Wassergas-Shift-Reaktion
Die Wassergas-Shift-Reaktion, kurz auch WGS oder Wassergas-Konvertierungsreaktion (historisch auch Kohlenoxid-Konvertierung), ist ein Verfahren zur Verringerung des Kohlenstoffmonoxid-Anteils in Synthesegas und zur Erzeugung von Wasserstoff. Die Reaktionsgleichung ist auch als Konvertierungsgleichgewicht bekannt.
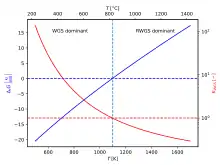
Unter Zugabe von Wasserdampf reagiert das CO zu CO2 und H2. Die Reaktionsenthalpie von −41,2 kJ/mol ist recht niedrig. Mit steigender Temperatur verschiebt sich das chemische Gleichgewicht von den Reaktionsprodukten hin zu den Reaktionsedukten. Bei ca. 1100 K (ca. 830 °C) beträgt die freie Enthalpie 0 kJ/mol, die Gleichgewichtskonstante beträgt 1.
Bei höherer Temperatur liegt eine schnelle Kinetik, aber ein ungünstiges chemisches Gleichgewicht vor. Eisen(III)-oxid-Katalysatoren beschleunigen die Umsetzung bei niedrigen Temperaturen von 250 bis 450 °C. In chemischen Reaktoren wird die Shift-Reaktion oft zweistufig durchgeführt: in einer Hochtemperatur- und Niedertemperatur-Shiftstufe (kurz: HT- und NT-Shift). Der CO-Gehalt lässt sich so je nach Fahrweise des Reaktors auf 0,6 bis 1,5 Vol.-% absenken.
Siehe auch
Literatur
- J. Pasel, et al.: Test of a water-gas-shift reactor on a 3 kWe-scale – design points for high- and low-temperature shift reaction. In: Journal of Power Sources 152 (2005) S. 189–195, doi:10.1016/j.jpowsour.2004.12.051
Weblinks
- Video: Thermodynamische Klassifizierung der Wassergas-Shift-Reaktion - exotherm, endotherm, exotrop, endotrop, exergonisch oder endergonisch. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15705.