Entner-Doudoroff-Weg
Der Entner-Doudoroff-Weg bzw. ED-Weg (nach den Entdeckern Nathan Entner und Michael Doudoroff[1] auch 2-Keto-3-desoxy-6-phosphogluconat-Weg oder KDPG-Weg genannt) ist ein Weg des Abbaus von Zuckern in Lebewesen zum Zweck der Energiegewinnung. Er kommt ausschließlich bei einigen Bakterien und – in modifizierter Form – auch in Archaeen vor. Der ED-Weg ist eine Alternative zum Embden-Meyerhof-Parnas-Weg (Glykolyse), der von den meisten anderen Lebewesen beschritten wird. Die Energieausbeute in Form von Adenosintriphosphat (ATP) beträgt nur 1 ATP, während sie beim Embden-Meyerhof-Parnas-Weg 2 ATP beträgt.

Glc-6-P = Glucose-6-phosphat
6-P-Glucono-δ-Lacton = 6-Phosphoglucono-δ-Lacton
6-P-Gluconat = 6-Phosphogluconat
KDPG = 2-Keto-3-desoxy-6-phosphogluconat
GAP = Glycerinaldehyd-3-phosphat
1,3-bPG = 1,3-Bisphosphoglycerat
3-PG = 3-Phosphoglycerat
2-PG = 2-Phosphoglycerat
PEP = Phosphoenolpyruvat
Pyr = Pyruvat
Biochemie
ED-Weg in Bakterien
In Bakterien wird bei dem Stoffwechselweg D-Glucose zunächst zu Glucose-6-phosphat unter ATP-Verbrauch aktiviert. Durch eine Glucose-6-phosphat-Dehydrogenase (EC 1.1.1.49) wird dieses zu 6-Phosphoglucono-δ-Lacton oxidiert, dabei wird NADPH gebildet. Das Lacton wird anschließend durch eine 6-Phosphoglucolactonase (EC 3.1.1.31) zu 6-Phosphogluconat hydrolysiert. Diese Schritte entsprechen den Anfangsreaktion im oxidativen Teil des Pentosephosphatweges. 6-Phosphogluconat wird dann durch eine Phosphogluconatdehydratase (EC 4.2.1.12) in die für den Stoffwechselweg charakteristische Verbindung 2-Keto-3-desoxy-6-phosphogluconat (KDPG) überführt. Eine KDPG-Aldolase (EC 4.1.2.14) spaltet dieses in Pyruvat und in Glycerinaldehyd-3-phosphat. Letzteres wird im Zuge der Glykolyse schließlich ebenfalls in Pyruvat überführt, wobei zwei Moleküle ATP und ein Molekül NADH gebildet werden.
In der Nettobilanz werden aus einem Molekül D-Glucose zwei Moleküle Pyruvat sowie Wasser, und jeweils ein Molekül NADPH, NADH sowie ATP gebildet:
Zuckertransport in die Zelle
Der Transport der D-Glucose erfolgt nicht über das Phosphoenolpyruvat-abhängige Zucker-Phosphotransferase-System vieler Bakterien, sondern über ein H+-Symportsystem.[2] Dadurch wird kein Molekül PEP pro transportierendes Molekül Glucose verbraucht und kann für Anabolismus verwendet werden.
Als einziger Prokaryot kann Zymomonas mobilis Glucose dagegen durch erleichterte Diffusion in die Zelle aufnehmen. Er lebt an Orten, an denen die Konzentration an Zuckern besonders hoch ist, beispielsweise im zuckerhaltigen Saft von Agaven.[3]
Modifizierte Formen in Archaeen und anderen Spezies
Zuckerabbauende Archaeen, und manch andere Organismen, nutzen neben modifizierten EMP-Wegen auch den ED-Weg zum Abbau von Glucose, wenngleich dieser im Vergleich zu Bakterien einige Unterschiede zeigt. Man hat in Archaeen drei verschiedene ED-Stoffwechselwege identifiziert, bei denen anfangs immer Glucose, und nicht Glucose-6-phosphat reduziert wird. Sie werden im Folgenden erläutert.
Nicht-phosphorylierender ED-Weg

In (hyper)thermoacidophilen Archaeen wie Sulfolobus solfataricus (reklassifiziert zu Saccharolobus solfataricus), Thermoproteus tenax (beide in der Klasse Thermoprotei, Phylum Crenarchaeota) und Thermoplasma acidophilum (zur Klasse Thermoplasmata [en], Phylum Euryarchaeota) wurde eine Variante des ED-Weges entdeckt, bei dem nicht KDPG entsteht.[4] Hierbei wird Glucose zunächst zu 2-Keto-3-desoxy-gluconat (KDG), nicht zu KDPG, umgesetzt, dabei entstehen wie beim bakteriellen ED-Weg NADH und NADPH (vgl. Abbildung). Es findet somit keine Phosphorylierung statt. KDG wird durch eine spezifische Aldolase zu Pyruvat und Glycerinaldehyd gespalten. Letzteres wird zu Glycerat (GA) oxidiert, was entweder eine NAD(P)+- oder eine Ferredoxin-abhängige Dehydrogenase katalysiert. Glycerat wird durch eine Kinase zu 2-Phosphoglycerat (2-PG) unter ATP-Verbrauch umgesetzt, und dann zu 3-Phosphoglycerat (3-PG) isomierisiert. Durch die oben beschriebenen glykolytischen Enzyme entsteht draus dann Pyrvuat.
Da bei diesem Stoffwechselweg kein Netto-ATP-Gewinn stattfindet, spricht man von einem nicht-phosphorylierenden ED-Weg.
Halbphosphorylierender ED-Weg
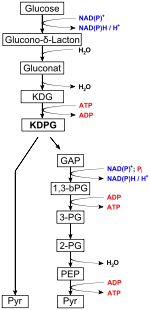
Einige Clostridienarten sowie halophile Archaeen wie beispielsweise Halobacterium saccharovorum und Halobacterium halobium (Phylum Euryarchaeota) nutzen eine ED-Variante, die man als halb(semi)phosphorylierend bezeichnet.[5][4] Dabei wird Glucose wie beim nicht-phosphorylierenden ED-Weg zu KDG umgesetzt (vgl. Abbildung). KDG wird vor Aldolspaltung zu KDPG durch eine KDG-Kinase phosphoryliert, wobei ein Molekül ATP investiert wird. Anschließend folgt die Aldolspaltung zu Pyrvuat und Glycerin-3-phosphat (GAP). Dieses wird dann anschließend in der Glykolyse zu Pyruvat umgesetzt, je nach Enzymausstattung entstehen entweder NADPH, NADH oder aber auch reduziertes Ferredoxin als Reduktionsmittel. Bei diesem Stoffwechselweg werden insgesamt ein Molekül ATP und zwei Moleküle Reduktionsäquivalente erzeugt.
Verzweigter ED-Weg
Die Crenarchaeota Sulfolobus und Thermoproteus betreiben anscheinend gleichzeitig den nicht- und den semi-phosphorylierenden ED-Weg, was man als einen verzweigten ED-Weg bezeichnet.[4] Dabei gibt es aber zwei Besonderheiten. Zum einen katalysiert eine bifunktionelle KDG/KDPG-Kinase die Aldolspaltung von KDG bzw. KDPG. Zum anderen wird das bei der Aldolspaltung von KDPG erzeugte GAP nicht durch eine klassische GAPDH oxidiert. Stattdessen wird es direkt durch eine nicht-phosphorylierende Glycerinaldehyddehydrogenase (GAPN) zu 3-Phosphoglycerat oxidiert. Da bei diesem Schritt kein ATP wie bei der klassischen Glykolyse durch Substratkettenphosphorylierung erzeugt wird, findet kein Netto-ATP-Gewinn beim verzweigten ED-Weg statt.
Bedeutung
Eine erhebliche Anzahl von Bakterien besitzt nicht die vollständige Ausstattung der Enzyme für den (klassischen) Embden-Meyerhof-Parnas-Weg der Glykolyse, beispielsweise fehlt die Phosphofructokinase-1. Dieses Enzym katalysiert eine der Anfangsreaktionen der Glykolyse. Daher sind sie auf Entner-Doudoroff-Weg angewiesen, um Glucose metabolisieren zu können. Andere Bakterien, wie z. B. Escherichia coli, nutzen sowohl diesen Weg als auch die klassische Form der Glykolyse. Der Entner-Doudoroff-Weg erlaubt nämlich die Verstoffwechslung von Gluconat bzw. anderer, verwandter organischer Säuren, die in die Glykolyse nicht eintreten können.[6]
Der Entner-Doudoroff-Weg wird auch beispielsweise bei der Alkoholischen Gärung des Bakteriums Zymomonas mobilis beschritten. Das gebildete Pyruvat wird dabei zu Acetaldehyd decarboxyliert und dieser mit dem aus Glucose-6-phosphat und Glycerinaldehyd-3-phosphat abgespaltenen Wasserstoff zu Ethanol reduziert. Industriell wird diese Gärung für die Herstellung von Pulque benutzt. Die Geschwindigkeit der Gärung und die Produkt-Ausbeute sind deutlich höher als bei der Alkoholischen Gärung durch Hefen, die Zucker über den Embden-Meyerhof-Parnas-Weg abbauen.
Literatur
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 3-13-444608-1, S. 204 ff.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag, Stuttgart 2008, ISBN 978-3-13-144861-3, S. 352 f.
Weblinks
Einzelnachweise
- N. Entner, M. Doudoroff: Glucose and gluconic acid oxidation of Pseudomonas saccharophila. In: J Biol Chem., 1952, 196(2), S. 853–862 (englisch); PMID 12981024; jbc.org (PDF).
- Garabed Antranikian: Angewandte Mikrobiologie. Springer, Berlin 2006; ISBN 978-3-540-24083-9; S. 51.
- Garabed Antranikian: Angewandte Mikrobiologie. Springer, Berlin 2006; ISBN 978-3-540-24083-9; S. 45.
- M. Reher et al: The nonphosphorylative Entner-Doudoroff pathway in the thermoacidophilic euryarchaeon Picrophilus torridus involves a novel 2-keto-3-deoxygluconate-specific aldolase. In: J Bacteriol., 2010, 192(4), S. 964–974; PMID 20023024.
- H. Ahmed et al.: The semi-phosphorylative Entner-Doudoroff pathway in hyperthermophilic archaea: a re-evaluation. In: The Biochemical journal, Band 390, September 2005, S. 529–540, doi:10.1042/BJ20041711, PMID 15869466, PMC 1198933 (freier Volltext).
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. 4. aktualisierte Auflage. Pearson Studium, 2008, ISBN 978-3-8273-7312-0, S. 474 ff.