Mesomerie
Als Mesomerie[1] (auch Resonanz oder Resonanzstruktur[2]) wird in der Chemie das Phänomen bezeichnet, dass die Bindungsverhältnisse in manchen Molekülen oder mehratomigen Ionen nicht durch eine einzige Strukturformel, sondern nur durch mehrere Grenzformeln dargestellt werden können. Keine dieser Grenzformeln beschreibt die Bindungsverhältnisse und damit die Verteilung der Elektronen in ausreichender Weise. Die tatsächliche Elektronenverteilung im Molekül bzw. Ion liegt zwischen den von den Grenzformeln angegebenen Elektronenverteilungen. Dies wird durch den Mesomeriepfeil (Resonanzpfeil) mit dem Symbol ↔ dargestellt. Der Mesomeriepfeil darf nicht mit dem Doppelpfeil Gleichgewichtspfeil ⇌ verwechselt werden, der ein chemisches Gleichgewicht kennzeichnet. Der Begriff der Mesomerie wurde 1933 von Christopher Kelk Ingold eingeführt.
Der wirkliche Zustand eines Moleküls, also der Zwischenzustand zwischen den Grenzstrukturen, wird als mesomerer Zustand bezeichnet.
Die Energiedifferenz zwischen den Grenzstrukturen und dem tatsächlichen mesomeren Zustand, die in vielen Fällen abgeschätzt werden kann, wird als Mesomerieenergie oder Resonanzenergie bezeichnet. Je mehr mesomere Grenzstrukturen ein Molekül oder Ion besitzt, desto stabiler ist es. Im Rahmen der Valenzstrukturtheorie (VB-Theorie) lassen sich die Eigenenergien der einzelnen Grenzstrukturen sowie deren Gewicht (d. h. deren Anteil an der Gesamtwellenfunktion) berechnen.[3]
Beispiel Benzol
| Benzol (C6H6) | |
| mesomere Grenzstrukturen | |
 | |
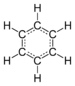
| delokalisierte Doppelbindungen | übliche Darstellung |
 |  |
| Mesomerieenergie | |
 | |
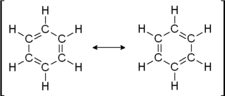
Ein Beispiel für eine mesomere Verbindung ist Benzol (siehe Abbildung). Auch andere Aromaten sind mesomere Verbindungen.
Gemäß der Oktettregel sind diejenigen Moleküle besonders stabil, bei denen jedes Atom von acht Valenzelektronen umgeben ist. Für das Benzol lassen sich zwei Strukturformeln aufstellen, bei denen dies der Fall ist (mesomere Grenzstrukturen).
Dass keine der beiden Grenzformeln des Benzols korrekt ist, lässt sich aus den Bindungslängen der Bindungen zwischen den Kohlenstoffatomen ableiten. Die durch Doppelbindungen miteinander verbundenen Kohlenstoffatome müssten geringere Abstände haben als jene, die nur durch eine einfache Atombindung miteinander verbunden sind. Das ist jedoch nicht der Fall. Die Bindungslängen zwischen den Kohlenstoffatomen betragen einheitlich 139 pm.
Im Benzolring verfügt jedes Kohlenstoffatom über vier Valenzelektronen, von denen zwei das Atom mit den benachbarten C-Atomen verbinden. Ein Elektron bindet das zugehörige Wasserstoffatom. Die verbleibenden sechs π-Elektronen ergeben formal drei π-Bindungen, wie sie in der Strukturformel mit drei Doppelbindungen ausgedrückt werden. In dem heute gültigen Orbitalmodell bilden die sechs π-Elektronen eine delokalisierte Ladungswolke (delokalisiertes 6-π-Elektronensystem) über und unter der Ebene des Kohlenstoffrings (Mehrzentrenbindung).
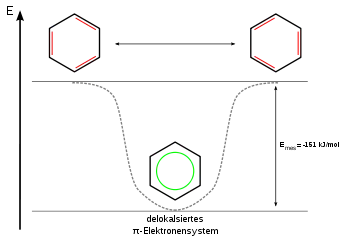
Daraus ergibt sich ein um 151 kJ/mol abgesenkter Energiezustand, welcher die Bindungsenergie um denselben Betrag erhöht, woraus eine größere Stabilität gegenüber den hypothetischen Grenzformeln (Cyclohexatrien) mit drei isolierten Doppelbindungen resultiert. Diese Energiedifferenz wird als Mesomerie- bzw. Resonanzenergie bezeichnet und ergibt sich aus der Differenz der Hydrierungsenergien des hypothetischen Cyclohexatriens und des Benzols.
Der gleiche Wert ergibt sich aus der Differenz der Verbrennungsenergien beider Verbindungen.
Es lässt sich allerdings auch eine andere Bezugssubstanz für die Mesomerieenergie benutzen. Im Falle des Vergleichs der Hydrierungsenergien bzw. Verbrennungsenergien von Benzol mit dem entsprechenden linearen Molekül (Hexatrien) ergibt sich ein etwas niedrigerer Wert. Diese Resonanzenergie wird als „Dewar Resonance Energy (DRE)“ bezeichnet.
Salze von Carbonsäuren und vinylogen Carbonsäuren
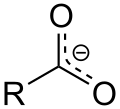
Ein ganz ähnlicher Fall eines delokalisierten Elektrons liegt bei den Salzen von Carbonsäuren wie etwa der Ameisen- und der Essigsäure vor, auch hier führt dies zur Mesomeriestabilisierung des Carboxylat-Anions (Ameisensäure: Formiat-Anion; Essigsäure: Acetat-Anion). Durch Einschieben einer oder mehrerer C=C-Doppelbindungen erhält man Salze vinyloger Carbonsäuren. Dabei geht die Mesomerie nicht verloren. Mesomeriestabilisiertes Carboxylat-Anion (oben) und vinyloges Carboxylat-Anion (unten):
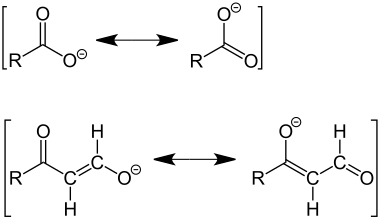
Im oberen Fall (Carboxylat-Anion) kann die Mesomerie durch die folgende Notation angedeutet werden:
Beispiele für vinyloge Carbonsäuren sind Ascorbinsäure (Vitamin C) und Vulpinsäure.
Siehe auch
Einzelnachweise
- Eintrag zu mesomerism. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.M03845 – Version: 2.1.5.
- Eintrag zu resonance. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.R05326 – Version: 2.1.5.
- Sason S. Shaik, Philippe C. Hiberty: A Chemist's Guide to Valence Bond Theory. John Wiley & Sons, 2007, ISBN 978-0-470-19258-0.