Anorganische Chemie
Die Anorganische Chemie (kurz: AC) oder Anorganik ist die Chemie aller kohlenstofffreien Verbindungen sowie einiger Ausnahmen (siehe Anorganische Stoffe). Ein Grenzgebiet zur organischen Chemie sind die Organometallverbindungen. Während die Organische Chemie diese nur als Hilfsmittel oder Reagenz benutzt, betrachtet die anorganische Chemie die Koordinationschemie der Metalle.
Historisch beschäftigte sich die anorganische Chemie mit Stoffen, die nicht von organischem Leben durch Lebenskraft erzeugt werden. Seit der Harnstoffsynthese 1828 von Friedrich Wöhler, bei der die organische Substanz Harnstoff aus der anorganischen Verbindung Ammoniumcyanat hergestellt wurde, verwischen sich die Grenzen zwischen Stoffen aus der unbelebten (den „anorganischen“ Stoffen) und der belebten Natur (den „organischen“ Stoffen). So stellen Lebewesen eine Vielzahl anorganischer Stoffe her, während im Labor inzwischen fast alle organischen Stoffe hergestellt werden können. Gleichwohl ist die moderne Unterscheidung nach wie vor sinnvoll, da sich die Reaktionsmechanismen und Stoffstrukturen in der Anorganik und Organik vielfach unterscheiden.
Geschichtliches zur anorganischen Chemie

Viele anorganische Stoffe und einige anorganische Stoffumsetzungen waren bereits im Altertum bekannt, etwa die Metallgewinnung aus Erzen wie Gold, Silber, Kupfer, Zinn, Blei, Eisen und Quecksilber. Andere Aspekte wie das Töpfergewerbe, die Glasbereitung in Ägypten, die Porzellanherstellung (China), die Mineralfarben (Bleiweiß, Mennige, Grünspan, Zinnober und Auripigment) wurden ebenfalls angewandt. Weiterhin war der Schwefel zum Räuchern, der Kalk als Mörtel für Wohnbauten, Salze wie Kochsalz zur Speisebereitung, Soda zur Herstellung von Glas und Seifen, Salpeter als Heilmittel und Alaun in Gerbereien bekannt.
Im alchemistischen Zeitalter, im 13. Jahrhundert, wurden Herstellungsmethoden zur Gewinnung von Schwefelsäure, verdünnter Salzsäure, Salpetersäure (Scheidewasser zur Auflösung von Silber aus Gold-Silberlegierungen) und Königswasser (Salz- und Salpetersäure zur Auflösung von Gold) von arabischen Alchemisten (Pseudo-Geber-Schriften) bekannt. Die Herstellungsverfahren von Säuren wurden später durch Johann Rudolph Glauber um 1650 deutlich verbessert, weiterhin entwickelte er ein Verfahren zur Gewinnung rauchender Salzsäure.
Robert Boyle beschrieb in seinem Hauptwerk The Sceptical Chemist in Abkehr von den aristotelischen Theorien der Alchemie eine Hinwendung zu experimenteller Forschung und Schlussfolgerungen auf Basis von Experimenten. Bedeutsam war seine These, dass die chemischen Elemente aus unzerteilbaren, gleichen, kleinen Atomen, chemische Verbindungen aus einer Vielzahl von kleinen, unterschiedlichen Elementen zusammengesetzt sind.
Georg Ernst Stahl und Johann Joachim Becher entwickelten um 1700 die Phlogistontheorie. Mit dieser Theorie, die sich 80 Jahre später als unrichtig herausstellte, konnten Verbrennungsvorgänge, Oxidationen und Reduktionen sowie die Gärung chemisch gedeutet werden. Ursache für die Fehldeutungen der Phlogistontheorie war ein damals noch unbekannter Stoff (Sauerstoff) in der Luft.
Joseph Priestley machte Studien mit der Luft und erkannte, dass in der Luft ein Stoff enthalten ist, der Atmungsvorgänge fördert und die Oxidation von Metallen zu Metalloxiden begünstigt. Aus Erhitzen von Quecksilber(II)-oxid konnte Priestley den Stoff – der Atmungs- und Verbrennungsvorgänge fördert – gasförmig gewinnen und den Gehalt dieses Stoffes in der Luft bestimmen. Erst Antoine Laurent de Lavoisier zog aus den Erkenntnissen von Priestley die Schlussfolgerung, dass dieser neu entdeckte Stoff (Sauerstoff) ein Element sein musste. Durch Lavoisiers Schlussfolgerungen wurde die Theorie der Elemente von Boyle bestätigt und die Elemente als eine Vielzahl gleicher, unteilbarer Atome betrachtet. Eine chemische Verbindung enthält mehrere unterschiedliche Elemente. Als reine Elemente wurden die Metalle Gold, Silber, Kupfer, Zinn, Blei, Zink sowie die nichtmetallischen Elemente Phosphor, Schwefel, Kohlenstoff, Sauerstoff, Stickstoff eingeordnet. Lavoisier erkannte ferner, dass bei jeder Stoffumsetzung die Summe der Gewichte von Ausgangs- und Endprodukten gleich bleibt (Massenerhaltungsgesetz). Die alten, alchemistischen Bezeichnungen von anorganischen Stoffen wurden durch eine rationale Bezeichnung mit den jeweiligen elementaren Bausteinen des Stoffgemisches geändert. Die Oxidationstheorie nach Lavoisier stellte eine bahnbrechende Neuerung in der Chemie dar, die nachfolgenden Chemiker mussten die reinen Elemente auffinden.
Nahezu zeitgleich erfolgte die Entdeckung des Stroms durch Luigi Galvani und Alessandro Volta. Durch diese Voltasche Säule ließ sich das Wasser in die Elemente Sauerstoff- und Wasserstoffgas zersetzen und die Zusammensetzung des Wassers durch Volumen- und Gewichtsbestimmung der beiden Gase genau bestimmen.
Humphry Davy konnte mit der Voltaschen Säule Natrium und Kalium als neue Elemente abscheiden. John Dalton stellte eine erste Atomgewichtstabelle für Elemente zusammen. Jöns Jacob Berzelius erfand ein Verfahren zur Bestimmung von sehr exakten Atomgewichten von Metallen und anderen Elementen und entwickelte die Formelsprache mit den ein oder zwei lateinischen Buchstaben zur Kennzeichnung der Elemente und bezog die relativen Atomgewichte auf Sauerstoff als Bezugspunkt. Amedeo Avogadro stellte die Hypothese auf, dass in gleich großen Räumen und bei gleicher Temperatur immer die gleiche Teilchenzahl eines Gases vorhanden sein muss.
In der Folgezeit gehörten die Suche nach neuen chemischen Elementen, die Bestimmung ihrer exakten relativen Atomgewichte und ihre Charakterisierung durch Reaktionen mit anderen Stoffen zu den Aufgaben der anorganischen Chemiker.
Joseph Louis Gay-Lussac entwickelte die Titration und konnte den quantitativen Gehalt einzelner Elemente in einer anorganischen Verbindung bestimmen. Später wurde die elektrogravimetrische Abscheidung zur Gehaltsbestimmung von Mineralproben genutzt. Robert Bunsen verbesserte die Methode der Stromerzeugung durch die Entwicklung einer Zink-Kohle-Batterie. In seinem Labor konnten die neuen Elemente Magnesium, Chrom und Strontium gewonnen werden. Die von Bunsen entwickelte Spektralanalyse führte zur Entdeckung der Elemente Caesium und Rubidium, später durch William Ramsay auch des Heliums.

Lothar Meyer und Dimitri Mendelejew sortierten die chemischen Elemente nach Atomgewicht und Bindungsfähigkeit in einem Periodensystem. So konnten leichter Voraussagen zum chemischen Verhalten von Elementen getroffen werden und noch unbekannte Elemente im System aufgesucht werden.
Svante Arrhenius, Jacobus Henricus van ’t Hoff und Wilhelm Ostwald erkannten, dass die Moleküle von Säuren, Basen und Salzen in wässrigen Lösungen als Ionen vorliegen. Die Entdeckung der Dissoziation von Salzen und Säuren war die Basis für wichtige neue Erkenntnisse (z. B. Reaktionsmechanismen, Kinetik) und Messmethoden (z. B. pH-Messung, Konduktometrie) in der Chemie.
Anorganische Stoffe
Zu den anorganischen Stoffen werden traditionell die Elemente und alle Verbindungen gezählt, die keinen Kohlenstoff enthalten.
Dazu kommen einige Ausnahmen von Kohlenstoffverbindungen, die genau wie typische anorganische Stoffe aufgebaut sind oder historisch der Anorganik zugeordnet werden. Hierzu gehören die wasserstofffreien Chalkogenide des Kohlenstoffs (Kohlenstoffmonoxid, Kohlenstoffdioxid, Schwefelkohlenstoff), die Kohlensäure und Carbonate, die Carbide sowie die ionischen Cyanide, Cyanate und Thiocyanate. Die Blausäure gilt als Grenzfall und wird sowohl in der Organik als auch Anorganik behandelt. Obwohl sie traditionell zur anorganischen Chemie gezählt würden, wird sie als Nitril (organische Stoffgruppe) der Ameisensäure aufgefasst.
Lehrbücher der anorganischen Chemie sind nach den chemischen Elementen des Periodensystems geordnet. In den Lehrbüchern werden das Vorkommen und die Gewinnung der Elemente oder Elementverbindungen aus Mineralien, Salzen, wässrigen Lösungen oder Gasen behandelt. Ferner werden wichtige Umwandlungen dieser Elemente mit anderen Elementen beschrieben.
Metalle


Von den etwa hundert Elementen des Periodensystems sind 76 % Metalle. Schon um 3000 bis 2000 v. Chr. gewannen Menschen aus Erzen Metalle wie Zinn, Kupfer, Silber und Eisen. Metalle wurden durch das hohe Erhitzen von mineralischen Erzen gewonnen. Bis auf Quecksilber sind alle Metalle bei Raumtemperatur fest und können durch Erwärmung verflüssigt werden. Die gute Formbarkeit von verflüssigten Metallen zur Herstellung von Gebrauchsgegenständen wird bis heute in großem Umfang genutzt. Metalleigenschaften sind die Leitfähigkeit für Wärme und Strom.
Seit dem 19. Jahrhundert können Metalle durch den elektrischen Strom (Elektrolyse und elektrolytische Raffination) gewonnen werden. Neue Metalle – wie das Aluminium und die Alkali- und Erdalkalimetalle – wurden dabei entdeckt. Für viele Anwendungsbereiche werden leichte Metalle wie das Aluminium oder das Titan benötigt, damit Flugzeuge, Automobile, Schienenfahrzeuge, Maschinen keinen übermäßigen Energieverbrauch aufweisen. Eisen ist aufgrund der hohen Härte und Temperaturbeständigkeit das meist verwendete Metall im Automobilbau. Die Oberfläche des Eisens neigt unter Feuchtigkeitseinfluss zur Rostbildung. Noch Anfang der 1980er Jahre wiesen viele Fahrzeuge eine deutliche Rostbildung auf. Zehn Jahre später hatten viele Fahrzeuge bereits eine rostschützende Verzinkung.
Metalle werden als Batterien und Akkumulatoren zur Stromgewinnung eingesetzt. In den preisgünstigen Zink-Kohle-Batterien wird während der Stromabgabe das Zink zum Zinksalz oxidiert. Weitere wichtige Batterien sind Nickel-Metallhydrid-Batterien (wiederaufladbar), Lithiumbatterien (sehr leichte Batterie) oder die preisgünstigen Blei-Bleioxid-Akkumulatoren (wiederaufladbar).
Legierungen von Metallen können mitunter bessere Eigenschaften als die reinen Elemente aufweisen. Das Duraluminium ist eine Mischung aus Magnesium, Kupfer und Aluminium, es weist eine höhere Härte als das reine Aluminium auf. Das Woodsche Metall ist eine Legierung aus Bismut, Blei, Cadmium und Zinn mit einem sehr geringen Schmelzpunkt, es wird für schmelzbare Formen genutzt. Weitere bedeutende Metalllegierungen sind Bronze aus Kupfer und Zinn, Messing aus Kupfer und Zink und Stahl, eine Eisenlegierungen mit unterschiedlichen Beimischungen.
Manche Metalle können sich mit Nichtmetallen zu Kristallstruktur mit neuen Eigenschaften verbinden. Das Silicium verbindet sich mit Germanium, Indium oder Arsen. Derartige Kristalle werden als Halbleiter (Dioden und Leuchtdioden) in der Elektronik genutzt. Andere Metalle – wie das Tantal – finden als Kondensatoren ein Anwendungsgebiet in der Elektronik.
Metalle oder Metallionen wirken bei Reaktionen in der Gasphase oder in einer Flüssigkeit als Katalysatoren, beispielsweise Eisen bei der Ammoniak- oder Aluminiumionen bei der Polyethylensynthese.
Salze, Mineralien
Das Wasser ist ein bedeutender Stoff der anorganischen Chemie, es hat kovalente, polarisierte Bindungen zwischen den Atomen und kann viele anorganische Salze gut lösen. Der Temperaturbereich zwischen Gefrier- und Siedepunkt des Wassers ermöglicht das Leben auf unserem Planeten durch die Löslichkeit von anorganischen und organischen Stoffen in flüssigem Wasser.
Anorganische Salze unterscheiden sich in ihrer Löslichkeit in Wasser. Aufgrund der unterschiedlichen Löslichkeit in Wasser lassen sich Salze durch Filtration vielfach trennen.
Die Mischung von zwei Salzen, die in Wasser löslich sind – z. B. Bariumchlorid und Natriumsulfat – kann zur Bildung eines schwerlöslichen Salzes führen (Bariumsulfat). Ist das Löslichkeitsprodukt eines Salzes gering, fällt es aus.
Viele Metallkationen bilden mit Sulfidanionen in einer Lösung schwer lösliche Sulfide. Durch eine richtige Wahl von Säuren und Basen können bestimmte Gruppen von chemischen Elementen als Sulfidniederschläge angereichert und bestimmt werden. In der analytischen Chemie ist die Sulfidfällung ein wichtiger Trennungsgang von Metallkationen.
Auch in Gesteinen und Mineralien sind Metallkationen enthalten. Die Metalle in Gesteinen liegen häufig als Silicate vor und diese sind in Wasser gar nicht löslich. Neben sehr starken Säuren nutzen Anorganiker den Sodaufschluss, um die Inhaltsstoffe der Gesteine zu lösen.
Beton: Silicate haben eine sehr große Bedeutung, beispielsweise die Aluminiumsilikate, die als Tonminerale bekannt sind. Durch vermischen diesen Tons mit Kalk entsteht Zement. Bei Vermischung von Kies, Steinschotter mit Zementmörtel entsteht Beton. Nahezu alle Wohngebäude in Deutschland enthalten zum Teil Beton.

Porzellan: Eine weitere Tonart ist das Kaolin. Mit Quarz und Feldspat wird der Ton durch Brennen zu Porzellan umgewandelt.
Glas: Wird Quarzsand durch Zusatz des Salzes Soda bei 1000 °C erhitzt, so entsteht Glas.
Schlecht lösliche Salze wurden und werden als Pigmente zur Färbung von Lacken genutzt.
Anorganische Salze haben eine große Bedeutung als Düngemittel. Diese Salze sind meist gut wasserlöslich. Mitunter ist bei der Düngung eine zu hohe Löslichkeit nicht immer wünschenswert. Ammoniumsulfat, Kaliumchlorid und Phosphatdünger (weniger gut wasserlöslich) erhöhen die Fruchtbarkeit der Böden erheblich.
Säuren und Basen
Sehr wichtige anorganische Säuren sind:
Wichtige anorganische Basen sind:
Die anorganischen Säuren und Basen werden zur Gewinnung von anorganischen Salzen und organischen Stoffen benötigt. Schwefelsäure ist mengenmäßig eine bedeutende Verbindung der gesamten Chemieindustrie. Durch anorganische Säuren werden Metalle in Salze zerlegt, und es bildet sich Wasserstoff. Das Wissen über Säuren und Basen hat sich durch die Dissoziations-Theorie erheblich erweitert.
Gase
Viele anorganische Stoffumsetzungen sind mit der Entwicklung von Gasen verbunden. Bei der Wasserelektrolyse entwickeln sich Wasserstoff- und Sauerstoffgas.
Bei der Chloralkali-Elektrolyse entstehen die Gase Wasserstoff und Chlor. Diese Gase können zum Chlorwasserstoffgas reagieren und es bildet sich mit Wasser die Salzsäure.
Durch das Verbrennen von Schwefel in der Luft entwickelt sich das Schwefeldioxidgas. Durch einen Katalysator (Kontaktverfahren mit Vanadiumoxid) können zwei Schwefeldioxidmoleküle mit einem weiteren Sauerstoffatom zum Schwefeltrioxid reagieren. In Wasser löst sich das Schwefeltrioxidgas zu Schwefelsäure.
Schwefelwasserstoff kann aus Pyrit (FeS2) und Salzsäure erzeugt werden. Kohlendioxid entsteht durch das Erhitzen von Calciumcarbonat beim Kalkbrennen zur Herstellung von Zement. Bei Erhärten nimmt der Zement wieder Kohlendioxid aus der Luft auf. Aus dem Luftstickstoff und Wasserstoffgas kann unter hohem Druck und bei 500 °C das Ammoniakgas nach dem Haber-Bosch-Verfahren hergestellt werden. Das Ammoniak lässt sich nach dem Ostwaldverfahren mit Sauerstoff zu Stickstoffmonoxid verbinden, das mit weiterem Sauerstoff zu Stickstoffdioxid reagiert. Gelöst in Wasser bildet sich dann die Salpetersäure.
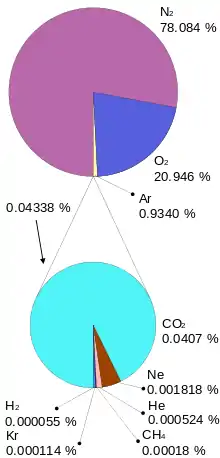
Sauerstoff, Stickstoff und Argon lassen sich aus der Luft nach dem Lindeverfahren gewinnen. Wachsendes wirtschaftliches Interesse zur Trennung einzelner Gase gewinnen auch Verfahren zu Gastrennung mittels sehr feinporiger Membranen (Gasmembran). Ein wichtiges Feld der Untersuchung von Gasen in der Luft ist die Atmosphärenchemie.
Sonstiges
Anorganische Kationen können in unterschiedlichen Oxidationsstufen als feste Salze oder in Lösung vorliegen. Dies hat zur Folge, dass sie unterschiedlich viele Anionen als Gegenionen besitzen können. In einer Lösung können Teilchen (Liganden) mit (z. B. Chlorid, Thiocyanat) oder ohne negative Ladung (beispielsweise Ammoniak oder Wasser durch freie Elektronenpaare) sich an Kationen anlagern und farbige Komplexe bilden. Es bilden sich Komplexe mit mehr – aus sterischen Gründen häufig vier bis sechs – Liganden am Kation, als die Oxidationszahl vorgibt. Die Ionen der Übergangsmetalle (Titan, Vanadium, Chrom, Mangan, Eisen, Kobalt, Nickel, Kupfer), die Elektronen auf der d-Schale besitzen, bilden mit Liganden vielfach farbige Komplexe. Das Kupfer(II)-ion bildet mit Ammoniak den blau gefärbten Kupfertetraminkomplex. Im Berliner Blau, dem Eisen(III)hexacyanoferrat, wird jedes Eisenion von sechs Cyanidionen als Liganden umgeben.
Die Ligandenfeldtheorie beschreibt die räumliche Koordination. Mit der Magnetochemie und über die Farbe der Lösung können Anorganiker Aussagen über die Koordination solcher Komplexe machen. Im Permanganatanion besitzt das Mangan(VII)-ion vier Sauerstoffatome als Liganden. Der gut gefärbte Komplex des Kaliumpermanganats dient zur quantitativen Gehaltsbestimmung in der Titrimetrie.
Auch organische Säuren wie EDTA (quantitative Bestimmung von Erdalkaliionen) oder Weinsäure oder Citronensäure (mit Kupfer(II) als Fehlingsche Lösung oder Benedicts Reagenz zur Bestimmung von oxidierbaren Zuckern) sowie Dioxime (Diacetyldioxim zur Nickelbestimmung) eignen sich als häufig farbgebende Liganden (genauer Chelate) für Kationen.
Anorganische Reaktionen
In der anorganischen Chemie spielt eine Vielzahl von Reaktionen eine Rolle. Die bedeutenden darunter sind die Redox-Reaktionen und die Säure-Base-Reaktionen. Diese Reaktionen sind immer Gleichgewichtsreaktionen, allerdings liegt das Gleichgewicht bei diesen Reaktionen häufig sehr stark auf einer Seite und es gibt eine hohe Reaktionsenthalpie. Dadurch sind viele Reaktionen in der Anorganik schnell und erreichen eine hohe Ausbeute. Im Gegensatz dazu sind in der organischen Chemie viele Reaktionen langsame Gleichgewichtsreaktionen, die nicht immer hohe Ausbeuten erreichen.
Bei Redox-Reaktionen werden Elektronen von einem Reaktionspartner auf den anderen übertragen. Typische Redoxreaktionen sind Reaktionen von Elementen zu Verbindungen. Die bekanntesten Redoxreaktionen sind die Knallgasreaktion von Wasserstoff und Sauerstoff zu Wasser und die Korrosion, bei der unedle Metalle (beispielsweise Eisen) mit Sauerstoff zu Oxiden reagiert.
Säure-Base-Reaktionen sind Reaktionen, bei denen Protonen übertragen werden. Die Säure gibt dabei an die Base (auch: Lauge) ein Proton ab. Bei Säure-Base-Reaktionen bilden sich meist Wasser und ein Salz (das bekannteste Beispiel ist die Reaktion von Salzsäure mit Natronlauge zu Natriumchlorid und Wasser). Da diese Reaktionen sehr schnell ablaufen und mit Indikatoren genau überprüft werden können, spielen sie eine große Rolle in der Analytischen Chemie.
In der anorganischen Chemie ist die Bildung unlöslicher Salze oder gasförmiger Verbindungen eine wichtige Triebkraft für Reaktionen, weil dabei Reaktionsprodukte das Gleichgewicht verlassen und somit die Reaktion vollständig in nur eine Richtung geht. So wird beim Zusammengießen einer Bariumchloridlösung und reichlich Natriumsulfatlösung in einer Fällungsreaktion sehr schwerlösliches Bariumsulfat ausgefällt, und zwar so vollständig, dass nach Abfiltrieren des Bariumsulfates keine Bariumionen mehr in der verbleibenden Natriumchloridlösung nachgewiesen werden können:
Als Beispiel für eine gerichtete Gleichgewichtsreaktion aufgrund entweichender Gase ist die Umsetzung von Ammoniumchlorid mit Natronlauge zu flüchtigem Ammoniak:
Solche Reaktionen spielen in der analytischen Chemie ebenfalls eine wichtige Rolle.
Verschiedene anorganische Verbindungen können bei höheren Temperaturen zerfallen, indem Gase entweichen. Ein Beispiel ist das Kalkbrennen, bei dem aus Calciumcarbonat Kohlendioxid entweicht und Calciumoxid zurückbleibt.
Teilgebiete der anorganischen Chemie
- Chemie der Metalle
- Chemie der Nichtmetalle
- Komplexchemie, einschließlich der Bioanorganischen Chemie
- Festkörperchemie
- Kristallographie
- Strukturchemie
- Metallorganische Chemie (steht zwischen anorganischer und organischer Chemie)
- Kolloidchemie
- Atmosphärenchemie
- Mineralsäuren
Technische Anwendungen

Die anorganische Chemie ist Basis vielfältiger technischer Anwendungen, beispielsweise
- Halbleiterchemie
- Mineralogie
- Metallurgie
- Herstellung von Eisen und Stählen
- Herstellung von Zement, Abbinden von Mörtel und Beton
- Herstellung von Keramiken
Anorganische Chemie in Schule und Studium
Schule
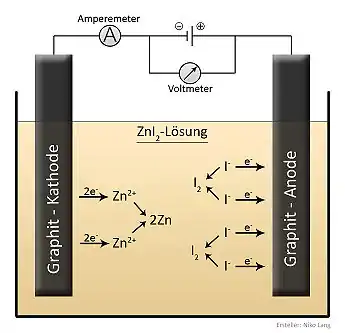
Im Schulunterricht bekommt der Schüler im Bereich der anorganischen Chemie Grundlagen der Atomtheorie, des chemischen Verhaltens von Elementen, die Oxidationszahlen der Elemente, die Eigenschaften von anorganischen Salzen (Farbreaktionen, Löslichkeiten), Fällungsreaktionen, die Ionentheorie, Säure-Base-Reaktionen, Gehaltsbestimmung durch Titration, Redox-Reaktionen, Elektrolysen und wichtige technische Verfahren geboten.
Studium
Im Studium wird das selbstständige wissenschaftliche Arbeiten in der anorganischen Chemie gelehrt. Der Chemiestudent lernt die Nachweisreaktionen für Kationen und Anionen aus unbekannten Proben kennen. Das Praktikum der anorganisch-analytischen Chemie teilt sich in die qualitative und quantitative Analyse von anorganischen Stoffen. Weiterhin wird die präparative Darstellung von anorganischen Stoffen gelehrt. Der Student lernt dabei die Beobachtungsgabe zu schärfen, sorgfältig zu arbeiten und methodisch, kombinatorisch zu denken.
Literatur

- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- D. F. Shriver, P. W. Atkins, C. H. Langford: Anorganische Chemie, 2. Auflage. Wiley-VCH, Weinheim 1997, ISBN 978-3-527-29250-9.
- J. Huheey, E. Keiter, R. Keiter: Anorganische Chemie – Prinzipien von Struktur und Reaktivität, 3. Auflage. Walter de Gruyter, Berlin – New York 2003, ISBN 3-11-017903-2.
- Lothar Kolditz (Hrsg.): Anorganikum – Lehr- und Praktikumsbuch der anorganischen Chemie; mit einer Einführung in die physikalische Chemie. Deutscher Verlag der Wissenschaften, Berlin 1967, 12. Auflage 1989; Johann Ambrosius Barth Verlag, Leipzig-Berlin-Heidelberg, 13. Auflage 1993. Russische Übersetzung: Mir Verlag, Moskva 1984.
- Comments on Inorganic Chemistry
Übungsbücher
- Ehrhard Uhlemann, Gerhard Röbisch: Fragen und Aufgaben zur Chemie. 3. Auflage. VEB Deutscher Verlag der Wissenschaften. Berlin 1988, ISBN 3-326-00275-0
Siehe auch
Weblinks
- Vorlesung Experimentalchemie I, Anorganische Chemie Videoaufzeichnungen einer Vorlesung. Von TIMMS, Tübinger Internet Multimedia Server der Universität Tübingen.