Essigsäureethylester
Essigsäureethylester, auch Ethylacetat oder oft kurz als Essigester bezeichnet, ist eine chemische Verbindung aus der Gruppe der Carbonsäureester. Es ist der Ester gebildet aus Essigsäure und Ethanol. Die farblose Flüssigkeit ist ein charakteristisch fruchtig riechendes[2] Lösungsmittel, das in der chemischen Industrie und in Laboratorien oft verwendet wird. Natürlich kommt Essigsäureethylester u. a. in der Moschus-Erdbeere[9] oder in Bananen[10] vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
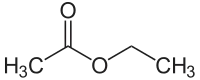 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Essigsäureethylester | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H8O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 88,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,894 g·cm−3 (25 °C)[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
77 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,372[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Veresterung
Eines der großtechnischen Herstellungsverfahren der chemischen Industrie beruht auf der säurekatalysierten Veresterung von Essigsäure mit Ethanol.
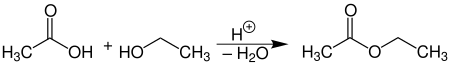
Diese Gleichgewichtsreaktion wird nach dem Prinzip von Le Chatelier (Prinzip vom kleinsten Zwang) durch fortlaufende Abtrennung des entstehenden Wassers oder kontinuierliches Abziehen des Esters auf die Seite der Produkte verlagert.
Tischtschenko-Reaktion
Eine weitere Möglichkeit zur Herstellung von Ethylacetat bietet die Tischtschenko-Reaktion. Danach wird Acetaldehyd bei Temperaturen von 0–5 °C in Gegenwart von Aluminiumtriethanolat-Lösung in einer Rührkesselkaskade umgesetzt.[11][12]
.svg.png.webp)
Bei 95%igem Umsatz erreicht die Selektivität von Ethylacetat etwa 96 % (bezogen auf Acetaldehyd). Das wesentliche Nebenprodukt ist Acetaldol, welches durch Aldoladdition von Acetaldehyd entsteht.
Das Produktgemisch wird in einer kontinuierlichen Destillationskolonne aufgetrennt und das Ethylacetat abdestilliert.[11][12]
Dieses Verfahren wird besonders in Regionen mit preisgünstiger Verfügbarkeit von Acetaldehyd (vor allem Europa und Japan) und in Ländern mit wirtschaftlich unattraktiven Ethanolpreisen durchgeführt.[12]
Eigenschaften
Physikalische Eigenschaften
Ethylacetat liegt unter Normalbedingungen als farblose, niedrigviskose und entzündbare Flüssigkeit vor. Der Schmelzpunkt liegt bei −83 °C,[2] wobei eine Schmelzenthalpie von 10,48 kJ·mol−1 realisiert wird.[13] Bei Normaldruck siedet die Verbindung bei 77 °C.[2] Die Verdampfungsenthalpie beträgt am Siedepunkt 31,94 kJ·mol−1.[14] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,22809, B = 1245,702 und C = −55.189 im Temperaturbereich von 289 K bis 349 K.[15] Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 54,26 kJ/mol, β = 0,2982 und Tc = 523,2 K im Temperaturbereich zwischen 298 K und 363 K beschreiben.[14]
| Eigenschaft | Typ | Wert | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−480,57 kJ·mol−1[16] −445,43 kJ·mol−1[16] |
als Flüssigkeit als Gas |
| Standardentropie | S0liquid S0gas |
259,4 J·mol−1·K−1[17] 362,75 J·mol−1·K−1[18] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −2235,4 kJ·mol−1[19] | |
| Wärmekapazität | cp | 168,94 J·mol−1·K−1 (25 °C)[3] 1,92 J·g−1·K−1 (25 °C)[3] 113,64 J·mol−1·K−1 (25 °C)[18] 1,29 J·g−1·K−1 (25 °C)[18] |
als Flüssigkeit als Gas |
| Kritische Temperatur | Tc | 523,2 K[14] | |
| Kritischer Druck | pc | 38,82 bar[20] | |
| Kritische Dichte | ρc | 3,497 mol·l−1[21] | |
| Azentrischer Faktor | ωc | 0,36641[22] | |
 Dampfdruckfunktion von Ethylacetat
Dampfdruckfunktion von Ethylacetat Temperaturabhängigkeit der Verdampfungsenthalpie von Ethylacetat
Temperaturabhängigkeit der Verdampfungsenthalpie von Ethylacetat
In 100 ml Wasser lösen sich ca. 8 ml Essigsäureethylester bei 20 °C. Die Verbindung bildet mit Wasser und vielen organischen Lösungsmitteln azeotrope Gemische. Das Azeotrop mit Wasser enthält bei Normaldruck 8,43 % Wasser und siedet bei 70,38 °C.[23] Die Azeotropzusammensetzung und der Azeotropsiedepunkt ist druckabhängig. Mit sinkendem Druck sinkt der Wassergehalt im azeotropen Gemisch, sowie dessen Siedepunkt.[23]
| p in Torr | 25 | 50 | 75 | 100 | 200 | 300 | 400 | 500 | 600 | 700 | 760 | 800 | 900 | 1000 | 1100 | 1200 | 1300 | 1400 | 1500 |
| p in mbar | 33 | 67 | 100 | 133 | 267 | 400 | 533 | 667 | 800 | 933 | 1013 | 1067 | 1200 | 1333 | 1467 | 1600 | 1733 | 1866 | 2000 |
| x(H2O) in % | 3,60 | 4,00 | 4,36 | 4,70 | 5,79 | 6,56 | 7,11 | 7,54 | 7,92 | 8,25 | 8,43 | 8,54 | 8,80 | 9,04 | 9,26 | 9,47 | 9,67 | 9,86 | 10,04 |
| Tb in °C | −1,89 | 10,0 | 17,4 | 23,0 | 37,6 | 46,8 | 53,8 | 59,4 | 64,1 | 68,2 | 70,4 | 71,8 | 75,1 | 78,2 | 81,0 | 83,5 | 85,9 | 88,2 | 90,3 |
wobei 1 Torr ≈ 133,322 Pa entspricht und 760 Torr in etwa der Normaldruck auf Meereshöhe ist.
Die azeotropen Zusammensetzungen und Siedepunkte mit weiteren organischen Lösungsmitteln finden sich in der folgenden Tabelle. Keine Azeotrope werden mit Toluol, Benzol, n-Propanol, n-Butanol, iso-Butanol, sec-Butanol, Aceton, 1,4-Dioxan, Methylacetat und Isopropylacetat gebildet.[24]
| Lösungsmittel | n-Hexan | Cyclohexan | Methanol | Ethanol | 2-Propanol | |
| Gehalt Ethylacetat | in Ma% | 38 | 54 | 56 | 69 | 75 |
| Siedepunkt | in °C | 65 | 72 | 62 | 72 | 76 |
| Lösungsmittel | Chloroform | Tetrachlorkohlenstoff | Butanon | Schwefelkohlenstoff | Acetonitril | |
| Gehalt Ethylacetat | in Ma% | 72 | 43 | 82 | 3 | 77 |
| Siedepunkt | in °C | 78 | 75 | 77 | 46 | 75 |
Sicherheitstechnische Kenngrößen
Ethylacetat bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −4 °C. Der Explosionsbereich liegt zwischen 2 Vol.‑% (73 g/m3) als untere Explosionsgrenze (UEG) und 12,8 Vol.‑% (470 g/m3) als obere Explosionsgrenze (OEG).[25] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −6 °C[2] sowie einen oberen Explosionspunkt von 25 °C. Die Explosionsgrenzen sind druckabhängig. Eine Erniedrigung des Druckes führt zu einer Verkleinerung des Explosionsbereiches. Die untere Explosionsgrenze ändert sich bis zu einem Druck von 100 mbar nur wenig und steigt erst bei Drücken kleiner als 100 mbar an. Die obere Explosionsgrenze verringert sich mit sinkendem Druck analog.[26]
| Druck | in mbar | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25 |
| Untere Explosionsgrenze (UEG) | in Vol.‑% | 1,7 | 1,8 | 1,8 | 1,8 | 1,9 | 1,9 | 2,0 | 2,1 | 2,2 | 2,8 | 3,5 |
| in g·m−3 | 62 | 63 | 64 | 65 | 67 | 69 | 71 | 74 | 79 | 102 | 126 | |
| Obere Explosionsgrenze (OEG) | in Vol.‑% | 12,8 | 12,6 | 12,2 | 11,8 | 11,6 | 11,6 | 11,6 | 11,4 | 11,4 | 9,9 | 8,1 |
| in g·m−3 | 468 | 461 | 448 | 433 | 426 | 419 | 419 | 426 | 426 | 364 | 295 | |
Die Sauerstoffgrenzkonzentration liegt bei 20 °C bei 9,8 Vol.‑%,[25] bei 100 °C bei 9,4 Vol%.[27] Der maximale Explosionsdruck beträgt 9,5 bar.[25] Der maximale Explosionsdruck verringert sich mit sinkenden Ausgangsdruck.[26]
| Druck | in mbar | 1013 | 800 | 600 | 300 | 200 | 150 | 100 |
| Maximaler Explosionsdruck (in bar) | bei 20 °C | 9,2 | 7,1 | 5,4 | 2,6 | 1,8 | 1,4 | 1,1 |
Die Grenzspaltweite wurde mit 0,95 mm (50 °C) bestimmt.[25] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[25] Mit einer Mindestzündenergie von 0,46 mJ sind Dampf-Luft-Gemische extrem zündfähig.[28] Die Zündtemperatur beträgt 470 °C.[25] Der Stoff fällt somit in die Temperaturklasse T1. Die Zündtemperatur sinkt mit steigendem Druck wesentlich ab.[29] Die elektrische Leitfähigkeit liegt mit <1·10−7 S·m−1 im mittleren Bereich für flüssige Stoffe.[28]
| Druck | in bar | 1,0 | 1,5 | 2,5 | 6,2 | 12,4 |
| Zündtemperatur | in °C | 470 | 350 | 300 | 240 | 220 |
Entsprechend den Gefahrgutvorschriften ist Ethylacetat der Klasse 3 (Entzündbare flüssige Stoffe) mit der Verpackungsgruppe II (mittlere Gefährlichkeit) zugeordnet (Gefahrzettel: 3).[2]
Verwendung

Essigsäureethylester ist ein vielseitig einsetzbares Lösemittel. Essigsäureethylester wird als Extraktionsmittel benutzt, z. B. zur Entkoffeinierung von Kaffeebohnen oder als natürlicher Aromastoff für Frucht- und Brandynoten[30] für die Aromatisierung von Limonaden, Bonbons und Arzneimitteln. In Rum und einigen anderen Spirituosen ist es von Natur aus in geringen Mengen vorhanden. Auch im Wein kommt es in geringen Mengen vor, besonders wenn die Trauben durch Hagel oder Fäulnis geschädigt wurden; es verursacht dann einen Lösungsmittelton im Wein.
Aufgrund seiner starken Lösungskraft findet Essigsäureethylester auch als Bestandteil von Nagellackentfernern und Verdünnern Verwendung und hat dort Aceton als Lösemittel weitestgehend ersetzt.[31] In Klebstoffen ist es eines der am häufigsten eingesetzten Lösungsmittel. In hoher Konzentration wirkt es als Rauschmittel, das zum Schnüffeln verwendet wird.
In der Stromspeichertechnologie wird Ethylacetat als Elektrolyt verwendet. Der Vorteil organischer Flüssigkeiten gegenüber wässerigen Elektrolyten ist die gute Funktionsfähigkeit bei tiefen Temperaturen. Der Nachteil ist die wesentlich geringere Energiedichte.
In der Entomologie ist es das am häufigsten eingesetzte Tötungsmittel bei der Präparation von Insekten.
Einzelnachweise
- Eintrag zu ETHYL ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Ethylacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Februar 2018. (JavaScript erforderlich)
- M. Pintos, R. Bravo, M. C. Baluja, M. I. Paz Andrade, G. Roux-Desgranges, J.-P. E. Grolier: Thermodynamics of alkanoate + alkane binary mixtures. Concentration dependence of excess heat capacities and volumes. In: Canadian Journal of Chemistry. 66, 1988, S. 1179–1186, doi:10.1139/v88-193.
- Zhang, X. M., Bordwell, F. G., van der Puy, M.; Fried, H. E., "Equilibrium acidities and homolytic bond dissociation energies of the acidic carbon-hydrogen bonds in N-substituted trimethylammonium and pyridinium cations", J. Org. Chem., (1993) 58, 3060–3066. doi:10.1021/jo00063a026
- CRC Handbook of Tables for Organic Compound Identification. 3. Auflage. 1984, ISBN 0-8493-0303-6.
- Eintrag zu Ethyl acetate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 141-78-6 bzw. Ethylacetat), abgerufen am 14. September 2019.
- Eintrag zu Ethylacetat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- Friedrich Drawert, Roland Tressl, Günter Staudt, Hans Köppler: Gaschromatographisch-massenspektrometrische Differenzierung von Erdbeerarten. In: Zeitschrift für Naturforschung C. 28, 1973, S. 488–493 (PDF, freier Volltext).
- R. Tressl, F. Drawert, W. Heimann, R. Emberger: Notizen: Gasehromatographische Bestandsaufnahme von Bananen-Aromastoffen. In: Zeitschrift für Naturforschung B. 24, 1969, S. 781–783 (online).
- Manfred Fedtke, Wilhelm Pritzkow, Gerhard Zimmermann: Technische Organische Chemie – Grundstoffe, Zwischenprodukte, Finalprodukte, Polymere. 1. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1992, ISBN 3-342-00420-7.
- Hans-Jürgen Arpe: Industrielle Organische Chemie – Bedeutende Vor- und Zwischenprodukte. 6. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6.
- W. E. Acree, Jr.: Thermodynamic properties of organic compounds: enthalpy of fusion and melting point temperature compilation. In: Thermochim. Acta. 189, 1991, S. 37–56. doi:10.1016/0040-6031(91)87098-H
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, ISBN 0-632-01529-2.
- J. Polak, I. Mertl: Saturated Vapour Pressure of Methyl Acetate, Ethyl Acetate, n-Propyl Acetate, Methyl Propionate, and Ethyl Propionate. In: Collect Czech Chem Commun. 30, 1965, S. 3526–3528, doi:10.1135/cccc19653526.
- K. B. Wiberg, L. S. Crocker, K. M. Morgan: Thermochemical studies of carbonyl compounds. 5. Enthalpies of reduction of carbonyl groups. In: J. Am. Chem. Soc. 113, 1991, S. 3447–3450, doi:10.1021/ja00009a033.
- G. S. Parks, H. M. Huffman, M. Barmore: Thermal data on organic compounds. XI. The heat capacities, entropies and free energies of ten compounds containing oxygen or nitrogen. In: J. Am. Chem. Soc. 55, 1933, S. 2733–2740, doi:10.1021/ja01334a016.
- D. R. Stull, Jr.: The Chemical Thermodynamics of Organic Compounds. Wiley, New York 1969.
- M. E. Butwill, J. D. Rockenfeller: Heats of combustion and formation of ethyl acetate and isopropyl acetate. In: Thermochim. Acta. 1, 1970, S. 289–295, doi:10.1016/0040-6031(70)80033-8.
- D. Ambrose, J. H. Ellender, H. A. Gundry, D. A. Lee, R. Townsend: Thermodynamic properties of organic oxygen compounds. LI. The vapour pressures of some esters and fatty acids. In: J. Chem. Thermodyn. 13, 1981, S. 795–802. doi:10.1016/0021-9614(81)90069-0
- S. Young, G. L. Thomas: The vapour pressures, molecular volumes, and critical constants of ten of the lower esters. In: J. Chem. Soc. 63, 1893, S. 1191.
- J. Schmidt: Auslegung von Sicherheitsventilen für Mehrzweckanlagen nach ISO 4126-10. In: Chem. Ing. Techn. 83, 2011, S. 796–812. doi:10.1002/cite.201000202
- R. W. Merriman: The Azeotropic Mixtures of Ethyl Acetate, Ethyl Alcohol and Water at Pressures Above and Below the Atmospheric Pressure. Part 1. In: J. Chem. Soc. Trans. 103, 1913, S. 1790–1801.
- I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 227–229.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003, ISBN 3-89701-745-8.
- D. Pawel, E. Brandes: Abschlussbericht zum Forschungsvorhaben Abhängigkeit sicherheitstechnischer Kenngrößen vom Druck unterhalb des atmosphärischen Druckes. (Memento vom 2. Dezember 2013 im Internet Archive), Physikalisch-Technische Bundesanstalt (PTB), Braunschweig 1998.
- P. M. Osterberg, J. K. Niemeier, C. J. Welch, J. M. Hawkins, J. R. Martinelli, T. E. Johnson, T. W. Root, S. S. Stahl: Experimental Limiting Oxygen Concentrations for Nine Organic Solvents at Temperatures and Pressures Relevant to Aerobic Oxidations in the Pharmaceutical Industry. In: Org. Process Res. Dev. 19, 2015, S. 1537–1542. doi:10.1021/op500328f
- Technische Regel für Betriebssicherheit - TRBS 2153, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen. Stand April 2009, Jedermann-Verlag, Heidelberg.
- Möller, W.; Sturm, R.: DECHEMA-Datenbank ChemSafe, abgerufen am 8. November 2017.
- Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 82, doi:10.1002/14356007.a11_141.
- [https://www.researchgate.net/profile/Anupam-Das-31/publication/330976621_The_science_of_nail_polish_nail_polish_remover_and_nail_moisturizers_A_Comprehensive_Approach/links/5e0104fc299bf10bc3741728/The-science-of-nail-polish-nail-polish-remover-and-nail-moisturizers-A-Comprehensive-Approach.pdf The science of nail polish, nail polish remover, and nail moisturizers] abgerufen am 2. August 2021

