Aldehyde
Aldehyde (aus neulateinisch alcoholus dehydrogenatus,[1] „dehydrierter Alkohol“ oder „Alkohol, dem Wasserstoff entzogen wurde“) sind chemische Verbindungen mit der funktionellen Gruppe –CHO, die Aldehydgruppe oder auch Formylgruppe genannt wird. Die Carbonylgruppe der Aldehyde trägt im Unterschied zu den Ketonen einen Wasserstoff- und einen Kohlenstoffsubstituenten. Eine Ausnahme bildet der einfachste Aldehyd Methanal (Formaldehyd), der zwei Wasserstoffsubstituenten trägt. Aldehyde mit einem Alkylrest (also Alkan-Derivate) werden als Alkanale bezeichnet; deren homologe Reihe leitet sich nomenklatorisch entsprechend von der homologen Reihe der Alkane ab. Weiter existieren Mehrfachaldehyde – wie beispielsweise das Glyoxal, der einfachste Dialdehyd.
| Aldehyde |
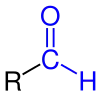 |
| Allgemeine Struktur eines Aldehyds. Der Rest R kann ein Wasserstoffatom oder ein Organyl-Rest (Alkyl-, Aryl-, Alkenyl-Rest etc.) sein. Die Aldehydgruppe (Formylgruppe) ist blau gekennzeichnet. |
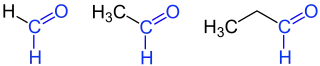 |
| Beispiele: Formaldehyd (Methanal, links), Acetaldehyd (Ethanal, Mitte) und Propionaldehyd (Propanal, rechts) mit blau gekennzeichneter Aldehydgruppe (Formylgruppe) |
Nomenklatur
Aldehyde erhalten nach der IUPAC-Nomenklatur den Namen des Alkans mit derselben Anzahl an Kohlenstoff-Atomen mit dem Suffix -al oder -carbaldehyd. Dementsprechend heißt der vom Methan abgeleitete Aldehyd Methanal, der vom Ethan abgeleitete Ethanal. Falls eine andere funktionelle Gruppe eine höhere Priorität aufweist, wird das Präfix „Formyl-“ verwendet. Ist die Verbindung hingegen ein Naturstoff oder eine Carbonsäure, so wird das Präfix „Oxo-“ gewählt.
Der Trivialname leitet sich von der lateinischen Bezeichnung für die bei Hinzufügen eines Sauerstoffatoms jeweils entstehende Carbonsäure her. Für Methanal (H–CHO) ist das die Methansäure (lat. acidum formicum, H–COOH), daher Formaldehyd, für Ethanal die Ethansäure (lat. acidum aceticum, CH3–COOH), daher Acetaldehyd. Entsprechend leiten sich die anderen Trivialnamen ab. Dicarbonsäuren, bei denen eine Carbonsäuregruppe zu einer Aldehydgruppe reduziert wurde, werden gelegentlich Semialdehyde genannt.
Homologe Reihe der Alkanale
| Anzahl (C-Atome) | IUPAC- Bezeichnung | Trivialnamen | Summenformel | Strukturformel | Siedepunkt in °C[2] |
|---|---|---|---|---|---|
| 1 | Methanal | Formaldehyd | CH2O | −19,1 | |
| 2 | Ethanal | Acetaldehyd | C2H4O | 20,1 | |
| 3 | Propanal | Propionaldehyd Propylaldehyd | C3H6O | 48 | |
| 4 | Butanal | n-Butyraldehyd | C4H8O | 74,8 | |
| 5 | Pentanal | Valeraldehyd Amylaldehyd n-Pentaldehyd | C5H10O | 103 | |
| 6 | Hexanal | Capronaldehyd n-Hexaldehyd | C6H12O | 131 | |
| 7 | Heptanal | Önanthaldehyd Heptylaldehyd n-Heptaldehyd | C7H14O | 152,8 | |
| 8 | Octanal | Caprylaldehyd n-Octylaldehyd | C8H16O | 171 | |
| 9 | Nonanal | Pelargonaldehyd n-Nonylaldehyd | C9H18O | 191 | |
| 10 | Decanal | Caprinaldehyd n-Decylaldehyd | C10H20O | 208,5 | |
| 11 | Undecanal | Hendecanal n-Undecylaldehyd | C11H22O | 117(18 mbar) | |
| 12 | Dodecanal | Laurinaldehyd Dodecylaldehyd | C12H24O | 238 | |
| 14 | Tetradecanal | Myristylaldehyd Tetradecylaldehyd | C14H28O | 260 |
Die allgemeine Summenformel der Alkanale lautet CnH2nO (n = 0, 1, 2, 3, 4, …).
Daneben gibt es auch viele weitere Gruppen von Aldehyden, für die meistens historische Namen benutzt werden:
Eigenschaften
Zwischen den Aldehydgruppen von Alkanalen kommt es zu Dipol-Dipol-Kräften, da die C=O-Doppelbindung sehr polar ist. Wasserstoffbrückenbindungen bilden sich nicht, weil kein sauerstoffgebundenes Wasserstoffatom vorhanden ist. Deswegen liegen die Siedepunkte der Aldehyde zwischen denen der Alkohole und Alkane. Mit Wasser können Aldehyde Wasserstoffbrückenbindungen eingehen, weil das Sauerstoffatom zwei freie Elektronenpaare hat und negativ polarisiert ist. Deswegen sind kurzkettige Aldehyde gut wasserlöslich. Bei längerkettigen Aldehyden überwiegt die Wirkung der unpolaren Alkylreste, was die Verbindungen unlöslich in Wasser macht. Viele Aldehyde haben einen charakteristischen Geruch.
Vorkommen
Aldehyde sind als Aromastoffe in Lebensmitteln, wie im Wein, weit verbreitet. Oft entstehen diese in Obst und Gemüse aus Öl-, Linol- oder Linolensäure-haltigen Stoffen bei der Ernte, Zerkleinerung oder Zubereitung. Hexanal findet sich z. B. in Äpfeln, Birnen, Pfirsichen und in der Kirsche. (E)-2-Hexenal findet sich in Äpfeln, Pfirsichen, Kirschen und Pflaumen, das isomere (Z)-2-Hexenal in Äpfeln, Birnen, Orangen und Erdbeeren. (Z)-3-Nonenal kommt in Gurken neben (E,E)-2,4-Nonadienal, (E,Z)-2,6-Nonadienal und (Z,Z)-3,6-Nonadienal als geruchsgebender Aromastoff vor.[4]
Oberhalb einer bestimmten Konzentration werden derartige Carbonylverbindungen allerdings oft als ranzig, fischig, metallisch oder als kartonartige Aromen bewertet und verursachen insgesamt einen Altgeschmack.[4]
Herstellung
Durch milde Oxidation von primären Alkoholen in nichtwässrigem Medium entstehen Aldehyde. Sie können weiter zu Carbonsäuren oxidiert werden.
Das technisch wichtigste Verfahren zur Herstellung von Aldehyden ist die Oxo-Synthese, auch Hydroformylierung genannt. Dabei wird ein Alken mit einem Gemisch aus Kohlenmonoxid und Wasserstoff in Gegenwart eines geeigneten Katalysators zur Reaktion gebracht:
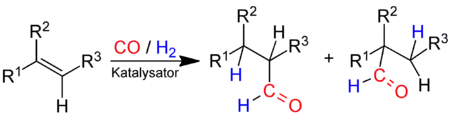
und des i-Aldehyds (rechts).
Verwendung
Formaldehyd (Methanal) wird in großen Mengen (weltweit 21 Mio. Tonnen pro Jahr) produziert, mehr als jeder andere Aldehyd. Er wird als Desinfektionsmittel, als Konservierungsmittel für verderbliche Güter wie Kosmetika (Formalinlösung) und als Rohstoff in der chemischen Industrie verwendet. Die größten Mengen wurden bis 1990 in der Kunststoffindustrie zu Aminoplasten und Phenoplasten weiterverarbeitet. In der Medizin wird Methanal in 4–8%iger Lösung (Formalin) als Fixierungsmittel in der Histotechnik verwendet.

Eau de Parfum (1924)
Aldehyde und Ketone werden außerdem zur Herstellung von Kunststoffen, Lösungsmitteln, Farbstoffen, Gerbstoffen, Parfums und Medikamenten verwendet. Ausgehend von Acrolein wird DL-Methionin, ein Futtermittelzusatzstoff, in Mengen von mehr als 100.000 Tonnen pro Jahr hergestellt.
In der Medizin werden Formaldehyd und Glutaraldehyd als Flächen- und Instrumentendesinfektionsmittel eingesetzt. Beide Aldehyde haben eine gute Wirksamkeit gegen viele verschiedene Mikroorganismen. Insbesondere unbehüllte Viren und sporenbildende Bakterien (z. B. Milzbrand), die nur wenigen Desinfektionsmitteln zugänglich sind, können so erreicht werden. Da Aldehyde irritierend auf Haut und Schleimhäute wirken und gelegentlich Allergien auslösen, muss mit diesen Mitteln sorgfältig umgegangen werden.[5]
In der Parfumherstellung werden Aldehyde seit 1921 eingesetzt (Chanel No. 5).
Physiologische Bedeutung
Im Stoffwechsel der Zellen findet sich eine Reihe von Aldehyden. Eine besondere Rolle spielt Acetaldehyd (Ethanal), der im Verlauf des Ethanolabbaus entsteht und an der Entstehung des sogenannten Alkohol-Katers beteiligt ist.
Nachweise
Spektroskopie von Aldehyden
In IR-Spektren von Aldehyden und Ketonen findet man die intensive charakteristische Bande der C=O-Valenzschwingung im Bereich von 1690–1750 cm−1.
In 13C-NMR-Spektren findet man das Signal des Carbonylkohlenstoffatoms von Aldehyden und Ketonen in einem Bereich von 195 und 210 ppm. Das dazugehörige Proton der Aldehydgruppe ist in 1H-NMR-Spektren als scharfes Signal bei etwa 10 ppm zu finden. Diese Eigenschaft macht die Identifikation mittels NMR-Spektroskopie besonders einfach, da in diesem hohen Bereich nur wenige Protonen eine Resonanz aufweisen.[6]
Reaktionen
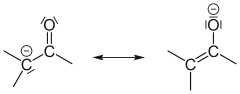
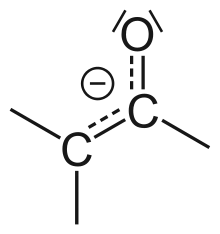
Aldehyde sind reaktive Verbindungen und lassen sich sehr leicht zur Carbonsäure oxidieren.
- Die C=O-Bindung der Carbonylgruppe ist stark polar mit der positiven Partialladung (δ+) am Kohlenstoffatom, an dem nukleophil angegriffen werden kann.
- Aldehyde mit einem Wasserstoffatom, gebunden an das α-Kohlenstoffatom direkt neben der Carbonylgruppe, können in der Keto- und der Enolform vorliegen – siehe dazu Keto-Enol-Tautomerie.
- Bei Aldehyden beobachtet man, dass Wasserstoffatome am zur Carbonylgruppe benachbarten C-Atom deutlich acider sind als Wasserstoffatome an „normalen“ C-Atomen. Dies liegt zum einen daran, dass der Carbonylkohlenstoff sehr elektronenarm ist und einen −I-Effekt auf benachbarte Bindungen ausübt, zum anderen kann nach Deprotonierung die negative Ladung auf den Sauerstoff der Carbonylgruppe delokalisiert werden (−M-Effekt).
Nukleophile Addition
Nach Angriff des Nukleophils geht das π-Elektronenpaar gänzlich zum inzwischen negativ geladenen Sauerstoff. Im protischen Lösungsmittel wird dies durch Protonenaufnahme ausgeglichen, wodurch eine OH-Gruppe anstelle der Carbonylgruppe entsteht.
Addition von Wasser
Wasser + Aldehyd ⇒ Aldehydhydrat (geminales Diol)
Aldehyde stehen in wässriger Lösung mit dem entsprechenden gem-Diol, das heißt einem Kohlenwasserstoff mit zwei Hydroxygruppen an einem Kohlenstoffatom, im Gleichgewicht. In der Regel liegt das Gleichgewicht auf der Seite des Aldehyds. Im Falle des Trichloracetaldehyds liegt das Gleichgewicht jedoch auf der Seite des geminalen Diols.
Addition von Alkoholen
Alkohol + Aldehyd ⇒ Halbacetal
Halbacetal + Alkohol ⇒ Acetal + Wasser
Beispiel: Ringschluss von Traubenzucker (Glucose)
Siehe auch: Acetalbildung
Addition von Stickstoff-Nukleophilen
Prim. Amin + Aldehyd ⇒ Imin (Schiffsche Base) + Wasser
Sec. Amin + Aldehyd ⇒ Enamin + Wasser
Oxidation zur Carbonsäure (wichtig für Nachweise)
Aldolreaktion
Das CH-acide H-Atom in der α-Position kann durch Basen abgespalten werden. Das entstandene Enolatanion addiert an den Carbonylkohlenstoff eines weiteren Aldehyd-Moleküls. Es entsteht ein Aldol, ein Additionsprodukt aus Alkohol (OH-Gruppe) und Aldehyd. Auf diese Weise können C-C-Bindungen geknüpft werden. Wird das gebildete Aldol anschließend dehydratisiert, spricht man von Aldolkondensation, dabei entstehen α,β-ungesättigte Aldehyde.
Gemischte Aldolreaktion
Gemischte Aldolreaktionen sind in der Regel nicht in einer Eintopfreaktion durchführbar, da sich vier mögliche Produkte bilden können und auch bilden. Eine Ausnahme ist, wenn einer der beiden Aldehyde nicht enolisierbar ist, das heißt kein CH-acides H-Atom besitzt. In diesem Fall ist nur ein gemischtes Aldol möglich. Ein Beispiel für nicht enolisierbare Aldehyde sind aromatische Aldehyde (siehe: Benzaldehyd). Auf diese Weise wird in einer Knoevenagel-Kondensation Zimtaldehyd, ein wichtiger Duftstoff, gewonnen.
Pinakol-Kupplung
Setzt man Aldehyde mit einem Alkalimetall (Beispiel: Natrium) um, so bildet sich ein Radikal-Anion, das schnell dimerisiert. Die Hydrolyse liefert ein Pinakol (traditionelle Bezeichnung für ein 1,2-Diol, also ein Diol mit vicinalen Hydroxygruppen). Ausgehend von einem α,ω-Dialdehyd erhält man analog durch eine intramolekulare Reaktion cyclische 1,2-Diole.
Einzelnachweise
- Duden, Deutsches Universalwörterbuch, 4. Aufl., Mannheim, 2001.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-1 – 3-523.
- Siegfried Hauptmann: Organische Chemie. 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 565, ISBN 3-342-00280-8.
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft. Vieweg + Teubner Verlag (2011) S. 82–85, ISBN 978-3-8348-1245-2.
- Werner Köhler, Rainer Ansorg: Medizinische Mikrobiologie. Elsevier, Urban & Fischer Verlag, 2001, ISBN 3-437-41640-5, S. 92.
- K. P. C. Vollhardt, N. E. Schore: Organische Chemie. Hrsg.: H. Butenschön. 4. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, ISBN 3-527-31380-X, S. 862–863.