Peroxyessigsäure
Die Peroxyessigsäure (Abk.: PES) ist eine farblose, stechend riechende Flüssigkeit, die sich chemisch von der Essigsäure ableitet und zu den Peroxycarbonsäuren (und damit zu den Peroxiden) gehört. In höheren Konzentrationen kann sich Peroxyessigsäure explosiv zersetzen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
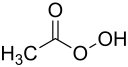 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Peroxyessigsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H4O3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, stechend riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 76,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,226 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
ab 40 °C Zersetzung, ab 100 °C Explosionsgefahr[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Peroxyessigsäure war schon bekannt, kurz nachdem Wasserstoffperoxid im Labor hergestellt werden konnte. Aufgrund ihrer Sensibilität gegenüber Metallspuren lernte man jedoch erst um 1930, sie industriell einzusetzen. Dennoch passierten viele Unfälle und sie konnte sich nicht durchsetzen, bis ab 1960 Kunststoffgefäße für Transport und Lagerung zur Verfügung standen. Danach entdeckte man in den einzelnen Ländern unterschiedliche Anwendungen, die größere Produktionsmengen rechtfertigten.
- In der DDR wurde sie aus politischen Erwägungen gefördert, um gegen einen bakteriologischen Angriff aus dem Westen gerüstet zu sein. Solange der nicht kam, musste die täglich produzierte Menge jedoch verkauft werden. Man fand die Tierstalldesinfektion als ideales Anwendungsgebiet für große Mengen.
- In England sträubten sich viele Kommunen, die in der Nähe des Meeres lagen, gegen den Bau einer Kläranlage. So desinfizierte man die Abwässer mit PES und pumpte die Fäkalien dann einfach ins Meer.
- In Österreich ersetzte man in Zuckerfabriken mit PES das bis dahin zur Desinfektion der Auslauganlage eingesetzte Formalin.
- In Italien hatte man zwar moderne Kläranlagen, aber die konnten aufgrund der hohen Temperaturen nicht die Abwassernormen erfüllen. So wurden die geklärten Abwässer noch mit PES nachdesinfiziert.
Gewinnung und Darstellung
Peroxyessigsäure wird durch Mischen von Essigsäure mit Wasserstoffperoxid hergestellt. Dabei bildet sich eine Gleichgewichtsmischung von Peroxyessigsäure, Essigsäure, Wasserstoffperoxid und Wasser.
Die Gleichgewichtseinstellung wird durch starke Säuren (Schwefelsäure) beschleunigt. Da das Verdünnen einer Peroxyessigsäurelösung automatisch zur Einstellung eines neuen Gleichgewichtes mit niedrigerem Peroxyessigsäuregehalt führt, ist die Lagerung verdünnter Reste nicht sinnvoll.
Kommerziell erhältlich ist Gleichgewichtsperoxyessigsäure in Konzentrationen zwischen 2,5 % und 40 %. Eine Alternative ist die Vakuumdestillation der Peroxyessigsäure aus einer Gleichgewichtsmischung. Wegen der Nähe der Siedepunkte erhält man dabei 38 % bis 40 % Peroxyessigsäure zusammen mit Wasser. Diese Mischung ist nicht stabil und muss zur Lagerung und zum Transport auf 0 °C gekühlt bleiben. Sie wird zur TCF-(Total-Chlor-Freien) Bleiche von Sulfatzellstoff verwendet.
Technisch kann PES durch Oxidation von Acetaldehyd hergestellt werden.
Eigenschaften
Beim Erhitzen zerfällt Peroxyessigsäure explosionsartig. Die mittels DSC bestimmte Zersetzungswärme beträgt −204 kJ·mol−1 bzw. −2682 kJ·kg−1.[5] Die Verbindung wirkt aufgrund ihrer Hydroperoxidgruppe stark oxidierend. PES ist aufgrund ihres Alkylrests etwas besser fettlöslich (lipophil) als Wasserstoffperoxid. Sie ist eine schwächere Säure als Essigsäure, ihre Salze können isoliert werden.
Die Dampfdruckfunktion ergibt sich nach August entsprechend lg(P) = −A/T+B (P in Torr, T in K) mit A = 2311 und B = 8,911 im Temperaturbereich von 0 °C bis 110 °C.[2]
Peressigsäure bildet in Essigsäure oder Ethylacetat gelöst detonationsfähige Gemische. Diese Eigenschaft ist konzentrations- und temperaturabhängig.[6]
| Detonationsfähigkeit von Peressigsäure in Essigsäure.[6] | ||||||||||||
| Konzentration | in Ma% | 20 | 30 | 40 | 45 | 50 | 54 | 57 | ||||
| Temperatur | in °C | 112 | 97 | 81 | 70 | 58 | 40 | 20 | ||||
Verwendung
Die stark oxidierende Wirkung bedingt den Einsatz als Bleichmittel, unter anderem bei Papieren, Textilien und Stärke und als Desinfektionsmittel (in ca. einprozentiger Konzentration) und Sterilisationsmittel (z. B. bei der kaltaseptischen Abfüllung von Getränken in Kunststoffflaschen aus PET oder HDPE). Als chemisches Oxidationsmittel wird die Peroxyessigsäure auch zur Epoxidierung von Alkenen eingesetzt.
Sicherheitshinweise
Bei Mensch und Tier wirkt die Peroxyessigsäure stark haut- und augenreizend.
PES zersetzt sich selbstbeschleunigend und ist besonders gegen äußere Erhitzung und Verunreinigung empfindlich. Die exotherme Zersetzung führt zur Erhitzung der Flüssigkeit, die bis zum Aufkochen und Verpuffen führen kann. Die Gefahr nimmt mit der Konzentration und der Gebindegröße stark zu. Die Konzentration technisch eingesetzter Lösungen wird deshalb üblicherweise auf unter 15 % beschränkt.
Einzelnachweise
- Eintrag zu Peroxyessigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- A. C. Egerton, W. Emte, G. J. Minkoff: Some properties of organic peroxides. In: Discuss. Faraday Soc. 10, 1951, S. 278–282, doi:10.1039/DF9511000278.
- Eintrag zu Peroxyessigsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- Eintrag zu Peracetic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Wei-Chun Chen; Jia-Ru Lin; Min-Siou Liao; Yih-Wen Wang; Chi-Min Shu: Green approach to evaluating the thermal hazard reaction of peracetic acid through various kinetic methods in J. Therm. Anal. Calorim. 127 (2017) 1019–1026, doi:10.1007/s10973-016-5812-0.
- B. Phillips, P. S. Starcher, B. D. Ash: Preparation of Aliphatic Peroxyacids. In: J. Org. Chem. 23, 1958, S. 1823–1826, doi:10.1021/jo01106a001.



