Nomenklatur (Chemie)
Unter Nomenklatur versteht man in der Chemie die möglichst systematische und international möglichst einheitliche Namensgebung für chemische Stoffe. Dabei gilt heute als wichtig, dass ein Verbindungsname eindeutig ist und nur zu einer einzigen Strukturformel führt. Die Bezeichnung „Ethanol“ bezeichnet beispielsweise nur die Verbindung CH3–CH2–OH und keine andere. Umgekehrt haben chemische Verbindungen aber keinen eindeutigen Namen, z. B. kann man die Verbindung CH3–CH2–OH nach verschiedenen Nomenklatursystemen sowohl als „Ethanol“ als auch als „Ethylalkohol“ bezeichnen.
Geschichte

Bis ins 18. Jahrhundert war die Bezeichnung chemischer Stoffe sehr uneinheitlich. Einen wichtigen Schritt in Richtung Systematisierung stellte 1787 das Buch Méthode de nomenclature chimique von Louis Bernard Guyton de Morveau, Antoine Laurent de Lavoisier, Claude Louis Berthollet und Antoine François de Fourcroy dar. Jöns Jakob Berzelius führte um 1825 die chemische Zeichensprache mit Buchstaben für chemische Elemente ein. 1860 schlug ein Komitee unter Leitung von Friedrich August Kekulé ein internationales Bezeichnungssystem für organische Verbindungen vor. 1919 wurde die International Union of Pure and Applied Chemistry (IUPAC) gegründet. Seitdem betrachtet sie die Festlegung internationaler Standards für die chemische Nomenklatur als ihre Hauptaufgabe.
Die IUPAC-Nomenklatur
Um die Bezeichnungsweisen für chemische Verbindungen zu vereinheitlichen, gibt es die als international verbindlich vereinbarten Richtlinien der IUPAC (International Union of Pure and Applied Chemistry) und der IUBMB (International Union of Biochemistry and Molecular Biology) sowie deren als Ausgleichskommission eingesetzte Joint Commission on Biochemical Nomenclature. Diese regeln den englischen Sprachgebrauch. Die Bezeichnungen in anderen Sprachen werden von den nationalen Chemikerverbänden entsprechend übertragen. So ist im deutschsprachigen Raum der Deutsche Zentralausschuss für Chemie unter Geschäftsführung der Gesellschaft Deutscher Chemiker (GDCh) im Einvernehmen mit den nationalen IUPAC-Mitgliedsgesellschaften der Schweiz und Österreich für die Umsetzung zuständig. Auch die IUPAC selbst verwendet in ihren Elementlisten viele englische Namen statt der den Elementkürzeln zugrunde liegenden (z. B. Potassium, Sodium, Tungsten, Mercury). Die Bedürfnisse verschiedener Sprachen und sogar des Englischen selbst werden von der IUPAC ausdrücklich anerkannt.[1] Besonders stringente Nomenklaturregelungen sind insbesondere für Index-Werke für chemische Stoffe wie Beilsteins Handbuch der Organischen Chemie und Chemical Abstracts bis vor kurzem notwendig gewesen, da deren System zur Auffindung von Einträgen bis zur Einführung elektronischer Recherche hauptsächlich danach erfolgte.
Da die systematische Bezeichnung von chemischen Verbindungen nach diesen Regeln oft sehr kompliziert ist, wird von den Chemikern im Alltagsgebrauch bis hin zu wissenschaftlichen Publikationen weiterhin eine große Anzahl von traditionellen Namen oder neu geschaffenen, anerkannten Kurznamen verwendet. Die IUPAC unterscheidet zwischen Trivialnamen, die keinen Bezug zur systematischen Nomenklatur haben (z. B. Wasser, Harnstoff oder Glaubersalz), semisystematischen Namen oder Semitrivialnamen, die zumindest einen Teil eines systematischen Namens verwenden (z. B. Kohlendioxid statt Kohlenstoffdioxid, Trityl für die Triphenylmethyl-Gruppe oder Glycerin für Propan-1,2,3-triol) und den bereits erwähnten systematischen Namen.[2] Auch für die Erfindung neuer Trivialnamen, z. B. von neu entdeckten Naturstoffen, gibt es IUPAC-konforme Regeln.
Ferner herrschen bei den Elementnamen die nationalen Gewohnheiten vor und selbst die IUPAC-Namensstamm entsprechen nicht durchgängig dem für die Formelkürzel maßgebenden Namen (Beispiel Hg = Hydrargyrum, dt. Quecksilber, IUPAC-Wurzel „mercur“ wie engl. mercury und lat. Mercurius).
Elementnamen und -symbole
Die Namen der chemischen Elemente werden von den Entdeckern festgelegt. Für unbekannte oder neue Elemente, die noch keinen Namen erhalten haben, gibt es systematische Elementnamen, die sich von der Kernladungszahl ableiten. Eine systematische Anordnung der Elemente nach ihrer Elektronenkonfiguration bietet das Periodensystem der Elemente. Für einige Elemente existieren alte deutsche Bezeichnungen, die in mehreren Revisionen von der IUPAC an die im englischsprachigen angepasst wurden. Dies betraf vor allem Elementnamen, in denen die Buchstaben k und z gegen c ausgetauscht wurden. Beispiele sind Kalzium – Calcium, Silizium – Silicium oder Kobalt – Cobalt. Aber auch einige andere Schreibweisen wie Jod, das zu Iod verändert wurde oder Wismut zu Bismut wurden geändert. Während in der Chemie überwiegend die neuen Bezeichnungen verwendet werden, werden in anderen Bereichen und im allgemeinen Sprachbereich vielfach noch die alten Namen genutzt.
Für jedes Element existiert ein Kürzel aus ein bis drei Buchstaben (Elementsymbol). Die Elementsymbole sind international gültig, sie werden also beispielsweise auch auf Japanisch durch lateinische Buchstaben wiedergegeben.
Will man ein bestimmtes Isotop eines Elements bezeichnen, so stellt man dessen Massenzahl hochgestellt vor das Elementsymbol, zum Beispiel 12C für das Kohlenstoff-12-Isotop, 235U für Uran-235 etc. Die schweren Isotope des Wasserstoffs, 2H (Deuterium) und 3H (Tritium), besitzen mit D bzw. T auch ein eigenes Elementsymbol.
Um Verbindungen von verschiedenen Elementen untereinander zu benennen, werden die Elementnamen teilweise abgewandelt und mit Nachsilben versehen. Dazu verwendet man den Namensstamm, welche aus den lateinischen bzw. griechischen Elementnamen abgeleitet sind. So wird beispielsweise der Sauerstoff in der Verbindung Aluminiumoxid (Al2O3) durch seine Namensstamm (ox) und die Endung -id angegeben.
Zahlenpräfixe in chemischen Namen
Falls eine Art von Atomen oder Atomgruppen in einem Molekül mehrfach vorkommt, wird die Anzahl durch ein entsprechendes Zahlenpräfix (Vorsilbe) angegeben, das von den griechischen Zahlwörtern abgeleitet ist und dem Namen des entsprechenden Atoms bzw. der entsprechenden Atomgruppe vorangestellt wird.[3] Ausgenommen sind nona und undeca, welche aus dem Lateinischen abgeleitet sind.
|
|
|
Die Präfixe mono und di werden nur für Eins und Zwei verwendet. In Verbindung mit anderen Zahlwörtern (21, 101 etc.) werden hen und do verwendet. Die Bildung des kompletten Zahlwortes erfolgt dabei von hinten nach vorne.
| Do- | -nonaconta- | -tetracta- | -kilia |
|---|---|---|---|
| 2 | 90 | 400 | 1000 |
| 1492 = Dononacontatetractakilia | |||
Beispiele:
- P4S7 Tetraphosphorheptasulfid
- SO3 Schwefeltrioxid
- CH2Cl2 Dichlormethan
Weglassen von Zahlenpräfixen
Bei Metallverbindungen nennt man nur die Wertigkeit bzw. Oxidationszahl, die das Metall in dieser Verbindung (Ionenbindung) besitzt: z. B.: CrO3 Chrom(VI)-oxid, gelesen Chrom-sechs-oxid, anstatt Chromtrioxid (Stocksche Nomenklatur). Die Wertigkeit bzw. Oxidationszahl wird dabei mit römischen Zahlen angegeben. Falls der Name einer Verbindung dadurch eindeutig bleibt, kann man die Wertigkeit auch weglassen. So gibt es z. B. nur ein einziges Oxid des Aluminiums, nämlich Al2O3, weshalb man statt Aluminium(III)-oxid auch einfach Aluminiumoxid schreiben kann.
Sehr oft wird die Vorsilbe mono- weggelassen, z. B. NaCl = Natriumchlorid und nicht Natriummonochlorid.
Alternative Zahlenpräfixe
Falls mehrere identische Gruppen vorhanden sind, bei denen die Verwendung der obigen Vorsilben missverständlich wäre, werden die folgenden aus dem griechischen hergeleiteten Präfixe verwendet. Ab Vier wird das einfache Zahlenpräfix zusammen mit der endung -kis verwendet.
| Anzahl | Vorsilbe (Präfix) |
|---|---|
| 1 | hen |
| 2 | bis |
| 3 | tris |
| 4 | tetrakis |
| 5 | pentakis |
| 6 | hexakis |
| … | |
| 21 | henikosakis |
Beispiele:
- Ca5F(PO4)3 Pentacalciumfluoridtrisphosphat – Durch Verwendung der Vorsilbe tris ist sofort klar, dass es sich nicht um die Triphosphatgruppe [P3O10]5− handelt, sondern um drei Phosphatgruppen [PO4]3−.
- 5,6-Bis(1,1-dimethylpropyl)undecan – die Verwendung der Vorsilbe bis zeigt sofort, dass es sich hier um zwei identische 1,1-Dimethylpropyl-Substituenten handelt.
Für die direkte Verknüpfung von identischen Einheiten verwendet man die folgenden Vorsilben, welche von den lateinischen Zahlwörtern abgeleitet sind:
| Anzahl | Vorsilbe (Präfix) |
|---|---|
| 2 | bi |
| 3 | ter |
| 4 | quater |
| 5 | quinque |
| 6 | sexi |
| 7 | septi |
| usw. | |
Beispiel:
- C6H5–C6H5 heißt Biphenyl (und nicht Diphenyl oder Bisphenyl).
Anorganische Chemie
Formeln von anorganischen Verbindungen
Beim Schreiben von Formeln von chemischen Verbindungen folgt man im Wesentlichen der Elektronegativitätsskala der chemischen Elemente. Man beginnt immer mit dem elektropositiveren Verbindungspartner, deshalb schreibt man etwa AgCl, Al2O3, PCl5 und nicht umgekehrt. Eine Ausnahme von dieser Regel sind die Wasserstoffverbindungen.
Wasserstoffverbindungen
Wasserstoffatome schreibt man in den Formeln an letzter Stelle (NH3, SiH4 etc.). Handelt es sich jedoch um aciden Wasserstoff (d. h. die Verbindung reagiert in wässriger Lösung sauer), so schreibt man den Wasserstoff am Anfang der Formel (HF, HCl, HBr, HI, H2O, H2O2, H2S, H2Se, H2Te). Bei der Benennung dieser Verbindungen wird beispielsweise neben dem Namen „Hydrogenfluorid“ für HF oder „Hydrogenchlorid“ für HCl auch der insbesondere im Labor wesentlich gebräuchlichere Name Fluorwasserstoff bzw. Chlorwasserstoff verwendet. Letztere sind aufgrund der eindeutigeren Bezeichnung insgesamt zu bevorzugen, da es sich bei diesen Verbindungen nicht um Salze mit den entsprechenden Anionen handelt, sondern aufgrund der hohen Elektronegativitätszahlen nur um stark partiell geladene Dipolverbindungen, in denen eine stark polare kovalente Bindung (Atombindung) vorliegt. Außerdem ist aufgrund der Eindeutigkeit bei der Benennung zu beachten, dass beispielsweise unter „Hydrogenfluorid“ Salze des Typs MHF bzw. MF×HF (mit M = einwertiges Metall) verstanden werden, somit ist Fluorwasserstoff bevorzugt zu verwenden. Auch bei anorganischen Oxosäuren schreibt man den Wasserstoff am Anfang der Formel, obwohl er eigentlich am Sauerstoff gebunden ist, also für Schwefelsäure zum Beispiel H2SO4 statt SO2(OH)2.
Radikale
Zur Benennung des Radikals wird dem Stammnamen die Endung -yl angehängt. Dies gilt sowohl in der organischen wie auch in der anorganischen Chemie.
Beispiele: HO•: Hydroxyl (Stamm: Hydrox-), •CH3: Methyl (Stamm: Meth-) und R–O•: Oxyl (z. B. 2,2,6,6-Tetramethylpiperidinyloxyl)
Einige Radikale haben, besonders bei den Sauerstoffverbindungen, spezielle Namen.
Organische Chemie
Für die Benennung von organischen Verbindungen nach dem IUPAC-System geht man üblicherweise von einem Stammsystem aus, das unter Umständen weitere Substituenten (Reste) trägt. Ein Substituent ist dabei ein Atom oder eine Atomkombination, welche ein Wasserstoffatom des Stammsystems ersetzt (substituiert). Für die Benennung der Verbindung wird der Name des Stammsystems unverändert übernommen und die Namen der substituierenden Gruppen werden dem Stammsystem in abgewandelter Form angefügt (substitutive Nomenklatur).
Als Ergänzung zum Stammsystem wird bei entsprechenden Verbindungen ein Deskriptor genannter Präfix vor dem systematischen Substanznamen ergänzt [z. B. cis-, trans-, (E)-, (Z)-, o-, m-, p-, n-, iso-, neo-, cyclo-, sec-, tert-, D-, L-, meso-, (±)-, (+)-, (−)-, (RS), (R)-, (S)-], der die Konfiguration oder die Stereochemie des Moleküls beschreibt. Häufig werden Deskriptoren in Kombination mit Lokanten (z. B. O-, N-, S-, α-, β-, [3.3]) zur genauen Beschreibung bestimmter Positionen von Atomen oder Bindungen verwendet, um eine chemische Struktur eindeutig zu benennen.
Klammerungen
Um eindeutige Formeln und Namen zu erhalten, werden in der Nomenklatur Namensteile und spezielle Angaben in Klammern gesetzt. Drei Arten von Klammern werden verwendet: runde ( ), eckige [ ] und geschweifte { }.[4] Die Verwendung von eckigen Klammern ist in der Anorganischen und Organischen Chemie allerdings unterschiedlich. Mehrfach vorkommende Einheiten werden in runde Klammern gesetzt, mit Ausnahme von Koordinationseinheiten, welche immer in eckigen Klammern stehen. Im Namen organischer Verbindungen werden von innen nach außen runde, eckige und geschweifte Klammern gesetzt: {[( )]}, {[({[( )]})]} usw.[5][6] In Formeln wird die abweichende Reihenfolge [], [( )], [{( )}], [({( )})], [{({( )})}] verwendet.[7]
Bei unvollständig isotop substituierten Verbindungen werden die Positionsziffern und Nuklidsymbole in runde Klammern gesetzt, zum Beispiel bei Dichlor(2H2)methan. Bei spezifischen, unselektiven, selektiv markierten, isotop defizitären oder angereicherten Verbindungen werden die Nuklidsymbole mit Multiplikationssubskripten in eckige Klammern gesetzt, zum Beispiel bei [13C,2H2]Methan, [def13C]Chloroform, [12C]Chloroform.[4]
Bei polycyclischen Kohlenwasserstoffen werden die Verschmelzungspositionen von Teilstrukturen in eckigen Klammern dazwischengeschoben, zum Beispiel bei Benzo[a]anthracen.[4]
Bei verbrückten polycyclischen Kohlenwasserstoffen im Von-Baeyer-System wird nach dem Begriff cyclo die Anzahl der C-Atome der beiden Zweige des Hauptringes, der Hauptbrücke und eventuell vorhandener Sekundärbrücken in absteigender Reihenfolge in eckigen Klammern angegeben, zum Beispiel Bicyclo[4.4.0]decan. Bei ungesättigten Brücken werden die Lokanten der Mehrfachbindungen in eckigen Klammern innerhalb des Brückenterms angegeben.[4]
Bei Spiro-Kohlenwasserstoffen folgen dem Term Spiro die Summen der an das Spiroatom gebundenen C-Atome in eckigen Klammern, zum Beispiel Spiro[2.4]heptan. Muss man, um überhaupt eine Spiroverknüpfung realisieren zu können, erst eine formale (Di)-Hydrierung durchführen, wird der zusätzliche indizierte Wasserstoff direkt hinter der die Spiroverknüpfung betreffenden Ziffer in runde Klammern gesetzt.[4]
Bei Oligosacchariden mit freier Halbacetal-Gruppe werden die Verknüpfungslokanten in runden Klammern zwischen die einzelnen Komponentennamen gesetzt, zum Beispiel β-D-Galactopyranosyl-(1→4)-α-D-glucopyranose.[4]
Leerzeichen und Bindestriche
An allen Stellen, wo im Englischen Leerzeichen zwischen den Worten eines Namens verwendet werden, stehen im Deutschen in der organischen Chemie Bindestriche[8] oder das Leerzeichen entfällt. Die Verwendung von Bindestrichen ist dabei zuweilen etwas willkürlich. Wenn es der Klarheit dient, sollte man hier etwas großzügig sein.[9]
Bindestriche werden in FORMELN und in NAMEN verwendet:[10]
- Um Lokanten von Worten oder Morphemen des Namens zu trennen. Beispiel: But-2-en
- Um einen Stereodeskriptor von einem Namen zu trennen. Beispiel: (E)But-2-en
- Um Symbole wie µ vom Rest der Formel oder des Namens zu trennen.
- Um Strukturdeskriptoren wie cyclo, catena, triangulo, quadro, tetrahedro, octahedro, closo, nido, arachno, cis und trans sowie z. B. Λ und α vom Rest der Formel oder des Namens zu trennen. In den Bezeichnungen von Aggregaten oder Clustern werden Lokanten in gleicher Weise getrennt.
- Um das Symbol des markierenden Nuklids von seinem Lokanten in der Formel einer selektiv-markierten Verbindung zu trennen.
- Um zu verschiedenen Namensteilen gehörende, zusammenstehende Lokanten zu trennen. Klammern sollten jedoch bevorzugt werden.
- Um den Namen eines Brückenliganden vom Rest des Namens zu trennen.
Nach Klammern erscheint ein Bindestrich nur dann, wenn der schließenden Klammer ein Lokant folgt, z. B. 3-(Bromcarbonyl)-4-(chlorcarbonyl)-2-methyl-benzoesäure. Zahlwörter (z. B. Tetra) werden ohne Bindestrich mit den Namen verknüpft.[11]
Lineare Ketten
Die einfachsten Stammsysteme sind lineare Ketten aus Kohlenstoffatomen, bei denen alle übrigen Bindungen mit Wasserstoffatomen gesättigt sind. Solche gesättigte Kohlenwasserstoffe nennt man Alkane, sie erhalten die Endung -an. Für die vier kleinsten Alkane werden die Namen Methan, Ethan, Propan und Butan beibehalten, für die übrigen Alkane ergibt sich der genaue Name der Verbindung nach der folgenden Tabelle aus der Anzahl der Kohlenstoffatome. Man kombiniert das Zahlwort der ersten Dekade mit den Zahlwörtern für die folgenden Dekaden. Am Ende folgt ein n, sodass man die Alkan-typische Endung -an erhält.
| 1 | Hen | 10 | Deca | 100 | Hecta | 1000 | Kilia | |||
| 2 | Do | 20 | Cosa | 200 | Dicta | 2000 | Dilia | |||
| 3 | Tri | 30 | Triaconta | 300 | Tricta | 3000 | Trilia | |||
| 4 | Tetra | 40 | Tetraconta | 400 | Tetracta | 4000 | Tetralia | |||
| 5 | Penta | 50 | Pentaconta | 500 | Pentacta | 5000 | Pentalia | |||
| 6 | Hexa | 60 | Hexaconta | 600 | Hexacta | 6000 | Hexalia | |||
| 7 | Hepta | 70 | Heptaconta | 700 | Heptacta | 7000 | Heptalia | |||
| 8 | Octa | 80 | Octaconta | 800 | Octacta | 8000 | Octalia | |||
| 9 | Nona | 90 | Nonaconta | 900 | Nonacta | 9000 | Nonalia | |||
Beispiele:
- C32H66 = Dotriacontan (Do + Triaconta + n)
- C99H200 = Nonanonacontan (Nona + Nonaconta + n)
- C403H808 = Tritetractan (Tri + Tetracta + n)
- C4728H9458 = Octacosaheptactatetralian (Octa + Cosa + Heptacta + Tetralia + n)
- C9999H20000 = Nonanonacontanonactanonalian (Nona + Nonaconta + Nonacta + nonalia + n)
Ausnahmen von der Benennung nach der obigen Tabelle gibt es bei:
| Anzahl der C-Atome | Verbindung | Name |
|---|---|---|
| 1 | CH4 | Methan |
| 2 | C2H6 | Ethan |
| 3 | C3H8 | Propan |
| 4 | C4H10 | Butan |
| 11 | C11H24 | Undecan |
| 20 | C20H42 | Icosan |
| 21 | C21H44 | Henicosan |
Falls eine Doppelbindung in der Verbindung vorhanden ist, spricht man von Alkenen und verwendet statt der Endung -an die Endung -en. Die Position der Doppelbindung wird durch eine Nummer angegeben siehe unten bei Nummerierung, z. B.
- CH2=CH–CH2–CH3 heißt But-1-en (früher 1-Buten),
- CH3–CH=CH–CH3 heißt But-2-en.
Bei Ketten, die eine Dreifachbindung enthalten (= Alkinen), wird die Endung -in verwendet, z. B.
- CH≡C–CH2–CH3 heißt But-1-in (früher 1-Butin),
- CH2=CH–CH2–C≡C–CH2–CH3 heißt Hept-1-en-4-in.
Falls mehrere Doppel- oder Dreifachbindungen vorkommen, verwendet man die multiplizierenden Vorsilben di, tri, tetra, penta, hexa, hepta, …
- CH2=CH–CH=CH2 heißt also Buta-1,3-dien,
- CH≡C–C≡C–C≡C–CH3 heißt Hepta-1,3,5-triin.
Bestimmung der Hauptkette bei verzweigten acyclischen Kohlenwasserstoffen
Die Hauptkette (Stammsystem) ist jene Kette, welche
- die größte Zahl an Mehrfachbindungen enthält
- bei Mehrdeutigkeit von (1): die größere Zahl von C-Atomen enthält
- bei Mehrdeutigkeit von (2): die größere Zahl von Doppelbindungen enthält
- bei Mehrdeutigkeit von (3): den niedrigsten Lokantensatz für die Mehrfachbindungen hat.
- bei Mehrdeutigkeit von (4): den niedrigsten Lokantensatz für die Doppelbindungen hat.
- bei Mehrdeutigkeit von (5): die größere Zahl von Substituenten hat.
- bei Mehrdeutigkeit von (6): den niedrigsten Lokantensatz für die Substituenten hat.
- bei Mehrdeutigkeit von (7): den alphabetisch geordnet ersten Substituenten hat.
- bei Mehrdeutigkeit von (8): den niedrigsten Lokanten für den alphabetisch ersten Substituenten hat.
Hinweis zum Lokantensatz: Ein Lokantensatz ist die Aufzählung der Lokanten wie z. B. 2,4 im 2,4-Dimethyl-heptan. Der „niedrigste Lokantensatz“ bedeutet nun nicht die kleinste Summe der Lokanten, vielmehr vergleicht man die Lokanten der Reihe nach. Der kleinste Lokantensatz ist der, der an der ersten unterscheidbaren Stelle den kleineren Lokanten aufweist.
Cyclische Systeme ohne Heteroatome
Bei cyclischen Systemen ist im Allgemeinen ein Cyclus das Stammsystem.
Monocyclische Systeme
Falls es sich um eine monocyclische Verbindung handelt, erfolgt die Benennung wie bei linearen Ketten, und zusätzlich wird die Vorsilbe Cyclo- vorangestellt, also z. B. Cyclohexan. Für Benzol wird der Trivialname beibehalten. Monocyclische Verbindungen mit mehr als sechs C-Atomen, die die maximale Anzahl nichtkumulierter Doppelbindungen aufweisen, können als (n)-Annulene bezeichnet werden (n = Anzahl der C-Atome). Cyclische Systeme werden bevorzugt nach dem Hantzsch-Widman-System bezeichnet.
Kondensierte polycyclische Systeme
Bei kondensierten polycyclischen Kohlenwasserstoffen (d. h. die einzelnen Ringe sind jeweils über genau eine gemeinsame Bindung verknüpft) ist jene Komponente das Basissystem, welche
- die meisten Ringe aufweist
- den größten Ring aufweist
Dabei werden folgende Polycyclen als eigene Systeme aufgefasst (in ansteigender Priorität, in Klammern die Anzahl der Ringe): Pentalen (2), Inden (2), Naphthalin (2), Azulen (2), Heptalen (2), Biphenylen (3), as-Indacen (3), s-Indacen (3), Acenaphthylen (3), Fluoren (3), Phenalen (3), Phenanthren (3), Anthracen (3), Fluoranthen (4), Acephenanthrylen (4), Aceanthrylen (4), Triphenylen (4), Pyren (4), Chrysen (4), Naphthacen (4), Pleiaden (4), Picen (5), Perylen (5), Pentaphen (5), Pentacen (5), Tetraphenylen (5), Hexaphen (6), Hexacen (6), Rubicen (7), Coronen (7), Trinaphthylen (7), Heptaphen (7), Heptacen (7), Pyranthren (8), Ovalen (10).
Alle übrigen Ringe werden als Vorsilben vorangestellt, wobei die Endsilbe -en in -eno umgewandelt wird (z. B. Benzocycloocten). Die Art der Verknüpfung wird durch Zahlen und Buchstaben angegeben, was aber hier nicht näher erläutert werden soll.
Zur Benennung von gesättigten oder teilweise gesättigten Derivaten der oben angeführten Polycyclen gibt es die Möglichkeit, beim Wegfallen einer Doppelbindung die beiden zusätzlichen Wasserstoffatome durch die Positionsnummern und die Vorsilbe dihydro- anzuzeigen. Analog gibt es tetrahydro-, hexahydro- usw. Vollständig gesättigte Systeme erhalten die Vorsilbe perhydro-. Einzelne Wasserstoffatome werden durch das sogenannte indizierte H angegeben, welches in kursiver Schrift vorangestellt wird (z. B. 4H-Pyrazol).
Cyclophane können nach den gleichen Regeln benannt werden, obwohl es für diese auch eine eigene Nomenklatur gibt.
Verbrückte polycyclische Systeme
Bei verbrückten polycyclischen Kohlenwasserstoffen (d. h. die einzelnen Ringe sind jeweils über mehr als eine gemeinsame Bindung verknüpft) wird das Von-Baeyer-System verwendet.
Spiroverbindungen
In Spiroverbindungen sind die Ringe über ein gemeinsames Atom verbunden.
Nomenklatur: Substituenten-spiro[Anzahl Atome im kleineren Ring . Anzahl Atome im größeren Ring]Stammname (Ringgröße wird ohne Spiro-Atom angegeben). Beispiel: 1-Brom-3-chlor-spiro[4.5]decan-7-ol.
Kompliziertere Systeme
Die Entscheidung, was nun als Stammsystem betrachtet wird, ist bei komplizierteren Verbindungen nicht mehr ganz einfach.
Heterocyclen
Sofern keine Trivialnamen vorliegen, benennt man monocyclische Heterocyclen mit bis zu 10 Ringgliedern meist nach dem Hantzsch-Widman-System.
Bei kondensierten Polycyclen haben Heterocyclen Vorrang gegenüber Carbocyclen (= Ringen, die nur aus Kohlenstoffatomen bestehen). Auch für Heterocyclen gibt es dabei Systeme mit Trivialnamen, welche als eigene Stammsysteme aufgefasst werden (ohne Reihung und unvollständig):
Ansonsten folgt die Benennung von Heterocyclen weitgehend den oben angeführten Regeln für cyclische Systeme ohne Heteroatome. Die Art und Position der Heteroatome wird dann mit Hilfe der Ersetzungsnomenklatur („a“-Nomenklatur) angegeben.
Viele Einzelverbindungen und Stoffgruppen enthalten die Endung -idin (z. B. Pyrrolidin und Anisidin). Dabei handelt es sich in den meisten Fällen um aromatische Verbindungen, die Stickstoff enthalten. Die Namensgebung folgt jedoch keiner durchgehenden Systematik.
Substituenten (Reste)
Ein Substituent kann z. B. eine funktionelle Gruppe sein, oder wiederum ein (kleineres) Stammsystem, etwa eine Seitenkette. Die Bezeichnungen für Substituenten werden dem Namen des Stammsystems als Vorsilben (Präfixe) oder Endungen (Suffixe) angefügt. Die genaue Position des Substituenten wird durch Ziffern präzisiert (siehe unten bei Nummerierung).
Falls mehrere Substituenten als Präfixe gibt, werden diese in alphabetischer Reihenfolge aufgelistet, multiplizierende Vorsilben ändern die Reihenfolge nicht, Bsp. Dibrom- vor Chlor- (Regel: P-14.5.1). Es gilt dabei immer der erste Buchstabe des Substituenten, Bsp. Dimethylamino (Regel P-14.5.2)[12]
Stammsysteme als Substituenten
Falls es sich beim Rest wiederum um ein Stammsystem handelt, zum Beispiel eine Seitenkette oder einen Ring, so wird an dessen Namen die Silbe -yl angehängt und das Ergebnis als Vorsilbe (Präfix) vorangestellt. Die Benennung von Seitenketten erfolgt nach den gleichen Regeln wie für die Grundkette, bis auf folgende Ausnahmen:
- bei Alkanen wird die Endung -an weggelassen
- die Nummerierung der Seitenkette startet immer bei der Verknüpfung mit der Hauptkette
Beispiele:
- Methyl: –CH3
- Ethyl: –CH2–CH3
- Ethinyl: –C≡CH
- Prop-2-enyl (Allyl): –CH2–CH=CH2
- Cyclohexyl: –C6H11
Die Namen Element-Wasserstoff-Gruppen werden analog aus der Stammverbindung gebildet:
- Germyl: -GeH3
- Silyl: -SiH3
- Trimethylsilyl: -Si(CH3)3
Wenn man beispielsweise an die Verbindung Propan (CH3–CH2–CH3) in der Mitte noch einen Methanbaustein anhängt, heißt die entstehende Verbindung CH3–CH(CH3)–CH3 dann 2-Methylpropan. Die Verbindung CH3–CH2–CH(CH3)–CH2–CH(CH2CH3)–CH2–CH3 heißt 3-Ethyl-5-methylheptan.
Seitenketten mit Doppelverbindung zur Grundkette erhalten die Endung -ylen (Methylen: =CH2), bei einer Dreifachverbindung -ylidin (Methylidin: ≡CH).
Funktionelle Gruppen
Die ranghöchste funktionelle Gruppe wird als Endung (Suffix) hinten angestellt, übrige funktionelle Gruppen als Vorsilben (Präfixe) vorangestellt:
- CH3–CH(OH)–CH3 heißt Propan-2-ol
- CH3–CH2–CH2–C(OOH) heißt Butansäure
- CH3–CH(OH)–CH2–CH(NH2)–CH2–CH3 hat zwei funktionelle Gruppen. Der Alkohol hat höhere Priorität, deshalb heißt die Verbindung 4-Amino-2-hexanol.
Für die Bezeichnungen einzelner funktioneller Gruppen und ihre Rangfolge siehe das Stichwort Funktionelle Gruppe.
Trivialnamen
Für manche Substituenten gibt es Trivialnamen, welche z. T. auch verbindlich sind, wie z. B.:
- Phenyl: –C6H5
- Benzyl: –CH2–C6H5
- Isopropyl: –CH–(CH3)2
- Vinyl: –CH=CH2
- u. v. m.
Nummerierung
Die Nummerierung des Stammsystems erfolgt so, dass die erhaltenen Nummern möglichst klein sind. CH3–CH2–CH2–CH(CH3)–CH3 heißt also 2-Methylpentan und nicht 4-Methylpentan.
Dabei gilt, wie im Fall der Bestimmung der Hauptkette, dass nicht die Summe der Positionsnummern möglichst klein sein muss, sondern dass die erste unterscheidbare Stelle den kleinsten Wert annimmt. CH3–CH2–CH(CH3)–CH(CH3)–CH2–CH2–CH2–CH2–CH(CH3)–CH3 heißt daher 2,7,8-Trimethyldecan und nicht 3,4,9-Trimethyldecan. Dies gilt auch, wenn Positionsnummern mehrfach vorkommen wie zum Beispiel bei ClCH2–CF3 (2-Chlor-1,1,1-trifluorethan statt 1-Chlor-2,2,2-trifluorethan).
Falls es nur eine mögliche Kombination gibt, können die Nummern weggelassen werden (z. B. 2-Methylpropan = Methylpropan, da es kein anderes Methylpropan gibt).
Falls Seitenketten nummeriert werden müssen, ist die Verbindungsstelle zur Hauptkette immer die Position 1.
Für natürlich vorkommende Derivate des Glycerins gilt für die Nummerierung der C-Atome nach IUPAC die sn-Nomenklatur.[13]
Bei kondensierten polycyclischen Systemen existieren ggf. verbindliche Nummerierungsschemata, die jeweils nachgeschlagen werden müssen (siehe z. B. Steran-Grundgerüst).
Die Positionsnummern werden Lokanten genannt.
Mehrfach vorkommende Substituenten
Für mehrfach vorkommende gleiche Gruppen werden die multiplizierenden Vorsilben di, tri, tetra, penta, hexa, hepta, … (siehe oben) verwendet:
- ein Benzolring mit drei Methylgruppen an den Positionen 1, 3 und 5 heißt 1,3,5-Trimethylbenzol,
- ein Methan mit vier Chloratomen heißt Tetrachlormethan.
- ein Ether mit zwei Ethylgruppen heißt Diethylether usw.
Falls die Verwendung von di, tri, tetra usw. missverständlich wäre, etwa bei identischen weitersubstituierten Seitenketten, muss man wie oben beschrieben die entsprechenden alternativen Vorsilben bis, tris, tetrakis usw. verwenden. Für direkt verknüpfte identische Einheiten sind die Vorsilben bi, ter, quater usw. in Verwendung.
Beispiel
Nach IUPAC-Nomenklatur muss zum Beispiel die Verbindung
H2N–CH2–CH2–OH
den Namen 2-Aminoethanol erhalten.
Auf folgende Weise gelangt man zu diesem Namen:
- Da die Kohlenstoffatome nur Einfachbindungen aufweisen, erhält die Wurzel als erste Endung „an“.
- Die Grundkette enthält zwei Kohlenstoffatome; damit ergibt sich die Wurzel „eth“. (→ „ethan“).
- Als funktionelle Gruppen sind enthalten eine Alkohol-(OH) und eine Aminogruppe (NH2). Die Alkoholgruppe hat die höhere Priorität und erhält Vorrang vor der Aminogruppe. Also wird „ol“ hinten angehängt. (→ „ethanol“).
- Die Aminogruppe befindet sich nicht am selben Kohlenstoffatom wie die Alkoholgruppe (Atom Nr. 1), sondern an dem daneben (Nr. 2). Deshalb wird der Ort angegeben durch „2-Amino“.
- Die Kombination von Vorsilbe, Wurzel und Endungen ergibt den Namen „2-Aminoethanol“.
Stereochemie
Chirale Verbindungen
Zur Unterscheidung von chiralen Verbindungen wird den verschiedenen Formen ein kursiv geschriebenes (R)- oder (S)- vorangestellt. Ihre Verwendung wird durch die Cahn-Ingold-Prelog-Regel (CIP-Regel) und ihre Nebenregeln festgelegt. Wenn eine chirale Verbindung als 1:1-Gemisch der Enantiomere vorliegt – also ein Racemat ist – wird die Bezeichnung (RS)- vorangestellt. Ist die Konfiguration (R)- oder (S)- unsicher oder unbekannt, kennzeichnet man dies durch ein (ξ) bzw. (Ξ)- (griechischer Buchstabe Xi).
Bei biochemischen Substanzen wie Kohlenhydraten und Aminosäuren wird auch noch häufig die Fischer-Nomenklatur verwendet, welche die Vorsilben D- und L- verwendet (wobei D und L als Kapitälchen geschrieben werden).
Zur Unterscheidung des Drehsinns bei optisch aktiven Verbindungen verwendet man ein (+)- oder (−)-, wobei kein Zusammenhang zwischen der optischen Aktivität (Drehsinn) und der „Richtung“ Chiralität besteht.
Es sei darauf hingewiesen, dass sich die unterschiedlichen Bezeichnungsweisen (R, S bzw. D, L und +, −) nach den verschiedenen Nomenklaturarten nicht von den jeweils anderen Bezeichnungen ableiten lassen. Zur systematischen Bezeichnung von Verbindungen mit mehreren Chiralitätszentren eignen sich nur die CIP-Regeln, wobei die Fischer-Nomenklatur beispielsweise für Zucker wesentlich kompakter ist.
cis-trans-Isomere
Bei der cis-trans-Isomerie unterscheidet man bei der Nomenklatur zwischen Verbindungen, die nur zwei verschiedene Substituenten haben, und Verbindungen mit mehr als zwei. Erstere werden mit den kursiv geschriebenen Vorsilben cis- oder trans- gekennzeichnet. cis-Doppelbindungen werden meist – aber nicht durchgängig – nach IUPAC mit einem vorangestellten, kursiven (Z) („Zusammen“) und trans-Doppelbindungen mit einem (E) („Entgegengesetzt“) gekennzeichnet. Genau genommen stehen bei einem (Z)-Isomer jene zwei Substituenten an benachbarten Atomen einer Doppelbindung auf derselben Seite des Moleküls, die die höchste Priorität im Cahn-Ingold-Prelog-System haben, beim (E)-Isomer stehen die Substituenten mit der höchsten CIP-Priorität also auf entgegengesetzten Seiten des Moleküls.
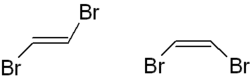
Links ist das trans-1,2-Dibromethen, rechts die cis-Version dargestellt. Auch kann man hier die (E,Z)-Nomenklatur anwenden,
- trans-1,2-Dibromethen wird als (E)-1,2-Dibromethen,
- cis-1,2-Dibromethen als (Z)-1,2-Dibromethen
bezeichnet.
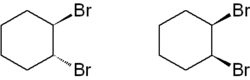
Auch hier am Ring sind die beiden Bromatome in trans- (links) und cis-Stellung („Zusammen“ auf einer Seite) dargestellt.
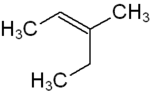
Das ist ein (Z)-3-Methylpent-2-en, da die ranghöheren Substituenten (siehe Stereochemie) auf einer Seite liegen.
Anomere
Bei Kohlenhydraten unterscheidet man Anomere durch die kursiven Vorsilben α- bzw. β-.
Biochemie
Für die Nomenklatur von Enzymen gibt es gemeinsame Richtlinien der IUPAC und der IUBMB (International Union of Biochemistry and Molecular Biology). Nach dieser Nomenklatur enden Enzymnamen mit -ase und enthalten eine Information über die Funktion des Enzyms. Details unter dem Stichwort Enzym und auf der Website der IUBMB.
Außerdem wurde ein Codesystem (siehe EC-Nummern) entwickelt, in dem die Enzyme unter einem Zahlencode aus vier Ziffern zu finden sind.
Für Nukleinsäuren gilt die Nukleinsäure-Nomenklatur.
Bezeichnungsstandards außerhalb der IUPAC-Vorschriften
Die alternative N-X-L-Nomenklatur dient der Bezeichnung hypervalenter Verbindungen. Für den praktischen Umgang mit chemischen Stoffen im Alltag gibt es zudem Normen, Nummernsysteme und Stoffdatenbanken unterschiedlicher Ausrichtung:
- Die E-Nummern bezeichnen in der Europäischen Union zugelassene Lebensmittelzusatzstoffe.
- Für Kunststoffe gibt es durch eine ISO-Norm festgelegte Kurzzeichen. Sie werden in Recycling-Codes verwendet.
- Die CAS-Nummern sind eindeutige Identifikatoren für chemische Stoffe und Gemische in Form von gruppierten Nummern. Stand April 2018 hat die CAS-Datenbank einen Bestand von rund 140 Millionen Einträgen.[14]
- Die international gültigen UN-Nummern werden für Gefahrgüter verwendet. Sie werden einzelnen Substanzen oder Gruppen gleicher Gefahr zugeordnet und sind in der Logistikkette und für Rettungskräfte von Bedeutung.
- Stoffe, die in der EU gehandelt werden, haben EG-Nummern. Diese sind eine wichtige Ordnungskategorie des Europäischen Chemikalienrechts (REACH-Verordnung).
Literatur
- IUPAC, Gerlinde Kruse (Hrsg.): Nomenklatur der Organischen Chemie – Eine Einführung. 1. Auflage. Wiley-VCH, Weinheim 1997, ISBN 3-527-29327-2.
- Karl-Heinz Hellwich: Chemische Nomenklatur. GOVI-Verlag, Eschborn 2002, ISBN 3-7741-0815-3.
- D. Hellwinkel: Die systematische Nomenklatur der organischen Chemie. Eine Gebrauchsanweisung. 5., korr., erw. u. erg. Auflage. Springer, Berlin 2005, ISBN 3-540-26411-6.
- Martin Negwer, Hans-Georg Scharnow: Organic chemical drugs and their synonymes, Vol. 1, 1–4138, Wiley–VCH–Verlag, Weinheim 2007, ISBN 978-3-527-31939-8
- Wolfgang Holland: Die Nomenklatur in der organischen Chemie. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1973, DNB 730400123.
- Philipp Fresenius, Klaus Görlitzer: Organisch-chemische Nomenklatur: Grundlagen·Regeln·Beispiele. 4. durchgesehene und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1998, ISBN 3-8047-1588-5.
- Ursula Bünzli-Trepp: Nomenklatur der Organischen Chemie, Metallorganischen Chemie und Koordinationschemie. Logos Verlag, Berlin 2001, ISBN 3-89722-682-0.
- Wolfgang Liebscher: Handbuch zur Anwendung der Nomenklatur organisch-chemischer Verbindungen. Akademie-Verlag, Berlin 1979, DNB 790313952.
- Wolfgang Liebscher, Ekkehard Fluck (Hrsg.): Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 2013, ISBN 978-3-642-58368-1, doi:10.1007/978-3-642-58368-1, 388 Seiten.
Weblinks
- Nomenklatur (PDF des Instituts für Analytische Chemie der Uni Regensburg; 55 kB)
Englisch
- IUPAC Website (englisch)
- IUBMB Website (englisch)
- IUPAC Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. (englisch)
- IUPAC-Regeln zur Nomenklatur in der organischen Chemie (englisch)
- IUPAC-Nomenklatur in der Stereochemie (englisch)
- Vergleich von mit Nomenklatursoftware generierten mit von Autoren veröffentlichten chemischen Namen. Gernot A. Eller: Improving the Quality of Published Chemical Names with Nomenclature Software. In: Molecules. 2006, 11, S. 915–928 (Onlineartikel auf Englisch) (PDF; 103 kB)
Einzelnachweise
- IUPAC Nomenclature of Organic Chemistry, Introduction, R-0.1 Conventions.
- IUPAC Nomenclature of Organic Chemistry, R-0.2.3 Names..
- Table 11 Basic numerical terms (multiplying affixes). IUPAC Nomenclature of Organic Chemistry, Recommendations 1993.
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 2013, ISBN 978-3-642-58368-1, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- acdlabs.com: R-0.1.5 Enclosing marks, abgerufen am 11. Juni 2017.
- G. J. Leigh: Principles of Chemical Nomenclature A Guide to IUPAC Recommendations. Royal Society of Chemistry, 2011, ISBN 978-1-84973-007-5, S. 55 (eingeschränkte Vorschau in der Google-Buchsuche).
- IUPAC: nomenclature of organic compounds (Memento des Originals vom 28. März 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 54 (eingeschränkte Vorschau in der Google-Buchsuche).
- Dieter Hellwinkel: Die systematische Nomenklatur der organischen Chemie – Eine Gebrauchsanweisung. Springer-Verlag, 2013, ISBN 978-3-662-06684-3, S. 3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Liebscher, Ekkehard Fluck: Die systematische Nomenklatur der anorganischen Chemie. Springer-Verlag, 1998, ISBN 978-3-540-63097-5, S. 63–66 (eingeschränkte Vorschau in der Google-Buchsuche).
- Gerlinde Kruse: Nomenklatur der Organischen Chemie: Eine Einführung. Wiley-VCH, 1997, ISBN 3-527-29327-2, S. 3,85.
- Henri A. Favre, Warren H. Powell: Nomenclature of Organic Chemistry. In: pubs.rsc.org. RSC Publishing, 17. Dezember 2013, S. 42–43, abgerufen am 3. Januar 2021 (englisch).
- IUPAC: Nomenclature of Lipids: Recommendations Lip-1 and Lip-2..
- Chemical Substances – CAS REGISTRY. In: support.cas.org. Abgerufen am 2. April 2018.