Propionsäuregärung
Bei der Propionsäuregärung, auch als Propionatgärung bezeichnet, werden durch Bakterien Kohlenhydrate oder Milchsäure (Lactat) zu Propionsäure (Propionat), Essigsäure (Acetat) und Kohlenstoffdioxid (CO2) vergoren. Sie dient den Bakterien als Energiequelle. Ist das Substrat Milchsäure, die als Gärprodukt von anderen Mikroorganismen gebildet wurde, spricht man von einer sekundären Gärung. Das Gärprodukt einer ersten Gärung wird dabei weitervergoren.
| Übergeordnet |
| Gärung |
| Gene Ontology |
|---|
| QuickGO |
Vorkommen
Mikroorganismen, die Propionsäuregärung betreiben, wurden ursprünglich im Schweizer Emmentaler-Käse entdeckt. Es sind Bakterien der Gattung Propionibacterium (z. B. P. freudenreichii), grampositive Anaerobier. Außerdem wird diese Gärung von einigen Vertretern der Gattungen Selenomonas, Veillonella, Clostridium und Peptostreptococcus betrieben.
Biochemie
Für die Propionsäuregärung dienen Glucose, andere Hexosen oder Milchsäure als Ausgangsstoffe. In jedem Fall wird aus diesen Stoffen Pyruvat gebildet, entweder aus den Zuckern im Zuge der Glykolyse oder aus Milchsäure durch Oxidation mittels Lactatdehydrogenase. In beiden Fällen wird je gebildetem Molekül Pyruvat ein Molekül NAD+ zu NADH reduziert.
Die Propionsäuregärung ist in zwei Äste aufgeteilt: Im oxidativen Ast der Gärung wird Pyruvat unter Einbeziehung von Coenzym A (CoA) zu Acetyl-CoA oxidiert, wodurch ein weiteres Molekül NAD+ zu NADH reduziert wird. Acetyl-CoA wird mittels anorganischem Phosphat zu Acetylphosphat[1] umgeestert, wobei CoA wieder frei wird; diese Reaktion wird durch eine Phosphotransacetylase katalysiert. Durch Substratkettenphosphorylierung mittels einer Acetatkinase wird schließlich Acetat gebildet und dabei ein Molekül Adenosintriphosphat (ATP) gewonnen (Übertragung des Phosphatrests vom Acetylphosphat auf Adenosindiphosphat (ADP)).
Im reduktiven Ast der Gärung wird das als Hydridionenüberträger fungierende NADH, das im oxidativen Ast durch Reduktion aus NAD gebildet wurde, reoxidiert, wobei Pyruvat zu Propionat reduziert wird. Beim reduktiven Ast der Propionsäuregärung sind zwei verschiedene Wege der chemischen Umsetzungen bekannt: der Methylmalonyl-Coenzym A-Weg und der Acrylyl-Coenzym A-Weg.
Methylmalonyl-CoA-Weg
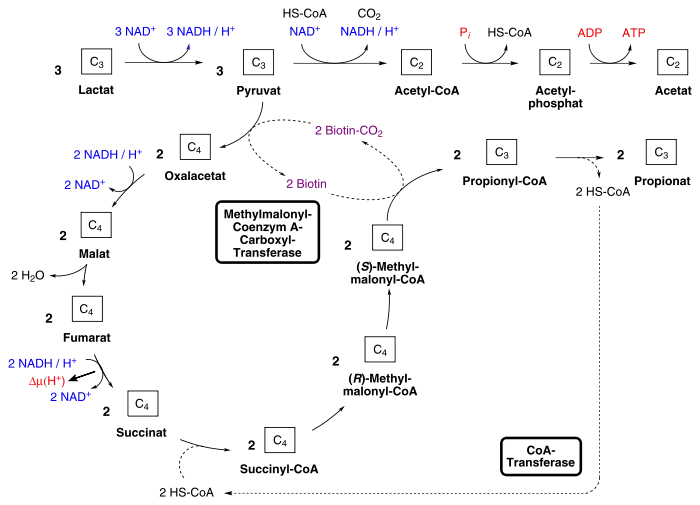
Propionibakterien gehen bei der Propionsäuregärung den Methylmalonyl-CoA-Weg. Dabei wird aus der C3-Verbindung Pyruvat durch Carboxylierung die C4-Verbindung Oxalacetat gebildet, was durch eine Transcarboxylase, der Methylmalonyl-Coenzym A-Carboxyl-Transferase katalysiert wird. Dieses ist ein für diesen Stoffwechselweg charakteristisches, Biotin-enthaltendes Enzym und überträgt eine CO2-Gruppe von Methylmalonyl-CoA, was im späteren Reaktionsverlauf gebildet wird, auf Pyruvat.
Oxalacetat wird in weiteren Reaktionsschritten wie im reduktiven Citratzyklus über Malat und Fumarat zu Succinat umgesetzt. Hierbei werden zwei Moleküle NADH zu NAD+ oxidiert. Bei der Reduktion von Fumarat wird zudem ein Protonengradient aufgebaut. Succinat wird durch eine Coenzym A-Transferase zu Succinyl-CoA umgesetzt. Dieses Enzym überträgt das Coenzym A von Propionyl-CoA, was im späteren Reaktionsverlauf gebildet wird, auf Succinat. Methylmalonyl-Coenzym A-Mutase, ein Adenosylcobalamin-enthaltendes Enzym, isomerisiert Succinyl-CoA zu Methylmalonyl-CoA, das dann durch die oben erwähnte Transcarboxylase decarboxyliert wird, wodurch Propionyl-CoA entsteht. Propionyl-CoA schließlich wird im letzten Schritt zu Propionat umgesetzt, wobei die Coenzym A-Transferase das Coenzym A auf Succinat überträgt.
Der Stoffwechselweg ermöglicht ein „Recycling“ von Coenzym A und CO2. Dadurch muss bei der Carboxylierung von Pyruvat und der Bindung von Succinat an CoA, die ohne dieses „Recycling“ Energie verbrauchen würden, keine Energie aufgewendet werden.
Die Bilanz für die Umsetzung lautet:
Acrylyl-CoA-Weg
Die Bakterien Clostridium propionicum und Megasphaera elsdenii gehen in der Propionsäuregärung einen einfacheren Weg. Dieser wird als Acrylyl-CoA-Weg bezeichnet. Dabei wird Lactat zu Lactyl-CoA aktiviert, was eine CoA-Transferase (A, siehe unteres Bild) katalysiert. Lactyl-CoA wird nach Wasserabspaltung zum namensgebenden Acrylyl-CoA durch eine Lactyl-CoA-Dehydratase (B) umgesetzt. Acrylyl-CoA wird zu Propionyl-CoA unter Oxidation von NADH reduziert, was eine Acrylyl-CoA-Reduktase (C) katalysiert. Das an Propionat gebundene Coenzym A wird durch eine CoA-Transferase (A) auf Lactat übertragen, Propionyl-CoA dient dadurch als CoA-Donor für ein weiteres Molekül Lactat.
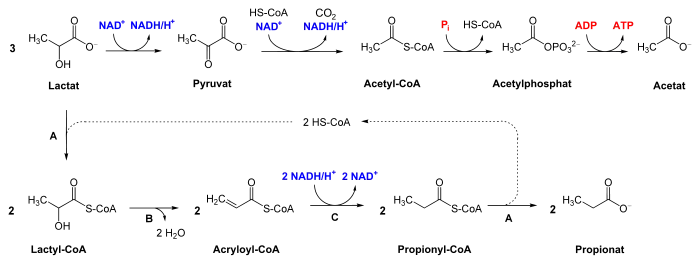
Bilanzen
Geht die Propionsäuregärung von drei Molekülen Lactat aus, werden ein Drittel des Lactats zu Acetat und Kohlenstoffdioxid umgesetzt unter Reduktion von NAD+ zu NADH und zwei Drittel zu Propionat auf dem Methylmalonyl-CoA-Weg unter Reoxidation des NADH. Insgesamt kann damit 1 mol ATP gebildet werden. Darüber hinaus wird ein Protonengradient aufgebaut, aus dem zusätzlich ATP generiert wird. Propionsäurebakterien gewinnen also mit Hilfe der dargestellten Reaktionsfolgen aus dem Abfallprodukt der Milchsäuregärung Energie: Die Änderung der Freien Enthalpie unter Standardbedingungen (pH = 7) ΔG0' beträgt für die Vergärung ausgehend von Lactat −162 kJ/mol.
Bei der Vergärung von Glucose in der Propionsäuregärung auf dem Methylmalonyl-CoA-Weg können die Bakterien aus je „1,5“ Mol Glucose (≙ drei C3-Molekülen) 4 mol ATP durch Phosphorylierung von ADP als kurzfristigen Energiespeicher und Energieüberträger bilden. In direkten Vergleich zur homofermentativen Milchsäuregärung wird damit etwas mehr ATP gebildet.
Bedeutung der Propionsäuregärung
Die Propionsäuregärung wird unter anderem bei der Reifung von Hartkäse genutzt, insbesondere bei Emmentaler. Hierbei werden Propionsäurebakterien mit einer Mischung aus homofermentativen Streptokokken und Milchsäurebakterien eingesetzt. Letztere fermentieren Lactose zu Milchsäure, es bildet sich Quark. Dieser wird abgegossen, woraufhin die Propionsäurebakterien die Milchsäure weiter zu Essigsäure und Propionsäure umsetzen, die wichtige Komponenten des Käsearomas sind. Das ebenfalls dabei gebildete CO2 führt unter anderem zur Lochbildung im Käse.
Bei Propionibakterien ist also ein Cobalaminenzym am Energiestoffwechsel beteiligt, in den Organismen also in größerer Konzentration enthalten als bei anderen Organismen, bei denen Cobalaminenzyme nur für bestimmte Reaktionen im Baustoffwechsel benötigt werden. Aus Propionibakterien (z. B. aus Propionibacterium shermanii[2]) werden deshalb Cobalamine (Vitamin B12) gewonnen.
Die Biotin-CO2-Verbindung ist labil und zerfällt bei geringen CO2-Konzentrationen, wodurch die Propionsäuregärung und damit die Energiegewinnung der Propionibakterien zum Erliegen kommt. Deshalb sind Propionibakterien auf eine höhere CO2-Konzentration angewiesen, was bei ihrer Kultur berücksichtigt werden muss. Diese CO2-Abhängigkeit führte zur Entdeckung der anaplerotischen Carboxylierungsreaktionen durch Harland G. Wood und Chester Werkman.
Einzelnachweise
- Acetylphosphat, Lexikon der Biologie; Acetylphosphat, Lexikon der Chemie. Auf spektrum.de.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008; ISBN 978-3-13-144861-3; S. 568.
Literatur
- Georg Fuchs (Hrsg.), Hans Günter Schlegel (Autor): Allgemeine Mikrobiologie. Thieme Verlag Stuttgart; 8. Auflage 2007; ISBN 3-13-444608-1; S. 372f.
- Wolfgang Fritsche: Mikrobiologie. Spektrum Akademischer Verlag; 3. Auflage 2001; ISBN 3-8274-1107-6; S. 240ff.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008; ISBN 978-3-13-144861-3; S. 381ff.
- Michael T. Madigan, John M. Martinko, Jack Parker und Thomas D. Brock: Mikrobiologie. Spektrum Akademischer Verlag; ISBN 3-8274-0566-1; S. 573f.