Propionsäure
Propionsäure ist der Trivialname der Propansäure, einer Carbonsäure mit stechendem Geruch. Ihre Salze und Ester heißen Propionate bzw. systematisch Propanoate.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
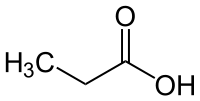 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Propionsäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C3H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit unangenehmem Geruch[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 74,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
0,99 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
141 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
4,87[4] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,386[5] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−510,7 kJ/mol[8] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Geschichte und Etymologie
Johann Gottlieb entdeckte 1844 bei der Reaktion von Kohlenhydraten mit geschmolzenen Alkalimetallhydroxiden die Propionsäure und ihre Salze. Der Name Propionsäure wurde ihr 1847 vom französischen Chemiker Jean-Baptiste Dumas gegeben.[5] Dumas leitete ihn aus griech. protos, ‚das Erste‘, und pion, ‚Fett‘ ab,[9] da sie die kleinste (erste) Carbonsäure ist, die ein ähnliches Verhalten wie Fettsäuren zeigt, indem sie beim Aussalzen einen Ölfilm auf Wasser und ein seifenartiges Kaliumsalz bildet.
Vorkommen
Propionsäure kommt in der Natur in einigen ätherischen Ölen vor. Es gibt auch Bakterien, die Propionsäure bilden, wie beispielsweise Clostridien, die den Dickdarm des Menschen besiedeln. Sie bilden dort die Säure aus unverdauten Kohlenhydraten. Auch bei der Herstellung bestimmter Käse ist die Bildung von Propionsäure durch bestimmte Bakterien von Bedeutung: Propionsäurebakterien im Käsebruch bilden beim Emmentaler und anderen Hartkäsesorten die charakteristischen Löcher und das Aroma durch Freisetzung von Kohlenstoffdioxid und Propionsäure. Sie bildet sich auch bei Gärungs- und Fermentationsprozessen beziehungsweise beim biologischen Abbau von pflanzlichen bzw. tierischen Materialien.
Ein Verursacher des unangenehmen Mundgeruchs beim Menschen ist – neben Buttersäure, Schwefelwasserstoff und anderen flüchtigen schwefelhaltigen organischen Verbindungen (Methanthiol, Dimethylsulfid) – Propionsäure.[10]
Gewinnung und Darstellung
Industrielle Herstellung
Zur großtechnischen Herstellung von Propionsäure in der Chemische Industrie werden aktuell zwei Verfahren angewendet. Die Hydrocarboxylierung von Ethen (Carbonylierung in Gegenwart von Wasser) wurde bereits in den 1930er Jahren von Walter Reppe bei der BASF in Ludwigshafen am Rhein entwickelt. Aufgrund der preisgünstigen Verfügbarkeit von Aldehyden auf Basis von petrochemischen Rohstoffen durch die Entwicklung der Oxo-Synthese bzw. Hydroformylierung, wird Propionsäure heute ebenfalls durch die Oxidation von Propionaldehyd hergestellt.
Hydrocarboxylierung von Ethen (BASF-Prozess)
Im Rahmen dieses Verfahrens wird Ethen mit Kohlenstoffmonoxid und Wasser bei Temperaturen von 250–320 °C und Drücken von 100–300 bar in Gegenwart von Nickeltetracarbonyl [Ni(CO)4] als homogener Katalysator in der flüssigen Phase umgesetzt.[11]
.svg.png.webp)
Dieses Verfahren wird heute vor allem in Anlagen der BASF SE durchgeführt. Das Unternehmen ist der weltweit größte Hersteller von Propionsäure und produziert diese an ihren Verbundstandorten in Ludwigshafen am Rhein (Deutschland) und Nanjing (China), die in den vergangenen Jahren stetig erweitert wurden. Die Produktionskapazität der BASF-Anlagen beträgt etwa 180.000 Jahrestonnen.[12][13]
Oxidation von Propionaldehyd
Ein weiteres wichtiges Verfahren zur großtechnischen Herstellung von Propionsäure ist die Oxidation von Propionaldehyd. Letzterer wird derzeit aus petrochemischen Ausgangsstoffen produziert und steht daher preisgünstig und in großen Mengen zur Verfügung. Die Flüssigphasenoxidation von Propionaldehyd wird mit Luftsauerstoff bei milden Temperaturen von 30–50 °C und geringen Drücken von 1–3 bar in Gegenwart von Mangan(II)-propionat als Katalysator durchgeführt.[14]
.svg.png.webp)
Man arbeitet in der flüssigen Phase und verwendet Propionsäure als Lösungsmittel.[14]
Sonstiges
Auch bei der Gewinnung von Biogas aus organischen Abfällen wird Propionsäure gebildet. Propionsäure entsteht in der zweiten Phase der Materialzersetzung, der säurebildenden Phase, in einem luftdichten Gärbehälter.[15]
Eigenschaften
Sicherheitstechnische Kenngrößen
Propionsäure bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 52 °C.[3][16] Der Explosionsbereich liegt zwischen 2,85 Vol.‑% (87 g/m3) als untere Explosionsgrenze (UEG) und 12 Vol.‑% (370 g/m3) als obere Explosionsgrenze (OEG).)[3][16] Hier ergibt sich ein oberer Explosionspunkt von 48 °C.[3] Die Grenzspaltweite wurde mit 1,1 mm bestimmt.[3][16] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[16] Die Zündtemperatur beträgt 485 °C.[3][16] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
Propionsäure ist ein wichtiger Synthesebaustein zur Herstellung von Kunststoffen, Herbiziden und Arzneimitteln. Propionsäure (E 280) sowie ihre Salze Natriumpropionat (E 281), Calciumpropionat (E 282) und Kaliumpropionat (E 283) werden als Konservierungsmittel verwendet. Die Säure selbst hat einen für den Menschen unangenehmen Geschmack, deshalb werden in der Lebensmittelindustrie, vor allem für abgepacktes Schnittbrot oder Feingebäck, die Salze der Säure verwendet. Die Säure selbst wird häufig der Silage zugesetzt, dort darf der Anteil bis zu 2 % der Trockenmasse betragen. Der Zusatzstoff hat den positiven Nebeneffekt, dass er Ketoazidosen bei Milchvieh vorbeugt. In der Bundesrepublik Deutschland waren Propionsäure und deren Salze in Schnittbrot ab 1988 verboten, da berichtet wurde, dass sie bei Ratten krebsähnliche Veränderungen des Vormagens hervorrufen. Nach neuestem EU-Recht ist sie wieder erlaubt.[17] Auch von der amerikanischen Food and Drug Administration wird Propionsäure als sicher eingestuft.[18] Der Mensch benötigt zum Abbau von Propionsäure Vitamin B12. Daneben sind Propionsäure und ihre Salze als Konservierungsmittel für Kosmetika gemäß deutscher Kosmetik-Verordnung zugelassen.
Viele Pilze sind in der Lage, auf reiner Propionsäure zu wachsen. Besonders in Verbindung mit anderen Kohlenstoff-Quellen wie Glucose wird aber die Polyketid-Synthase der Pilze und damit das Wachstum gehemmt.
Die Ester der Propionsäure dienen als Riechstoffe, Aromastoffe sowie als Lösungsmittel.
Humanmedizin
Untersuchungen an Zelllinien von Dünn- und Dickdarmzellen haben gezeigt, dass die Stimulierung der G-Protein-gekoppelten Rezeptoren für kurzkettige Fettsäuren GPR41 (free fatty acid receptor FFAR 3) und GPR43 (free fatty acid receptor FFAR 2) durch Propionsäure zum Beispiel zu einer günstigen Beeinflussung des Fett- und Zuckerstoffwechsels führt. Die gleiche Beobachtung konnte auch direkt an Ratten gemacht werden.[19]
Besonders die vermehrte Bildung von zwei Hormonen, PYY (Peptid YY) und GLP-1 (Glucagon-like Peptide 1) ist in diesem Zusammenhang wichtig. PYY und GLP-1 werden in den „L-Zellen“ des Darms, besonders im letzten Teil des Dünndarms (Ileum) und im Dickdarm (Blinddarm, aufsteigender Dickdarm) produziert. GLP-1 aktiviert die Insulinproduktion in der Bauchspeicheldrüse und hemmt dort gleichzeitig die Glucagon-Bildung (Glucagon ist der Insulin-Gegenspieler und erhöht den Blutzuckerspiegel). Somit wird durch kurzkettige Fettsäuren der Blutzuckerspiegel gesenkt.
Gleichzeitig wird der Appetit reduziert und das Sättigungsgefühl verstärkt. Dabei wirken PYY und GLP-1 sowohl im Hypothalamus, einer bestimmten Gehirnregion, im Sinne eines Sättigungsgefühls sowie einer Verminderung des Appetits, als auch im Magen, wo die Entleerung gehemmt wird.
Wird Propionsäure in Form von Natriumpropionat oder Calciumpropionat der Nahrung zugeführt, hat dies eine Produktion von PYY und GLP-1 zur Folge, deren Spiegel im Blut ansteigen. Im Laufe eines halben Jahres kommt es bei Übergewichtigen zu einer Gewichtsabnahme, auch im Bauchraum und der Leber, und die Insulinresistenz, die sich in der Kontrollgruppe verschlechtert, bleibt gleich.[20]
Tirosh et al. zeigten in einer Studie mit 14 Probanden, dass der Verzehr einer 1000 mg Propionat enthaltenden Mischmahlzeit beim Menschen kurz nach dem Essen zu einem Anstieg von Plasma-Glucagon, einem glukoneogenen Hormon namens Fettsäure-bindendes Protein 4 (FABP4), und zur Noradrenalinfreisetzung durch das sympathische Nervensystem führte. Dies wiederum bewirkte eine Insulinresistenz mit kompensatorischer Hyperinsulinämie. Die Ergebnisse deuten darauf hin, dass Propionat als Stoffwechseldisruptor wirken kann, der das Risiko für Diabetes mellitus Typ 2 und Fettleibigkeit beim Menschen potenziell erhöht.[21]
Antientzündliche Wirkung
Propionsäure wird bei ballaststoffreicher Ernährung durch Bakterien im Dickdarm gebildet und stellt dann eine der wichtigsten Energiequellen der oberflächlich gelegenen Darmzellen (Darmepithelien) dar. Wie andere kurzkettige Fettsäuren übt auch die Propionsäure einen regulierenden Einfluss auf die Entzündungsbereitschaft des Darmes sowie des gesamten Organismus aus und kann im Tierversuch chronischen Entzündungskrankheiten, wie etwa der Multiplen Sklerose, vorbeugen. Neuerdings zeichnen sich sogar Erfolge bei der Therapie der menschlichen MS ab,[22] Zudem stimuliert Propionsäure bestimmte neuroendokrine Zellen des Dickdarmes, die sogenannten L-Zellen, zur Produktion von Hormonen (Glucagon-like Peptide 1, Peptide YY), die sich günstig auf Fettleibigkeit und Diabetes auswirken.[23]
Herz-Kreislauf-Erkrankungen
In einem Tierversuch fütterten Forscher Mäuse mit hohem Blutdruck mit Propionat. Danach hatten die Tiere weniger ausgeprägte Herzschäden oder abnormale Vergrößerungen des Organs, was sie weniger anfällig für Herzrhythmusstörungen machte. Auch Gefäßschäden, wie z. B. Atherosklerose, nahmen bei Mäusen ab. Das Forschungsteam hofft nun, ihre Ergebnisse zu bestätigen, indem es die Auswirkungen der Substanz auf den Menschen untersucht.[24]
Physiologische Effekte
Nehmen Menschen eine ballaststoffreiche Diät zu sich, so ändert sich nach einigen Monaten die Zusammensetzung der Bakterien im Darm und es werden mehr kurzkettige Fettsäuren gebildet.[25][26][27]
Die Epithelzellen des Dickdarms nehmen fast 90 % der kurzkettigen Fettsäuren auf und geben sie über das Pfortadersystem und die Leber an den Organismus weiter. Aktuellen Schätzungen zufolge bezieht der Mensch bis zu zehn Prozent seines täglichen Energiebedarfs über die kurzkettigen Fettsäuren. Darüber hinaus decken die Epithelien des Dickdarms über die Hälfte ihres Energiebedarfs aus kurzkettigen Fettsäuren, insbesondere auch über die Buttersäure.[28]
Eine Reihe von Zellen haben auf ihrer Oberfläche Rezeptoren, mit denen sie kurzkettige Fettsäuren erkennen können. Über diese Rezeptoren werden Signale in das Innere der Zelle übermittelt, die das Verhalten der Zelle verändern. Interessant ist, dass diese Rezeptoren zum einen auf Zellen vorhanden sind, die mit dem Fett- und Zuckerstoffwechsel zu tun haben, und sich aber andererseits zum Beispiel auch auf Immunzellen finden: Es sind in erster Linie sogenannte G-Protein-gekoppelte Rezeptoren (GPR), speziell GPR41 (free fatty acid receptor FFAR 3) und GPR43 (free fatty acid receptor FFAR 2).[29]
GPR41 findet sich in Zellen von Fettgewebe, Bauchspeicheldrüse, Milz, Lymphknoten, Knochenmark, Lymphozyten und Monozyten. GPR43 findet sich im distalen Ileum, Colon, Fettgewebe, in Monozyten und neutrophilen Granulozyten (höchste Expression). Dementsprechend sind die Effekte von Propionsäure und ihren Salzen, wie Natriumpropionat, und anderen kurzkettigen Fettsäuren speziell auf den Zucker- und Fettstoffwechsel sowie das Immunsystem ins Zentrum der aktuellen Forschung gerückt.
Sicherheitshinweise
Propionsäure wirkt ätzend, in Verdünnung reizend auf Haut, Augen, Schleimhäute und Atemtrakt. Bei längerer Gabe von Propionsäure und Propionaten im Futter von Ratten in Dosierungen zwischen 0,6 und 5 % verursachen diese Veränderungen des Vormagens (Verdickungen und Entzündungen). Dies wird jedoch als für Ratten speziesspezifische Reaktion eingestuft, da bei anderen Tierarten wie Mäusen und Kaninchen keine derartigen Effekte beobachtet wurden.[30]
Siehe auch
Einzelnachweise
- Eintrag zu E 280: Propionic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu PROPIONIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 22. April 2020.
- Eintrag zu Propionsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Oktober 2018. (JavaScript erforderlich)
- U.-R. Samel, W. Kohler, A. O. Gamer, U. Keuser: Propionic Acid and Derivatives. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012, doi:10.1002/14356007.a22_223.pub2.
- Eintrag zu Propionsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Mai 2014.
- Eintrag zu Propionic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 79-09-4 bzw. Propionsäure), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- Development of Systematic Names for the Simple Alkanes. (Memento vom 16. März 2012 im Internet Archive)
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag, 2011, ISBN 978-3-8348-1245-2, S. 61–62.
- Ulf‐Rainer Samel, Walter Kohler, Armin Otto Gamer, Ullrich Keuser, Shang‐Tian Yang, Ying Jin, Meng Lin Zhongqiang Wang, Joaquim Henrique Teles: Propionic Acid and Derivatives. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 31. Januar 2018, doi:10.1002/14356007.a22_223.pub4.
- BASF erweitert Kapazität für Propionsäure. CHEMIE TECHNIK, 28. November 2007, abgerufen am 21. März 2020.
- BASF und SINOPEC erweitern Kapazität zur Herstellung von Propionsäure in Nanjing, China. In: BASF Presseinformationen. 1. Juni 2017, abgerufen am 19. März 2021.
- Manfred Fedtke, Wilhelm Pritzkow, Gerhard Zimmermann: Technische Organische Chemie – Grundstoffe, Zwischenprodukte, Finalprodukte, Polymere. 1. Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1992, S. 133, ISBN 3-342-00420-7
- Stephan Ahlert, Rita Zimmermann, Johannes Ebling, Helmut König: Analysis of propionate-degrading consortia from agricultural biogas plants. In: MicrobiologyOpen. 5(6), 2016, doi:10.1002/mbo3.386.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- EFSA: Scientific Opinion on the re-evaluation of propionic acid (E 280), sodium propionate (E 281), calcium propionate (E 282) and potassium propionate (E 283) as food additives. EFSA, Dezember 2014, abgerufen im Dezember 2014 (englisch).
- Food and Drug Administration FDA: DIRECT FOOD SUBSTANCES AFFIRMED AS GENERALLY RECOGNIZED AS SAFE. In: CFR - Code of Federal Regulations. Food and Drug Administration FDA, 1. April 2015, abgerufen am 1. April 2015 (englisch).
- A. Psichas, M. L. Sleeth, K. G. Murphy u. a.: The short chain fatty acid propionate stimulates GLP-1 and PYY secretion via free fatty acid receptor 2 in rodents. International Journal of Obesity. In: International Journal of Obesity (Hrsg.): International Journal of Obesity. Nr. 39. MacMillan Publishers, London, UK 2015, S. 424–429, doi:10.1038/ijo.2014.153.
- Edward S. Chambers, Alexander Viardot u. a.: Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults. In: Gut. Band 64, Nr. 11, 2015, S. 1744–1754, doi:10.1136/gutjnl-2014-307913 (englisch).
- Amir Tirosh1†, Ediz S. Calay et al.: The short-chain fatty acid propionate increases glucagon and FABP4 production, impairing insulin action in mice and humans. In: Science Translational Medicine. 24. April 2019, abgerufen am 25. April 2019 (englisch).
- Cell, Vol. 180, issue 6, S. 1067–1080 (2020), DOI: https://doi.org/10.1016/j.cell.2020.02.035.
- E. N. Bergman: Energy contributions of volatile fatty acids from the gastrointestinal tract in various species. In: Physiological Reviews. Band 70, 1990, S. 567–590, PMID 2181501.
- Hendrik Bartolomaeus et al.: The Short-Chain Fatty Acid Propionate Protects from Hypertensive Cardiovascular Damage. In: Circulation. 2018, doi:10.1016/j.cardiores.2006.06.030.
- Maria De Angelis, Eustacchio Montemurno, Lucia Vannini u. a.: Effect of Whole-Grain Barley on the Human Fecal Microbiota and Metabolome. In: Applied and Environmental Microbiology. Band 81, Nr. 22, 2015, S. 7945–7956, doi:10.1128/AEM.02507-15, PMID 26386056.
- J. G. LeBlanc, F. Chain, R. Martín, L. G. Bermúdez-Humarán, S. Courau, P. Langella: Beneficial effects on host energy metabolism of short-chain fatty acids and vitamins produced by commensal and probiotic bacteria. In: Microbial cell factories. Band 16, Nummer 1, Mai 2017, S. 79, doi:10.1186/s12934-017-0691-z, PMID 28482838, PMC 5423028 (freier Volltext) (Review).
- E. Patterson, J. F. Cryan, G. F. Fitzgerald, R. P. Ross, T. G. Dinan, C. Stanton: Gut microbiota, the pharmabiotics they produce and host health. In: The Proceedings of the Nutrition Society. Band 73, Nummer 4, November 2014, S. 477–489, doi:10.1017/S0029665114001426, PMID 25196939 (Review), PDF.
- Olga Brandstätter, Oliver Schanz, Julia Vorac u. a.: Balancing intestinal and systemic inflammation through cell type-specific expression of the aryl hydrocarbon receptor repressor. In: Scientific Reports. Band 6, 2016, S. 26091, doi:10.1038/srep26091.
- R. Corrêa-Oliveira, J. L. Fachi, A. Vieira u. a.: Regulation of immune cell function by short-chain fatty acids. In: Clinical & translational immunology. Band 5, Nummer 4, April 2016, S. e73, doi:10.1038/cti.2016.17, PMID 27195116, PMC 4855267 (freier Volltext) (Review).
- H.-G. Classen, P. S. Elias, W. P. Hammes, M. Winter: Toxikologisch-hygienische Beurteilung von Lebensmittelinhaltsstoffen und Zusatzstoffen. Behr’s Verlag, 2001, ISBN 978-3-86022-806-7.


