Glycerin
Glycerin (von griech. γλυκερός glykerós „süß“,[9] auch Glycerol oder Glyzerin) ist der Trivialname und die gebräuchliche Bezeichnung von Propan-1,2,3-triol. Glycerin ist ein Zuckeralkohol und der einfachste dreiwertige Alkohol, ein Triol. Der Name Glycerol wurde eingeführt, da er die korrekte Endung -ol für einen Alkohol besitzt (die Endung -in steht für Alkine oder Amine).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
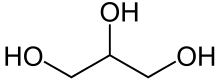 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glycerin | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C3H8O3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 92,09 g·mol−1[4] | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,26 g·cm−3 (20 °C)[4] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
290 °C (unter Zersetzung)[4] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,4745[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
Gemessen als einatembarer Aerosolanteil: | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−669,6 kJ/mol[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Glycerin ist in allen natürlichen Fetten und fetten Ölen – z. B. Pflanzenölen – chemisch gebunden als Fettsäureester (Triglyceride) vorhanden und spielt eine zentrale Rolle als Zwischenprodukt in verschiedenen Stoffwechselprozessen. Als Lebensmittelzusatzstoff trägt es das Kürzel E 422.
Geschichte
1779 erhielt Carl Wilhelm Scheele bei der Verseifung von Olivenöl erstmals Glycerin. Michel-Eugène Chevreul konnte im Jahr 1813 nachweisen, dass Fette Ester von Fettsäuren und Glycerin sind und gab dem Alkohol 1823 seinen Namen, abgeleitet von γλυκύς glykýs ‚süß‘.[3] 1836 wurde der strukturelle Aufbau von Théophile-Jules Pelouze aufgeklärt.[10] Der Engländer George Fergusson Wilson entwickelte 1854 ein Verfahren, um reines Glycerin in industriellem Maßstab zu synthetisieren.[11] In der Folgezeit stieg das Interesse an Glycerin als Vorläufer für das damals neu entdeckte Nitroglycerin.[10]
Damals wurde Glycerin größtenteils aus Ölen und Fetten gewonnen, allerdings reichte die Produktionsmenge in Kriegszeiten nicht aus, sodass erstmals auch Anlagen gebaut wurden, in denen Glycerin aus Zucker fermentativ hergestellt wurde. 1943 wurde in Deutschland eine neue, erdölbasierte Herstellungsmethode für Glycerin gefunden, die in der Folgezeit die fermentative Herstellung ablöste. Um die Jahrtausendwende wurden ca. 25 % des Glycerins erdölbasiert hergestellt.
Da durch politische Maßnahmen seit Anfang der 2000er Jahre die Produktion von Biodiesel mehr und mehr gefördert wurde, stieg auch die Menge des Kuppelprodukts Glycerin aus natürlichen Quellen stark an. Mittlerweile wird Glycerin nahezu ausschließlich aus nachwachsenden Rohstoffen hergestellt. Durch die gestiegene Produktionsmenge ist der Glycerinpreis stark gefallen. Damit wird Glycerin auch für neue Anwendungen interessant, für die es früher zu teuer war.[10][12] 2015 lag die weltweite Jahresproduktion an Glycerin bei ca. 4 Millionen Tonnen.[10]
Gewinnung und Darstellung
Die Herstellung kann petrochemisch aus Propen mit den Zwischenprodukten Allylchlorid und Epichlorhydrin oder chemisch als Kuppelprodukt bei der Verseifung von natürlichen Fetten und Ölen zur Gewinnung von Seifen (= Alkalisalze der Fettsäuren) geschehen. Früher wurden dazu vor allem tierische Fette eingesetzt.
Inzwischen werden große Mengen Glycerin als Nebenprodukt der Biodieselherstellung erzeugt. Dies geschieht durch eine Umesterung von meist pflanzlichen Ölen mit Methanol. Ein Fettmolekül (Triacylglycerid) wird mit drei Methanolmolekülen zu Glycerin und drei Fettsäuremethylestern (FAME) umgesetzt.
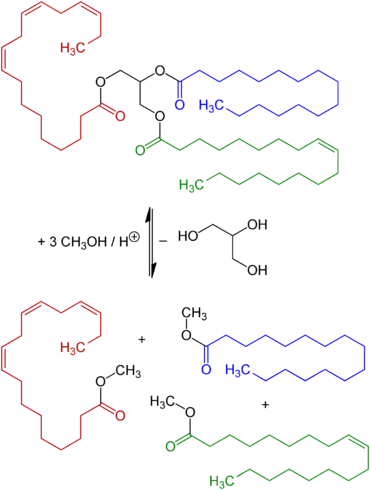
Auch eine biotechnologische Herstellung durch Fermentation ist möglich. Hefen können durch Sulfitzusatz die Gärung von Ethanolbildung auf Glycerinbildung umstellen. Als Substrat wurde oftmals Melasse verwendet, da diese neben einem hohen Anteil an Zucker auch viel Sulfit enthält. Diese Form der Gärung wurde 1918 von Neuberg als 2. Neuberg’sche Gärungsform bezeichnet.[13] Das Verfahren geht auf Carl Neuberg zurück, wurde von Karl Lüdecke und Wilhelm Connstein von den Vereinigten Chemischen Werken in Berlin-Charlottenburg entwickelt und wurde im Ersten Weltkrieg in Deutschland von großer Bedeutung für die Sprengstoffproduktion.
Glycerin ist in unterschiedlichen Reinheiten im Handel erhältlich. Für industrielle Zwecke wird es als Rohglycerin und für pharmazeutische Zwecke (Pharmaglycerin) in den Qualitäten 99,8-, 99,5- und etwa 86-prozentig angeboten. 86-prozentig (mit 14 % Wasser) ist es wegen des stark erniedrigten Schmelzpunkts (−10 °C) und der niedrigeren Viskosität (ca. 100 mPa·s) technisch einfacher zu handhaben. Die Aufbereitung erfolgt durch mehrstufige Destillation, Desodorierung und Filtration.[14] Hochreines, synthetisches Glycerin stammt nicht aus tierischen oder pflanzlichen Vorprodukten und wird besonders in qualitätssensiblen Bereichen der Pharmaindustrie sowie der Kosmetik- und Lebensmittelindustrie eingesetzt.[15]
Eigenschaften
Physikalische Eigenschaften
Glycerin ist bei Raumtemperatur eine farb- und geruchlose, leicht viskose und hygroskopische Flüssigkeit, die süßlich schmeckt. Glycerin hat eine Viskosität von 1480 mPa·s (20 °C).
Chemische Eigenschaften
Glycerin bildet unter Hitzeeinwirkung weißen Dampf. Beim Erhitzen unter Sauerstoffmangel zersetzt es sich zudem in Wasser gut (267 g/l) löslichen sowie giftigen ungesättigten Aldehyd Propenal, das auch Acrylaldehyd oder Acrolein genannt wird.
Mit festem Kaliumpermanganat reagiert es unter Selbstentzündung vollständig zu Kohlenstoffdioxid und Wasser. Als Nebenprodukte entstehen bei dieser Reaktion auch Braunstein und Kaliumcarbonat.
Von wässrigem Kaliumpermanganat wird es nur bis zur Mesoxalsäure oxidiert. (CSB-Titration durch Manganometrie)
Sicherheitstechnische Kenngrößen
Glycerin bildet bei höherer Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 191 °C.[4][16] Der Explosionsbereich liegt zwischen 2,6 Vol.‑% (99 g/m3) als untere Explosionsgrenze (UEG) und 11,3 Vol.‑% (435 g/m3) als obere Explosionsgrenze (OEG).[4][17] Die Zündtemperatur beträgt 400 °C.[4][17] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Lebensmittel und Kosmetik

Wegen seiner wasserbindenden Eigenschaften ist Glycerin in Kosmetikartikeln als Feuchtigkeitsspender enthalten. Als Lebensmittelzusatzstoff findet Glycerin unter der Nummer E 422 Anwendung zur Feuchthaltung, etwa für Datteln oder Kaugummi, aber auch als Süßungsmittel. Auch in verschiedenen Zahnpasten ist Glycerin enthalten.
Haushalt
Häufig wird Glycerin in das Wasser von Weihnachtsbaumständern gegeben, um den Baum länger frisch zu halten. Das Glycerin sorgt für Frostschutz und führt dazu, dass die Nadeln länger halten. Glycerin findet aufgrund seiner feuchtigkeitsspendenden Wirkung Verwendung in Lederpflegemitteln und Schuhcremes, um Leder glatt und geschmeidig zu halten. Auch bei der Herstellung von Flüssigkeit für Seifenblasen wird in der Regel etwas Glycerin hinzugegeben.
Malerei
Glycerin dient als Feuchthaltemittel in Aquarellfarben, entweder allein oder zusammen mit Honig.
Tabak, Zigaretten und Verdampfer
.jpg.webp)
Glycerin (E 422) wird zusammen mit 1,2-Propandiol als Feuchthaltemittel für Tabakwaren verwendet, nicht zu verwechseln mit der Glycerin-Phosphorsäure und deren Natrium-, Kalium- und Magnesiumverbindungen, deren Reinheitsanforderungen beispielsweise in Deutschland in deren Tabakverordnung klar definiert sind. Im Zigaretten- und Pfeifentabak sollen die Feuchthaltemittel vor allem die Lagerungszeiten der Produkte verlängern und die Austrocknung verhindern. Shisha-Tabak werden von den Herstellern deutlich höhere Mengen an Feuchthaltemitteln zugemischt, um einerseits die Verbrennung des Tabaks zu verhindern und andererseits einen dichteren Dampf zu erzeugen. Weiterhin findet Glycerin ebenso wie 1,2-Propandiol Verwendung als Nebelfluid in elektrischen Zigaretten.
Industrie und Technik
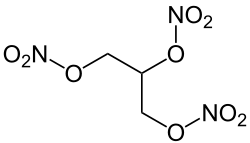
Glycerin wird als Frostschutzmittel (in Mischung mit Wasser als Wärmeträger), Schmierstoff und Weichmacher verwendet. In Nebelfluiden wird es zur Erhöhung der Standzeit des Nebels beigesetzt. Bei der Herstellung von Kunststoffen, Microchips, Farbstoffen sowie Zahnpasta wird die Substanz als Reaktant benötigt.[14] Bei der Reaktion von Glycerin mit einem Gemisch konzentrierter Salpetersäure und konzentrierter Schwefelsäure entsteht „Glyceroltrinitrat“. Diese Verbindung ist der als „Nitroglycerin“ bekannte Explosivstoff, der zusammen mit Kieselgur den Sprengstoff Dynamit bildet.
Aufgrund der zeitweise deutlich gesunkenen Preise werden neue Anwendungsgebiete für Glycerin gesucht. Neben der Verbrennung sind dabei insbesondere die Nutzung als zusätzliches Nährmedium (Cosubstrat) in Biogasanlagen zur Erzeugung von Biogas sowie die Nutzung als Fermentationssubstrat in der Industriellen Biotechnologie Alternativen.
Weiterhin wird geforscht, Glycerin mit Isobuten zu Glycerin-tert-butylether (GTBE; analog zu MTBE und ETBE) umzusetzen für den Einsatz als Kraftstoffzusatz.[18] Seit 2009 setzt die Volkswagen AG aus alten Frittierfetten gewonnenes Glycerin anstelle von aus Erdöl gewonnenem Ethylenglycol als Kühlmittelzusatz (G13) in ihren Fahrzeugmodellen ein.[19]
Glycerin lässt sich in einem neuen Verfahren unter Einwirkung von Ameisensäure zu einem chemischen Grundbaustein – dem Allylalkohol – umsetzen.[20]
Landwirtschaft
Bei steigenden Futtermittelpreisen findet Glycerin als Futtermittel für Wiederkäuer, Schweine und Hühner Interesse.[14]
Medizin

Glycerin wird in der Medizin als Arzneistoff zur Behandlung des Hirnödems eingesetzt. Dazu wird es als 10%ige Lösung infundiert.
In Form glycerinhaltiger Zäpfchen kommt es als Abführmittel (Laxans) zur Anwendung. Die Wirkung entsteht zum einen durch einen reflektorischen Effekt: Durch den Kontakt des Glycerins mit der Rektalschleimhaut wird der Defäkationsreiz gesteigert (siehe auch: Defäkationsreflex). Zum anderen wirkt ein osmotischer Effekt: Durch den Wassereinstrom in das Darmlumen wird der Stuhl weicher und gleitfähiger.
Gegenstand medizinischer Forschung ist die Verwendung von Glycerin zur Aufrechterhaltung der menschlichen Hirn- und Organfunktionen während einer künstlichen Absenkung der Körpertemperatur. Dies könnte für langwierige, schwierige medizinische Operationen von Bedeutung sein. Biologisches Vorbild ist der kanadische graue Laubfrosch Hyla versicolor, dessen Körperzellen sich zur Überwinterung mit Glycerin anreichern.
Glycerin wird auch im Rahmen des Klockhoff-Testes (Glycerol-Belastungstest) zur Diagnose eines Morbus Menière verwendet.
Plattformchemikalie in der Chemieindustrie
Glycerin ist eine Plattformchemikalie, da es in großem Umfang biobasiert gewonnen wird, und sich chemisch als Synthesebaustein für zahlreiche verschiedene Endprodukte eignet.[10][12]
Biologische Bedeutung

Die meisten tierischen und pflanzlichen Fette und Öle sind Triacylglyceride (Triglyceride). Sie bestehen aus dem dreiwertigen Alkohol Glycerin, der über die Hydroxygruppen (–OH) dreifach mit Fettsäuren verestert ist. Sie sind Energiespeicher im Fettgewebe oder in Samen von Ölpflanzen, wie Raps, Soja, Sonnenblume, Kokospalmen oder Ölpalmen. Ähnlich aufgebaut sind Phosphoglyceride. Statt der dritten Fettsäure ist eine Phosphatgruppe verestert und an diese ein Rest gekoppelt, wie Cholin im Lecithin. Somit erhält das Molekül einen polaren und einen apolaren Bereich, was die Bildung einer Membran (Zellmembran) ermöglicht.
Nahezu alle natürlich vorkommenden Glycerinderivate weisen die sn-Konfiguration auf, welche die räumliche Anordnung der Substituenten am mittleren Kohlenstoffatom des Glycerins festlegt.[21]
Einige Insekten enthalten Glycerin als natürliches Gefrierschutzmittel im Blut, um tiefe Temperaturen überleben zu können. Hornissen überleben so bis zu −17 °C und arktische Laufkäfer bis zu −85 °C.[3]
Gesundheitsrisiken
In Lebensmitteln

Als Zusatzstoff in Lebensmitteln gilt Glycerin als unbedenklich. Er wird von der Food and Drug Administration (Lebensmittelüberwachungsbehörde der USA) ohne Höchstmengenbeschränkung (Erlaubte Tagesdosis) als unbedenklich eingestuft.[22] In der EU ist es als Zusatzstoff E422 ebenfalls ohne Höchstmengenbeschränkung zugelassen, 2017 wurde dies in einer Studie nochmals bestätigt.[23]
Der physiologische Brennwert von Glycerin liegt bei 17 kJ/g bzw. 4 kcal/g.[3]
In Wasserpfeifentabak
Glycerin wird neben anderen Feuchthaltemitteln Wasserpfeifentabaken in erheblichen Mengen zugesetzt. Eine Untersuchung des Bundesinstituts für Risikobewertung (BfR) quantifizierte den Feuchthaltemittelgehalt im Wasserpfeifenrauch und konnte erhebliche Mengen der Feuchthaltemittel Glycerin und Propandiol (Propylenglycol) nachweisen. In der Bewertung der Ergebnisse wurde auf mögliche Gesundheitsgefahren hingewiesen, bei denen sich das BfR auf Studien im Zusammenhang mit der Toxikologie von sogenannten TSNAs und PAHs bezieht, welche ebenso bei der Benutzung von Wasserpfeifen entstehen und Teils sowohl im Blut als auch im Urin von Rauchern von Wasserpfeifen nachgewiesen wurden.[24]
Weblinks
Einzelnachweise
- Eintrag zu E 422: Glycerol in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 6. August 2020.
- Eintrag zu GLYCERIN in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. Februar 2020.
- Eintrag zu Glycerol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Februar 2013.
- Eintrag zu Glycerin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. März 2019. (JavaScript erforderlich)
- Organikum – Organisch-chemisches Grundpraktikum, 16. Auflage, Deutscher Verlag der Wissenschaften Berlin 1986, S. 648.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 9. November 2015.
- Eintrag zu Glycerin in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Margarida Bastos, Sven-Ove Nilsson, Maria D.M.C Ribeiro da Silva, Manuel A.V Ribeiro da Silva, Ingemar Wadsö: Thermodynamic properties of glycerol enthalpies of combustion and vaporization and the heat capacity at 298.15 K. Enthalpies of solution in water at 288.15, 298.15, and 308.15 K. In: The Journal of Chemical Thermodynamics. Band 20, Nr. 11, 1988, S. 1353–1359, doi:10.1016/0021-9614(88)90173-5.
- duden.de: Glyzerin
- Mario Pagliaro: Glycerol – The Renewable Platform Chemical. Elsevier, 2017, ISBN 978-0-12-812205-1.
- Anita McConnell: Wilson, George Fergusson (1822–1902). In: Oxford Dictionary of National Biography. Oxford University Press, 2004; online edn, May 2009 accessed 19 April 2015.
- Arno Behr & Thomas Seidensticker: Einführung in die Chemie nachwachsender Rohstoffe – Vorkommen, Konversion, Verwendung. Springer Spektrum, 2018, ISBN 978-3-662-55254-4, 5. Das Koppelprodukt der Oleochemie – Glycerin, S. 85–105.
- Hans G. Schlegel: Allgemeine Mikrobiologie, Herausgeber: Georg Fuchs, Georg Thieme Verlag, Stuttgart; 8. völlig überarbeitete u. erweiterte Auflage erschienen im September 2006, ISBN 3-13-444608-1.
- Was ist Glycerin. (Memento vom 2. Februar 2010 im Internet Archive) Deutsche Melasse Handelsgesellschaft (DMH), abgerufen am 12. Januar 2010.
- The OPTIM Advantage. (Memento vom 25. Mai 2011 im Internet Archive) The Dow Chemical Company, abgerufen am 12. Oktober 2010 (engl.).
- Chemsafe Datenbank für sicherheitstechnische Kenngrößen im Explosionsschutz, PTB Braunschweig/BAM Berlin, abgerufen am 20. März 2019.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Entwicklung von GTBE aus Glycerin; Bericht im Innovationsreport.
- VW Mitarbeiter verbessern mit innovativem Kühlmittelzusatz die CO2-Bilanz der Fahrzeugpalette.
- Neue Methode erlaubt Herstellung von chemisch interessanten Grundbausteinen aus Glyzerin und Erythritol.
- Gregor Cevc: Phospholipids Handbook. CRC Press, 1993, ISBN 978-0-8247-9050-9, S. 2.
- Sec. 182.1320 Glycerin. FDA, abgerufen am 4. März 2018 (englisch).
- EFSA Panel on Food Additives and Nutrient Sources added to Food: Re-evaluation of glycerol (E 422) as a food additive. In: EFSA Journal. 15. März 2017, abgerufen am 4. März 2018 (englisch).
- BfR-Pressemitteilung vom 3. August 2011, Artikel über Studie über Wasserpfeifen als Quelle von toxischen Bestandteilen vom 20. April 2011.