Hydratisierung
Hydratisierung ist ein Begriff in den Naturwissenschaften, besonders in der organischen Chemie. Die Bezeichnung Hydratisierung ist nicht scharf gegenüber „Hydratation“ und „Hydrolyse“ abgegrenzt.[1] Unter Hydratisierung versteht man eine chemische Reaktion, bei der Wassermoleküle unter Bruch einer (H–O)-Bindung an ein Substrat addiert werden. Der Begriff ist nicht zu verwechseln mit der Hydratation, also der Anlagerung von Wasser an Ionen oder im Kristallgitter (Kristallwasser),[2] und der Hydrierung, welche die Addition von Wasserstoff an ein Substrat bedeutet.
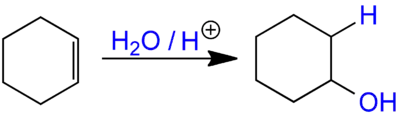
Anlagerung von Wasser an eine C=C-Doppelbindung (Reaktion)
Diese Reaktion wird üblicherweise in stark saurer wässriger Lösung durchgeführt. Während bei der Hydrolyse die Nicht-Wasser-Komponente in zwei Bestandteile zerlegt wird, bleibt sie bei der Hydratisierung als ein Molekül erhalten.
Die allgemeine Formel der Reaktion ist:
Hier als Beispiel die Reaktion von Cyclohexen zu Cyclohexanol, mit Schwefelsäure als Katalysator.
In der Laborpraxis liefert diese Reaktion oft ungewollte Nebenprodukte. Eine Alternative stellt die – aus toxikologischen Gründen nicht mehr zeitgemäße – Oxymercurierung da.

Anlagerung von Wasser an eine C=O-Doppelbindung (Reaktion)
Chloral bildet durch Aufnahme von Wasser ein stabiles geminales Diol, das Chloralhydrat. Dieses ist eine der wenigen Verbindungen, die der Erlenmeyer-Regel widersprechen. Formaldehyd bildet analog mit Wasser Formaldehydhydrat. Das Gleichgewicht liegt zu 99,9 % auf der Seite des Formaldehydhydrats.[4]
Siehe auch
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 1780.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Helvetica Chimica Acta, Zürich 2006, S. 108, ISBN 978-3-906390-29-1.
- Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 484, ISBN 978-3-11-024894-4.
- Joachim Buddrus: Grundlagen der Organischen Chemie, 4. Auflage, de Gruyter Verlag, Berlin, 2011, S. 483, ISBN 978-3-11-024894-4.