Methanol
Methanol (IUPAC), auch Methylalkohol (veraltet Holzgeist oder Holzalkohol), ist eine organisch-chemische Verbindung mit der Summenformel CH4O (Halbstrukturformel: CH3OH) und der einfachste Vertreter aus der Stoffgruppe der Alkohole. Unter Normalbedingungen ist Methanol eine klare, farblose, entzündliche und leicht flüchtige Flüssigkeit mit alkoholischem Geruch. Es mischt sich mit vielen organischen Lösungsmitteln und in jedem Verhältnis mit Wasser.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methanol | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | CH4O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit angenehmem bis stechendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 32,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
0,79 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
65 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
16[3] | ||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser,[2] Ethanol und Diethylether[4] | ||||||||||||||||||
| Dipolmoment |
5,5 ·10−30 C·m[5] | ||||||||||||||||||
| Brechungsindex |
1,3288 (20 °C)[6] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−239,2 kJ/mol (Flüssigkeit) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Mit 60 Millionen Tonnen Jahresproduktion (Stand: 2012) ist Methanol eine der meisthergestellten organischen Chemikalien.[10] Die technische Methanolherstellung erfolgt hauptsächlich katalytisch aus Kohlenstoffmonoxid und Wasserstoff. In der chemischen Industrie dient es insbesondere als Ausgangsstoff bei der Produktion von Formaldehyd, Ameisensäure und Essigsäure.
Methanol und seine Folgeprodukte werden neben der stofflichen Verwendung auch als Energieträger eingesetzt. Mit der Technologie Methanol to Gasoline wird aus Methanol Kraftstoff. Methanol wird für die Synthese von Biodiesel und das Klopfschutzmittel MTBE benötigt. Mit Hilfe von Brennstoffzellen kann es elektrische Energie liefern. Zudem ist es als billiger, hochdichter Langzeitspeicher für die Solar- und Windenergie in Diskussion.[11]
In der Natur kommt Methanol in Baumwollpflanzen, Früchten und Gräsern sowie als Stoffwechselprodukt von Bakterien vor. Beim Bierbrauen, der Weinherstellung oder der Produktion von Spirituosen wird es in geringer Menge, überwiegend durch die Spaltung von Pektinen, als Nebenprodukt freigesetzt. Die Abbauprodukte von Methanol, vor allem Formaldehyd, sind giftig. Deshalb kann die Aufnahme von Methanol zu Erblindung, in höheren Dosen zum Tod führen.
Geschichte

Die antiken Ägypter erhielten Methanol durch Pyrolyse von Holz (Holzgeist) und balsamierten ihre Toten mit einem Substanzgemisch auf dessen Basis. Mit dem Verfahren der trockenen Destillation erhielt der irische Chemiker Robert Boyle 1661 erstmals reines Methanol aus Buchsbaumholz.[12] 1834 klärten die französischen Chemiker Jean-Baptiste Dumas und Eugène-Melchior Péligot die Zusammensetzung dieser wasserklaren Flüssigkeit und gaben ihr auch ihren Namen „methylene“, der sich aus altgriechisch méthy (altgriechisch μέθυ) für berauschendes Getränk oder Wein und hylé (altgriechisch ὕλη) für Holz zusammensetzt.[13]

Die erste Synthese von Methanol gelang Marcelin Berthelot im Jahr 1858 durch Verseifung von Methylchlorid.[14][15]
Die USA gewannen noch 1930 etwa 50 % des hergestellten Methanols durch trockene Destillation von Holz. Hierzu wurde Holz auf circa 500 °C in eisernen Behältern erhitzt. Als fester Rückstand blieb Holzkohle, die gasförmigen Produkte wurden abgezogen und teilweise kondensiert. Das entstehende wässrige Destillat enthielt neben Methanol hauptsächlich Aceton, Essigsäure und Essigsäuremethylester. Die Abtrennung dieser Komponenten und die abschließende Trocknung erforderten mehrere Neutralisations-, Destillations- sowie Trocknungsschritte. Die Ausbeute an Methanol bei der trockenen Destillation betrug je nach verwendetem Rohstoff ungefähr 1 %, erreicht jedoch nie 3 % der eingesetzten Masse.
Die BASF erhielt im Jahr 1913 ein Patent für ein Verfahren zur Methanolgewinnung aus kohlestämmigem Synthesegas. Matthias Pier, Alwin Mittasch und Fritz Winkler entwickelten das Verfahren und setzten es für die erste Großproduktion von Methanol ein, die 1923 im Ammoniakwerk Merseburg der Leuna-Werke begann. Der Prozess nutzte einen oxidischen Zink-Chrom-Katalysator bei einem Druck von 250 atm bis 300 atm. Die Temperaturen lagen zwischen 360 °C und 380 °C und bei einem Verhältnis von Kohlenstoffmonoxid zu Wasserstoff von 1 zu 2,2.[16]
Schon früh erkannten die beteiligten Wissenschaftler, dass auf Kupfer basierende Katalysatoren wesentlich aktiver waren. Diese waren jedoch sehr empfindlich gegenüber den im Synthesegas enthaltenen Schwefelverbindungen. Die Weiterentwicklung der Methanolsynthese war verknüpft mit den Fortschritten in der Kohlevergasungstechnik und den Gasreinigungsprozessen. Nachdem es möglich war, die Gase großtechnisch auf einen Schwefelgehalt von weniger als 0,1 ppm zu begrenzen, entwickelte 1966 das Unternehmen ICI die erste Niederdrucksynthese basierend auf einem Kupferoxid-Zinkoxid-Aluminiumoxid-Katalysator.[17]
Vorkommen
Methanol ist nach Methan das zweithäufigste organische Gas in der Erdatmosphäre und kommt in Konzentrationen von 0,1 bis 10 ppb vor. Es ist eine bedeutende atmosphärische Quelle für Formaldehyd und Kohlenstoffmonoxid. Ein Großteil des in der Atmosphäre vorhandenen Methanols wird von Pflanzen emittiert. In Feuchtgebieten wurden Methanol-Emissionen von 268 Mikrogramm pro Quadratmeter und Stunde gefunden, auf Gras und Weideflächen wurden Werte zwischen 100 und 500 Mikrogramm pro Quadratmeter und Stunde beobachtet.[18][19] Die Methanolfreisetzung erfolgt durch Pektinmethylesterase (PME) aus Pektin (teilweise mit Methanol veresterte Poly-Galacturonsäure), etwa als Reaktion auf Angriff durch Fressfeinde. Die Gesamtmenge des von Pflanzen freigesetzten Methanols wird auf über 100 Millionen Tonnen pro Jahr geschätzt.[20]
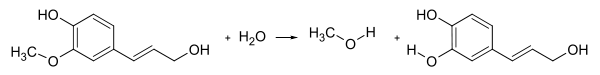
Methylester und -ether, in denen Methanol chemisch gebunden ist, kommen in vielen Früchten (Methylester) und in Lignin, einem Bestandteil der pflanzlichen Zellwand (Phenylmethylether), vor. Die im Lignin vorhandenen Methyl-Phenyl-Ethergruppen der Coniferyl- und Sinapylalkoholeinheiten spalten sich unter Aufnahme von Wasser in Methanol und einen phenolischen Rest.
Methanol wird regelmäßig durch enzymatische Verseifung der Galacturonsäuremethylester bei der Maischung freigesetzt. Um den wegen der Giftigkeit des Methanols unerwünschten Gehalt an Methanol im Endprodukt so gering wie möglich zu halten, wird versucht, durch geeignete Methoden die Freisetzung des Methanols zu minimieren. So kann die pektolytische Enzymaktivität durch Säuregaben minimiert werden.[21] Weiterhin haben der Gehalt an Schwefeldioxid und die Temperatur der Maischung einen Einfluss auf die enzymatische Aktivität. Durch kurzzeitiges Erhitzen der Maische auf bis zu 90 °C und schnelles Abkühlen kann erreicht werden, dass der Methanolgehalt um 40 % bis 90 % verringert wird.[21] Durch geeignete verfahrenstechnische Schritte bei der Destillation kann der Methanolgehalt in der Spirituose gering gehalten werden, etwa durch Kondensation leichtflüchtiger Bestandteile.[21] Alkoholika enthalten zum Teil beträchtliche Mengen an Methanol. Bei einer Untersuchung verschiedener Fruchtsäfte und Alkoholika wies das Untersuchungsamt Baden-Württemberg in Spirituosen Spitzenwerte bis zu 4,7 g·l−1 Methanol nach, in Weinen und Fruchtsäften bis zu 0,2 g·l−1.[22]
Tabak enthält zum Teil ligninhaltige Anteile, deren Phenylmethylether pyrolytisch gespalten werden und für das Auftreten von Methanol im Tabakrauch verantwortlich sind.[23] Nach dem gleichen Prinzip setzt Räucherrauch Methanol frei. Bei der Verdauung von Aspartam, einem Methylester des Dipeptids der α-Aminosäuren L-Asparaginsäure und L-Phenylalanin, wird Methanol abgespalten. Beim Genuss normaler Mengen an mit Aspartam gesüßten Lebensmitteln werden jedoch keine toxikologisch bedenklichen Werte im Bezug auf Methanol erreicht.[24]
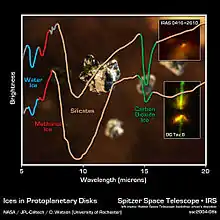
Methanol kommt im interstellaren Raum häufig vor, wobei der Bildungsmechanismus nicht geklärt ist. Im Jahr 2006 gelang Astronomen mit dem MERLIN-Radioteleskop am Jodrell-Bank-Radioobservatorium die Beobachtung einer großen Methanolwolke.[25][26] Mit den empfindlichen Instrumenten des Spitzer-Weltraumteleskops gelang der Nachweis von Methanol in protoplanetarischen Scheiben um junge Sterne herum.[27]
Herstellung
Methanol ist eine organische Grundchemikalie und ein mengenmäßig bedeutender großtechnisch hergestellter Alkohol. Im Jahr 2008 betrug der weltweite Methanolverbrauch 45 Millionen Tonnen. Die größten Exporteure von Methanol waren im Jahr 2006 die karibischen Staaten wie Trinidad und Tobago mit 7,541 Mio. Tonnen, Chile und Argentinien mit 3,566 Mio. Tonnen und die Staaten am persischen Golf mit 5,656 Mio. Tonnen. Die größten Importeure waren die Vereinigten Staaten mit 7,112 Mio. Tonnen, West-Europa mit 8,062 Mio. Tonnen, Taiwan und Südkorea mit zusammen 2,361 Mio. Tonnen und Japan mit 1,039 Mio. Tonnen.[28]
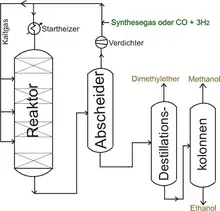
Die technische Herstellung von Methanol erfolgt ausschließlich in katalytischen Verfahren aus Synthesegas, einem Gemisch von Kohlenstoffmonoxid und Wasserstoff im Verhältnis von etwa 1:2. Diese Verfahren werden nach den Reaktionsdrücken in drei Bereiche unterteilt. Das zunächst entwickelte Hochdruckverfahren arbeitete auf Grund der niedrigen Katalysatoraktivität und der Volumenkontraktion der Reaktion bei Drücken von 250 bis 350 bar und Temperaturen von 360 bis 380 °C. Das Mitteldruckverfahren arbeitet bei 100 bis 250 bar und 220 bis 300 °C, das Niederdruckverfahren bei 50 bis 100 bar und 200 bis 300 °C. Jedes Verfahren arbeitet mit spezifischen Katalysatoren und Massen-Verhältnissen von Kohlenmonoxid zu Wasserstoff.
Das zur Methanolsynthese notwendige Synthesegas kann aus fossilen Rohstoffen wie Kohle, Braunkohle, Erdölfraktionen und Torf hergestellt werden. Beim Einsatz von nachwachsenden Rohstoffen wie Holz, Biogas oder anderer Biomasse wird das Produkt auch als Biomethanol bezeichnet.[13] Weiterhin können Müll oder Klärschlamm zur Synthesegasherstellung eingesetzt werden.
Die Dampfreformierung und die partielle Oxidation von Erdgas, nach aktuellen Schätzungen die größte ökonomisch nutzbare Kohlenwasserstoffquelle, sind neben der Kohle der Hauptlieferant für Synthesegas. In Nordamerika und Europa wird meist Erdgas als Rohmaterial genutzt, in China und Südafrika basiert die Synthesegasherstellung auf Kohle oder Braunkohle. 2005 hat China 5,4 Millionen Tonnen Methanol erzeugt, davon 65 % oder 3,5 Millionen Tonnen auf Kohle basierend.[29]
Für die Bildung von Methanol aus Synthesegas können die folgenden Gleichungen formuliert werden:
und
Wegen ökonomischer Vorteile bei niedrigen Synthesedrücken und niedrigen Temperaturen wird Methanol größtenteils im Niederdruck-Verfahren produziert. Als Nebenprodukt werden Dimethylether, Ameisensäuremethylester und Ethanol gebildet, die abdestilliert werden können.[30] Den ökonomischen Nachteil des höheren Drucks gleichen die Mitteldruckverfahren durch höhere Ausbeuten aus. Das Hochdruckverfahren wird heute nicht mehr durchgeführt.
China ist heutzutage der größte Produzent und Verbraucher von Methanol. Es wird erwartet, dass allein die chinesische Produktionskapazität in den nächsten Jahren 60 Millionen Tonnen pro Jahr übersteigen wird. Während gegenwärtig das meiste Methanol im Chemiesektor verwendet wird, hat der Einsatz im Kraftstoffsektor die höchsten Steigerungsraten. Im Jahr 2008 nutzte China circa drei Millionen Tonnen Methanol als Mischkomponente zur Herstellung von Kraftstoffblends. Probleme für eine breite Einführung und höhere Methanolanteile im Kraftstoff bereiten die Entwicklung geeigneter Motoren und anderer Triebwerkskomponenten, die mit Methanol verträglich sind.[31] In Deutschland wurden im Jahr 2000 circa zwei Millionen Tonnen hergestellt, davon etwa 1,4 Millionen Tonnen aus Rückstandsölen.
Eigenschaften
| Physikalische Eigenschaften | |
| Schallgeschwindigkeit | 1123 m·s−1 (25 °C)[32] |
| Oberflächenspannung | 0,0226 N·m−1 (20 °C gegen Luft)[33] |
| Dynamische Viskosität | 0,544 · 10−3 Pa·s (25 °C)[34] |
| Dielektrizitätskonstante | 33,8 = (25 °C)[35] |
| Brechungsindex | 1,326 (25 °C, Na-D-Linie)[34] |
| Isotherme Kompressibilität | 12·10−5 bar−1 (20 °C)[36] |
| Wärmekapazität | 81,08 J·mol−1·K−1 (25 °C)[34] |
| Selbstentzündungstemperatur | 470 °C[34] |
| Kritische Temperatur | 512,5 K[34] |
| Kritischer Druck | 8,084 MPa[34] |
| Tripelpunkt | 175,5 K[37] |
| Magnetische Suszeptibilität[38] | 5,3·10−7 cm³·g−1 |
| Viskosität[39] | 0,808 mPa·s (0 °C) 0,690 mPa·s (10 °C) 0,593 mPa·s (20 °C) 0,449 mPa·s (40 °C) 0,349 mPa·s (60 °C) |
| Standardbildungsenthalpie | −238 kJ/mol[40] |
| Standardverdampfungsenthalpie | +37,4 kJ/mol[40] |
| Molare Standardentropie | 127,2 J/(mol·K)[40] |
| Standardverbrennungsenthalpie | −726 kJ/mol[40] |
| Van-der-Waals-Gleichung[41] | a = 964,9 l2·kPa/mol2 b = 0,06702 l/mol |
Alkohole, die sich formal von den Alkanen ableiten, werden als Alkanole bezeichnet. Methanol ist der einfachste Alkohol und bildet das erste Glied der homologen Reihe der Alkanole. Vormals wurden viele Alkohole nach einem Vorschlag von Hermann Kolbe als Derivate des Methanols – abgeleitet von Carbinol – als Carbinole bezeichnet. Seit 1957 empfiehlt die IUPAC, diese Nomenklatur nicht mehr zu verwenden.[42]
Physikalische Eigenschaften
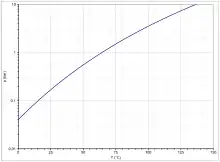
Methanol ist unter Normalbedingungen eine farblose, leicht bewegliche Flüssigkeit. Der Siedepunkt liegt bei 65 °C. Methanol erstarrt unterhalb von −98 °C in Form von farblosen Kristallen. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend
mit P in bar und T in Kelvin, sowie A = 5,20409, B = 1581,341 und C = −33,5 im Temperaturbereich von 288 bis 357 K.[43]

Durch die Polarität der Hydroxygruppe bilden sich zwischen den Methanolmolekülen Wasserstoffbrückenbindungen aus. Während der Schmelzpunkt fast genau dem des Methylchlorids entspricht, führt die Ausbildung der Wasserstoffbrücken im flüssigen Zustand zu einem relativ hohen Siedepunkt im Vergleich zu den Methylhalogeniden. Die Dissoziationsenergie der Wasserstoffbrückenbindung beträgt etwa 20 kJ/mol.[44]
Methanol bildet mit einer großen Anzahl organischer Verbindungen wie zum Beispiel Acetonitril, Benzol, Chloroform, Cyclopentan, Methylmethacrylat und Tetrahydrofuran Azeotrope. Mit Wasser mischt sich Methanol unter Volumenkontraktion. Bei einem Volumenanteil von 55 % bis 60 % Methanol vor dem Mischen wird ein Mischvolumen von 96,36 % erhalten.[45]
Methanol kristallisiert im orthorhombischen Kristallsystem mit den Gitterparametern a = 643 pm, b = 724 pm und c = 467 pm. Die Struktur lässt sich als ein über Wasserstoffbrücken gebundenes Kettenpolymer beschreiben. Bei weiterer Abkühlung findet ein Phasenübergang durch Faltung der Polymerkette in ein monoklines Kristallsystem statt.[44][46]
Molekulare Eigenschaften

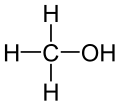
Das Methanolmolekül besteht aus einem Kohlenstoff-, einem Sauerstoff- und vier Wasserstoffatomen. Das Molekül weist als Struktureinheiten eine Methylgruppe mit trigonaler Symmetrie und eine Hydroxygruppe auf. Die Daten zur Molekülgeometrie sind in der Skizze ausgewiesen. Der Bindungswinkel zwischen dem Kohlenstoff-, dem Sauerstoff- und dem Wasserstoffatom beträgt 108,9 ° und ist gegenüber dem Tetraederwinkel von 109,47 ° leicht kontrahiert. Die Bindungslänge zwischen dem Sauerstoff- und Wasserstoffatom beträgt 96 pm und ist damit auf Grund der größeren Elektronegativität des Sauerstoffs kleiner als die Kohlenstoff-Wasserstoff-Bindungslänge der Methylgruppe, die 110 pm (1,10 Å) beträgt.[47]
Die Rotationshemmung der Kohlenstoff-Sauerstoff-Einfachbindung wurde mit 4,48 kJ/mol bestimmt[48] und beträgt damit nur ein Drittel der Rotationhemmung zweier Methylgruppen, etwa im Ethan.
Chemische Eigenschaften
Aufgrund der polaren Hydroxygruppe lässt sich Methanol in jedem Verhältnis mit Wasser mischen. Die Ähnlichkeit zu Wasser zeigt sich im Lösungsvermögen einiger Mineralsalze wie Calciumchlorid und Kupfersulfat in Methanol. Es ist ferner in Diethylether, in Kohlenwasserstoffen und vielen anderen organischen Lösungsmitteln unter Wasserausschluss gut löslich. In einigen Lösungsmitteln können bereits geringe Anteile von Wasser eine Entmischung bewirken. Methanol ist wenig löslich in pflanzlichen Fetten und Ölen.[34]
Der pKs-Wert von Methanol liegt bei 16.[49] Methanol reagiert in wässriger Lösung sauer. Methanol kann mit starken Basen zum Methanolat deprotoniert werden. Mit starken Säuren wie Schwefelsäure lässt sich Methanol protonieren.
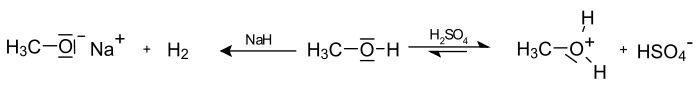
Methanol verbrennt mit schwach blauer, fast unsichtbarer Flamme zu Kohlenstoffdioxid und Wasser. Der Flammpunkt liegt bei 9 °C. Methanoldämpfe bilden mit Luft im Bereich von 6 % bis 50 % explosionsfähige Gemische. Mit Alkali- und Erdalkalimetallen reagiert Methanol unter Bildung von Wasserstoff und der Methanolate. Es reagiert leicht mit vielen Oxidationsmitteln wie Bariumperchlorat, Brom oder Wasserstoffperoxid. Verschiedene Kunststoffe, Lacke und Kautschuk werden von Methanol angegriffen.
Mit Carbonsäuren reagiert Methanol in Säure- oder Basenkatalyse unter Wasserabgabe zu Methylestern; mit Carbonsäureestern ist eine Umesterung unter Freisetzung und Entfernung der anderen Alkoholkomponente aus dem Reaktionsgemisch oder im Methanol-Überschuss möglich.[50]
Methanol lässt sich katalytisch zu Formaldehyd oxidieren.[51] Mit Aldehyden und Ketonen reagiert Methanol in Gegenwart saurer Katalysatoren zu Halbacetalen beziehungsweise Dimethylacetalen, die als Schutzgruppe in der organischen Chemie eingesetzt werden können.[52]
Verwendung

Methanol wird unter anderem als Ausgangsmaterial in der chemischen Industrie oder als Energielieferant genutzt. Die stoffliche Verwertung als Chemierohstoff erfordert ein besonders reines Produkt. Rohmethanol kann als Energieträger in stationären Anlagen verfeuert werden.[30] Ein Gemisch aus reinem Methanol und Wasser liefert außerdem die chemische Energie zum Betrieb von Brennstoffzellen, die sie in elektrische Energie wandeln. Die Verwendung als Kraftstoff, so genanntes Fuel-Methanol, wird intensiv untersucht. Möglich ist der Zusatz zu herkömmlichen Motorkraftstoffen oder die Verwendung reinen Methanols. Methanol wird als polares Lösungsmittel eingesetzt. Im Rectisolverfahren dient es zur Abtrennung von sauren Komponenten wie Kohlenstoffdioxid oder Carbonylsulfid aus Gasströmen.[54] Im Zeitraum von 2005 bis 2009 nahm die Gesamtmenge des stofflich verwendeten Methanols um etwa 6 % zu, während die energetische Nutzung eine Steigerungsrate von 55 % aufwies.[53]
Methanol als Chemierohstoff
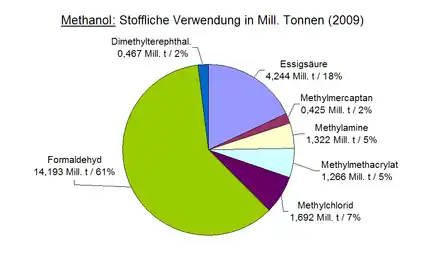
Methanol ist ein wichtiger Ausgangsstoff für Synthesen in der chemischen Industrie. Mengenmäßig von großer Bedeutung sind die primären Derivate Formaldehyd, Essigsäure, MTBE, Methylmethacrylat, Methylchlorid und Methylamine.[53] Diese werden zu einer Reihe sekundärer und tertiärer Derivate weiterverarbeitet. Bekannte Beispiele sind Vinylacetat, Essigsäureanhydrid, Phenol-Formaldehyd-Harze und Melaminharze.
Formaldehyd
Die größte Menge an zu Formaldehyd verarbeiteten Methanol wird durch Oxidation mit Sauerstoff an Silber-Katalysatoren oder im Formox-Prozess an Eisenoxid/Molybdänoxid/Vanadiumoxid-Katalysatoren bei 400 °C umgesetzt.
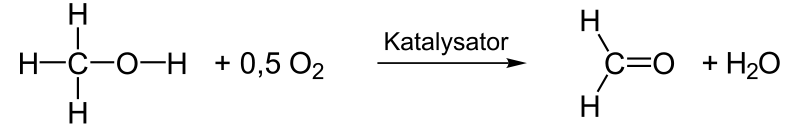
Der Formaldehyd-Markt ist zwischen 2006 und 2010 in Nordamerika um etwa 15 % geschrumpft, im Wesentlichen bedingt durch den Rückgang der Nachfrage in der Möbel- und Baubranche. Das Marktvolumen in Nordamerika betrug etwa 4 Mio. Tonnen im Jahr 2010.[55] Formaldehyd wird überwiegend zur Herstellung von Harnstoff-, Phenol- und Melamin-Formaldehydharzen verwendet, deren größte Verbraucher die Bau-, die Automobil- und die Holzindustrie sind. Formaldehydharze werden für die Herstellung von Holzprodukten, etwa als Bindemittel für Hartfaser- und Spanplatten, verwendet. Schnell wachsende Märkte sind die Herstellung von Polyoxymethylen, Methylendiisocyanat und 1,4-Butandiol.[56] Im Jahr 2005 war China der weltgrößte Formaldehyd-Produzent mit einer Kapazität von 11 Millionen Tonnen.[57]
Essigsäure
Methanol wird zur Essigsäure-Herstellung durch Umsetzung mit Kohlenstoffmonoxid nach dem Monsanto-Prozess sowie zur Essigsäureanhydrid-Herstellung über Methylacetat nach dem Tennessee-Eastman-Essigsäureanhydrid-Prozess eingesetzt. Die katalytisch aktive Spezies ist der anionische Rhodium-Komplex cis-[Rh(CO)2I2]− mit Iodwasserstoff als Co-Katalysator.[30]
Im katalytischen Zyklus reagiert Methanol zunächst mit Iodwasserstoffsäure zu Methyliodid, das sich oxidativ an den Rhodiumkomplex addiert. Kohlenmonoxid insertiert in die Metall-Methyl-Bindung unter Bildung eines Formyl-Komplexes. Dieses wird als Säurehalogenid aus dem Komplex eliminiert. Das Säureiodid reagiert mit Wasser wieder zur Iodwasserstoffsäure und Essigsäure.[30]
Bei der Herstellung von Essigsäureanhydrid wird ein Teil des Produkts mit Methanol in Methylacetat überführt und in den Prozess zurückgeführt. Das Essigsäureanhydrid wird dabei vollständig auf Basis von Synthesegas gewonnen.[30]
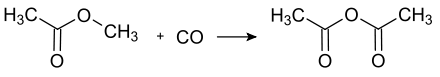
Ein weiteres Folgeprodukt dieser Syntheseschiene ist Vinylacetat. Durch Hydrocarbonylierung eines Gemisches aus Essigsäureanhydrid und Methylacetat in Gegenwart von homogenen Rhodiumkatalysatoren wird bei Temperaturen um 150 °C und einem Druck von etwa 40 bar bis 70 bar Ethylidendiacetat gebildet, welches sich bei erhöhter Temperatur unter Säurekatalyse in Vinylacetat und Essigsäure spalten kann.[30]
Andere Folgeprodukte
Methylmethacrylat, das Monomer des Polymethylmethacrylats, wird durch Hydrolyse und anschließender Veresterung des aus Acetoncyanhydrin gebildeten 2-Methylpropennitrils mit Schwefelsäure in Gegenwart von Methanol hergestellt.[30]
Methanol kann mit Hilfe dotierter Kupfer-Katalysatoren zum Methylformiat dehydriert werden. Nach Abtrennung des erzeugten Wasserstoffs wird das Methylformiat zunächst in kaltem Methanol ausgewaschen und anschließend destillativ getrennt.[30]
Durch Veresterung kann eine Reihe von Folgeprodukten hergestellt werden. Chlormethan ist selektiv durch Umsatz mit preiswerter Salzsäure herstellbar.[58] Fettsäuremethylester können durch herkömmliche Umesterungsverfahren hergestellt werden. Durch zweistufige Oxidation von p-Xylol mit einem intermediären Veresterungsschritt wird Dimethylterephthalat gewonnen.[59]
Die Reaktion von Methanol mit Ammoniak unter Einsatz von Aluminiumsilikaten als Katalysator liefert Gemische von Methylaminen, ein Vorprodukt für Farbstoffe, Medikamente und Pflanzenschutzmittel.[59]
Durch Umsetzung von Methanol an Zeolithen des Typs ZSM-5 im Methanol-to-Olefins-Verfahren gelingt die Herstellung kurzkettiger Olefine wie Ethylen, Propylen und Butenen, die zuvor meist durch Steamcracken von leichtem Naphtha gewonnen wurden. Im ersten Schritt bildet sich Dimethylether, der unter Wasserabspaltung zu Ethen weiterreagiert.[30]
Durch Variation der Reaktionsbedingungen kann die Selektivität zu aromatischen Produkten verändert werden (Methanol to Aromatics, MtA).
Methanol im Energiesektor
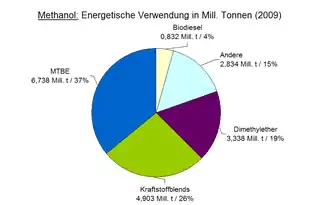
Methanol kann auf verschiedene Weise als Energielieferant dienen.[17] Es kann als Rohstoff für die chemische Umwandlung in andere Kraftstoffe genutzt werden. Weiterhin kann Methanol als 15%iges Gemisch mit Benzin (M15) oder direkt als Reinmethanol (M100) eingesetzt werden.[60] Die Energiedichte (Heizwert) beträgt etwa die Hälfte der von Motorenbenzin. Reines Methanol kann als Wasserstofflieferant für Brennstoffzellen dienen, oder in der Direktmethanolbrennstoffzelle direkt (d. h. ohne das Zwischenprodukt Wasserstoff) zur Bereitstellung elektrischer Energie genutzt werden. In Kombination mit der katalytischen Erzeugung des Energiespeicherstoffs kann ein geschlossener oder offener Kreislauf zur Lösung des Energiepufferproblems alternativer Energiequellen aufgebaut werden.[61] Mehrere Herstellungsvarianten unter Einbeziehung elektrischer oder photonischer Reaktionen sind bereits in Anwendung und werden derzeit aktiv in Richtung höherer Effizienz weiterentwickelt.[62] Während des Zweiten Weltkriegs wurden methanolhaltige Gemische als Treibstoff für Raketen- und Flugzeugtriebwerke (MW-50) verwendet. So wurde C-Stoff, ein Gemisch aus Methanol, Hydrazin, Wasser und Kaliumtetracyanidocuprat (I) (K3[Cu(CN)4]) zusammen mit T-Stoff, hochkonzentriertem Wasserstoffperoxid, als selbstentzündlicher, hypergoler Treibstoff genutzt.[63]
Methanol als Kraftstoff
| Methanol-Kraftstoff | |
|---|---|
| Andere Namen |
M100, Methol, Spritol, Methyloxyhydrat, Methynol, Pyroholzether, Spiritol, Holzin, Holzalkohol, Holzspiritus, Karbinol, Holzgeist, Carbinol, Methylalkohol[2] |
| Kurzbeschreibung | Ottokraftstoff für angepasste Motoren |
| Charakteristische Bestandteile |
Methanol |
| CAS-Nummer | |
| Eigenschaften | |
| Aggregatzustand | flüssig |
| Dichte |
0,79 kg/l |
| Heizwert |
15,7 MJ·l−1 = 19,9 MJ·kg−1[34] |
| Brennwert |
17,9 MJ·l−1 = 22,7 MJ·kg−1[34] |
| Oktanzahl |
106 ROZ[64] |
| Flammpunkt |
9 °C[2] |
| Zündtemperatur | 440 °C[2] |
| Explosionsgrenze | 6–50 Vol.-%[2] |
| Temperaturklasse | T2[2] |
| Sicherheitshinweise | |
| UN-Nummer |
1230[2] |
| Gefahrnummer |
336[2] |
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |
Methanol kann in vielfältigen Varianten entweder direkt als Kraftstoff oder Kraftstoffzusatz eingesetzt werden. Zum Einsatz in Otto- und Diesel-Verbrennungsmotoren sind heute mehrere Möglichkeiten bekannt. Nach der Europäischen Norm für Ottokraftstoffe EN 228 sind maximale Zumischungen von 3 Volumenprozent zum Kraftstoff zulässig unter Zusatz von Stabilisierungsmitteln. Derartige geringe Zumischungen können von heutigen Ottomotoren ohne Anpassungen verkraftet werden. Aus Kostengründen nutzte Deutschland bisher diese Möglichkeiten nicht aus.
Weiterhin kann Methanol als Zumischung in höheren Konzentrationen zum Benzin oder als nahezu reiner Methanolkraftstoff eingesetzt werden. In Deutschland sponserte das Bundesministerium für Bildung und Forschung in den 1980er Jahren einen Großversuch mit einem M15-Kraftstoff, bestehend aus 15 % Methanol und 85 % Benzin, und mit einem M85-Kraftstoff mit entsprechenden Verhältnissen; es testete diese mit über 1000 Fahrzeugen aller deutschen Autohersteller mit Unterstützung der Mineralölindustrie sowie zahlreicher Forschungsinstitute ausführlich.[65] Die Fahrzeuge wurden für den Betrieb mit diesen Kraftstoffen werkstoff- und gemischbildungsseitig angepasst. Die USA, Japan, China, Neuseeland und Südafrika führten ähnliche Versuche durch. Ebenfalls testete dieses Programm einen Methanol-Diesel-Mischkraftstoff mit 20 % Methanol in PKWs.
Für die Verwendung von reinem Methanol (M100) wurden Nutzfahrzeug-Dieselmotoren entsprechend modifiziert. Wegen der niedrigen Cetanzahl von Methanol ist ein Motorbetrieb als Selbstzünder nicht möglich. Deshalb setzten die Tester zusätzliche Zündhilfen in Form von Diesel-Piloteinspritzung oder Kerzen- oder Glühzündung ein. Der Tanker Lindanger ist das Typschiff für sieben Produktentanker, deren Dual-Fuel Zweitaktmotoren mit dem Brennstoff Methanol angetrieben werden. Die Dual-Fuel-Hauptmotoren vom Typ B&W 6G50ME-9.3 LGIB mit einer Nennleistung von 10.320 kW bei 100/min werden mit Methanol und MGO als Zündöl gefahren. Sie wurden von MAN B&W in Kopenhagen entwickelt und von der Motoren- und Maschinenbau-Abteilung von Hyundai Heavy Industries gebaut.[66]
Auch ein Zweistoffbetrieb Diesel-Methanol ist möglich. Der von Franz Pischinger entwickelte Methanol-Glühzündermotor weist gute Emissionswerte bei niedrigem Verbrauch auf.[67][68]
In für Reinmethanol M100 und M85 angepassten Motoren lassen sich im Vergleich zu Benzinmotoren eine bis zu 10 % höhere Motorleistung und ein etwa 15 % besserer thermischer Wirkungsgrad erzielen, dadurch ein günstigerer energetischer Kraftstoffverbrauch. Als flüssiger Kraftstoff ist Methanol wegen der einfachen Handhabung im Vergleich zu gasförmigen Kraftstoffen besonders für den Verkehrssektor geeignet, sowohl für den Straßen, Wasser- und Schienenverkehr sowie mit Einschränkungen in der Luftfahrt.
Während sich bei den limitierten Emissionen für Kohlenwasserstoffe, Kohlenmonoxid und Stickoxide mit der heute bei Ottomotoren üblichen Katalysatortechnik keine Vorteile mehr ergeben, sind bei den nichtlimitierten Emissionen geringe Vorteile zu verzeichnen. So emittiert Methanol beispielsweise keine Aromaten wie Benzol, Toluol und niedrigere polyzyklische aromatische Kohlenwasserstoffe und hat ein geringes Ozonbildungspotential. Nachteilig ist dagegen die erhöhte Formaldehydemission, wobei das Niveau bei allen hier aufgeführten Emissionskomponenten wegen des Katalysators sehr niedrig ist. Bei Dieselkonzepten entfallen weitgehend Schwefelemissionen und Rußbildung. Methanol hat knapp 50 % des Heizwertes von Diesel und Benzin.[69]
Unvorteilhaft ist die Giftigkeit von Methanol, die Vorsichtsmaßnahmen bei der Betankung und bei Arbeiten am Fahrzeug erfordert. Da Methanol biologisch abbaubar ist, ist die Umweltgefährdung bei eventuellen Unfällen gering.[70]
Im US-Motorsport ersetzten in den 1960er Jahren die amerikanischen Formel-Rennserien (CART, Indy Car) nach schweren Feuerunfällen beim Indianapolis 500 das mit Wasser nicht löschbare Benzin durch Methanol.[71] Ein Nachteil dabei ist, dass brennendes reines Methanol kaum sichtbar ist. So wird nach dem Tankvorgang im Rennen stets Wasser über den Tankstutzen gespritzt, um etwaig ausgelaufenes Methanol wegzuspülen, bevor es sich an heißen Teilen entzündet. Methanol ist – wie Ethanol – besonders für aufgeladene Motoren geeignet.[72] Dragster mit Achtliter-Kompressor-V8-Motoren der Klasse Top Methanol erzielen Leistungen über 3500 PS.
Im Modellbau wird Methanol mit Nitromethan-Zusatz in Glühzündermotoren verwendet. Die Verwendung ist stark rückläufig, weil die Modellbau-Treibstoffe teuer sind und moderne Elektromotoren mit Lithium-Ionen-Akkumulatoren immer kostengünstiger und leiser werden.
Methanol in Brennstoffzellen

Es gibt zwei Wege, wie Methanol genutzt werden kann, um elektrische Energie aus Brennstoffzellen zu erhalten: Entweder dient das Methanol als Wasserstofflieferant für eine Wasserstoff-Brennstoffzelle oder es wird in der Brennstoffzelle direkt umgesetzt. Für die Versorgung von Wasserstoff-Brennstoffzellen muss das Methanol mit Wasser zunächst unter Energiezufuhr in Wasserstoff und Kohlenstoffdioxid CO2 umgewandelt werden. Für diesen Schritt wird ein Methanol-Reformer genutzt (siehe Indirekte Methanolbrennstoffzelle). Dann wird der Wasserstoff vom CO2 (und von eventuellem CO) getrennt und der Brennstoffzelle zugeführt und dort umgesetzt. Alternativ zur Kombination aus Reformer und H2-Zelle können die dafür geeigneten Direktmethanolbrennstoffzelle das Methanol-Wassergemisch unmittelbar nutzen, also ohne vorherige Umwandlung in Wasserstoff. Diese vom Funktionsprinzip her die einfachere Variante wird für Kleinverbraucher wie Kühlgeräte oder Fernseher beim Camping oder Messeinrichtungen bevorzugt. Nach Herstellerangaben wurden bis 2018 über 40.000 solcher Brennstoffzellen verkauft.[73]
Die ablaufenden Reaktionen sind:
Anodenreaktion:
Kathodenreaktion:
Gesamtreaktion:
Als Elektrolyt verwendet dieser Zellentyp eine Protonen-Austausch-Membran. Der Anode wird das Methanol-Wasser-Gemisch zugeführt und das Methanol dort oxidiert, wobei als Abgas Kohlenstoffdioxid entsteht. An der Kathode reagieren die Wasserstoffionen mit Luftsauerstoff zu Wasser. Ein Problem der Direkt-Methanol-Brennstoffzelle ist die Durchlässigkeit der Membran für Methanol, wodurch der Wirkungsgrad sinkt.
Methanolderivate als Kraftstoff
Die primären Derivate des Methanols werden in vielfältiger Weise bereits als Kraftstoff oder Kraftstoffzusatz verwendet. Bekannt ist die Verwendung des Oktanzahlboosters MTBE, das in den Vereinigten Staaten 1979 vom EPA in Konzentrationen zwischen 2 und 5 % genehmigt wurde.[74] Das Derivat Dimethylether (DME) dient als Dieselersatzkraftstoff. Methanol wird zur Umesterung von Pflanzenöl und Herstellung von Biodiesel genutzt. Vorteile der Derivate sind unter anderem deren Schwefel- und Aromatenfreiheit. Die Energiedichte ist gegenüber reinem Methanol erhöht.
Biodiesel

In der Biodieselherstellung wird Methanol zur Umesterung von pflanzlichen Ölen eingesetzt. Dazu wird zum Beispiel Rapsöl mit Methanol unter Basenkatalyse umgeestert. Das Methanol wird über das stöchiometrische Verhältnis von Glycerinester zu Alkohol hinaus zugegeben, um die Reaktion auf die Seite des Methylesters zu verschieben. Als Nebenprodukt fällt Glycerin an. Nach der Beendigung der Reaktion werden die Phasen getrennt und der Biodiesel zur Aufarbeitung gewaschen und destilliert. Moderne Biodieselanlagen weisen eine Kapazität von rund 200.000 Tonnen pro Jahr auf; die gesamte in Deutschland installierte Kapazität betrug im Jahr 2006 3.840.500 t.[75]
Methanol to Gasoline
Im Methanol-to-Gasoline-Verfahren wird Methanol zur Herstellung hochoctaniger Vergaserkraftstoffe eingesetzt. Durch Umsatz an Zeolith-Katalysatoren des Typs ZSM-5 wird über das Zwischenprodukt Dimethylether ein Kohlenwasserstoffgemisch gebildet.[76] Die Reaktion findet im ersten Schritt über die Dehydratisierung des Dimethylethers zu Ethen und anderen leichten Olefinen statt, die in weiteren Schritten zu Produkten mit fünf und mehr Kohlenstoffatomen oligomerisieren und zyklisieren können. Der Reaktionsmechanismus ist komplex und bis heute Gegenstand intensiver Untersuchungen.[77][78]
Die Verweilzeiten sind länger und Temperaturen höher als bei den verwandten MtO- und MtA-Verfahren. Der erhaltene Ottokraftstoff ist schwefelfrei und weist niedrige Benzol-Gehalte auf. Der Prozess kann im Festbett- oder Fluidbett-Verfahren durchgeführt werden. Das Fluidbett-Verfahren besitzt Vorteile durch eine kontinuierliche Katalysatorregenerierung, die niedrigere Drücke erlaubt. TotalEnergies errichtete eine Pilotanlage mit einer Produktionsleistung von 1700 Tonnen Kraftstoff pro Tag in Neuseeland. Rheinbraun betrieb eine weitere Pilotanlage über längere Zeit im nordrhein-westfälischen Berrenrath. Sie wurde gemeinsam von Uhde und Lurgi errichtet.[79]
MTBE
Durch säurekatalysierten Umsatz von Methanol mit Isobuten wird Methyl-tertiär-butylether (MTBE), ein Oktanzahlverbesserer, hergestellt. Der Sauerstoffgehalt von MTBE bewirkt in Vergasermotoren eine bessere Verbrennung der Kraftstoffe. Die dadurch erreichte Luftverbesserung war ausschlaggebend dafür, dass der Einsatz von Oxygenaten, einer Gruppe von Chemikalien, die den Sauerstoffgehalt des Benzins erhöhen, im Clean Air Act (CAA, Verordnung zur Luftreinhaltung) der Vereinigten Staaten von 1992 vorgeschrieben wurde. Das in der Verordnung vorgegebene Ziel von 2,7 Gew.-% Sauerstoff im Kraftstoff erreichten die Raffinerien vor allem durch den Einsatz von MTBE.[80]
.png.webp)
Nachdem MTBE in Grundwasser nachgewiesen wurde, verboten 2003 Kalifornien und anderen Bundesstaaten der USA die Verwendung von MTBE als Oktanzahlverbesserer, da Konzentrationen von circa 40 µg MTBE pro Liter Wasser die Trinkwasserqualität beeinträchtigen.[81] In Europa und Deutschland wurde der Einsatz von MTBE durch die Richtlinie 85/535/EWG und später durch die Kraftstoffqualitätsrichtlinie 98/70/EG, wonach eine Beimischung bis zu 15 Vol.-% erlaubt ist, verstärkt. In Deutschland und der EU konnten Untersuchungen keine unmittelbare Gesundheits- oder Umweltgefährdung durch MTBE nachweisen, ein Verbot wurde nicht erwogen.[82]
Dimethylether
Das leicht zu verflüssigende Gas Dimethylether (DME) kann durch katalytische Dehydrierung von Methanol in Gegenwart von Silica-Alumina-Katalysatoren hergestellt werden. DME wird von einigen Unternehmen als vielversprechender Kraftstoff in Dieselmotoren[83] und Gasturbinen[84] gesehen. Die Cetanzahl von DME liegt bei 55 und damit über der von herkömmlichem Diesel.[83][85] Die Verbrennung ist relativ sauber und führt nur zu geringen Emissionen von Partikeln, Stickoxiden und Kohlenmonoxid.[86] Im Zuge des europäischen BioDME-Projekts wird untersucht, ob auf Basis von Lignocellulose produziertes DME im großtechnischen Maßstab produziert werden kann.[87]
Sonstige Anwendungen
Methanol findet weitere Anwendung in vielen Bereichen. So findet es als Lösungs- und Frostschutzmittel Einsatz. In Wärmerohren im mittleren Temperaturbereich bis 500 K dient Methanol als Übertrager-Fluid. Ebenso findet es Anwendung bei der Sensorreinigung von digitalen Spiegelreflexkameras, da es keine Schlieren hinterlässt und rückstandslos verdunstet. Mono- und perdeuteriertes Methanol werden als Lösungsmittel in der Kernspinresonanzspektroskopie verwendet. In Kläranlagen wird Methanol zur Unterstützung der Denitrifikation, der Umwandlung von Nitrat in gasförmigen Stickstoff, zum Abwasser gegeben. Die bakteriellen Stoffwechselvorgänge benötigen Methanol als zusätzlichen Energielieferanten. In der Abfallaufbereitung wird Methanol zum solvolytischen Recycling von Polyethylenterephthalat genutzt. Dabei werden Ethylenglycol und Dimethylterephthalat zurückgewonnen. Methanol wird zur Abscheidung von Polystyrol und Chloroprenkautschuk aus Polymermischungen, etwa zur Verkapselung anderer Polymere wie zum Beispiel Butadien-Kautschuk, verwendet.[88]
Die Verwendung von Methanol zum Transport von Kohle in Methanol-Kohle-Slurrys wurde intensiv untersucht.[89] Die Kohle-Methanol-Slurry kann bei diesem Verfahren direkt verbrannt werden oder das Methanol kann destillativ abgetrennt werden und über Pipelines wieder an den Förderort der Kohle zurückgepumpt werden. Methanol wird in der Chemischen und Ölindustrie als Extraktionsmittel eingesetzt, etwa zur Trennung von aromatischen und paraffinischen Kohlenwasserstoffen.[90]
Biologische Bedeutung
Methanol als Substrat im anaeroben Stoffwechsel
Methanol wird nicht nur zum Zwecke des Energiegewinns zu Kohlenstoffdioxid abgebaut, sondern kann auch als Kohlenstoffquelle für den Aufbau von Zellbausteinen dienen. Dies ist insbesondere der Fall für anaerobe Methanotrophe, die C1-Verbindungen assimilieren. In der Regel wird Methanol zunächst zu Formaldehyd oxidiert und kann entweder im so genannten Wood-Ljungdahl-Weg, dem Serinweg oder im Ribulosemonophosphatweg zu Kohlenhydraten aufgebaut werden.
Methanol als Zwischenprodukt des aeroben Methanabbaus
Methanol wird als Zwischenprodukt des Stoffwechsels methanotropher Bakterien aus der Oxidation von Methan gebildet. Methylotrophe Bakterien (Methylophilaceae) und Hefen, beispielsweise Backhefe, oxidieren auch andere C1-Verbindungen wie Methanol und Formaldehyd zur Energiegewinnung. Der Abbau findet in aeroben Umgebungen in der Nähe von Methanvorkommen statt.
Der aerobe biologische Abbau des Methans erfolgt über die Stufen Methanol, Formaldehyd, Formiat zu Kohlendioxid (CO2).[91]
Für die Gesamtreaktion gilt:
Die Oxidation von Methan zu Methanol wird durch das Enzym Methan-Monooxygenase unter Verbrauch von Sauerstoff und Nicotinamidadenindinukleotid (NAD(P)H) katalysiert. Die weitere Oxidation des entstehenden Methanols zu Formaldehyd erfolgt je nach Spezies in unterschiedlicher Weise.[92] Gram-negative Bakterien oxidieren Methanol über eine lösliche Methanol-Dehydrogenase im periplasmatischen Raum mit Pyrrolochinolinchinon (PQQ) als Coenzym. Gram-positive, methanotrophe Bakterien wie Bacilli und Aktinomyzeten verwenden eine cytosolische NAD(P)H-abhängige Dehydrogenase. Dagegen oxidieren Hefen Methanol in den Peroxisomen, was durch eine FAD-abhängige Alkoholoxidase katalysiert wird. Dabei werden die Elektronen auf Sauerstoff übertragen, so dass daraus Wasserstoffperoxid entsteht.
Für die Oxidation von Formaldehyd sind verschiedene Stoffwechselwege bekannt. Formaldehyd ist sehr reaktiv und wird zum Beispiel als Addukt an Tetrahydrofolsäure beziehungsweise Tetrahydromethanopterin, alternativ an Glutathion, gebunden.[93]
Einzellerproteine
Verfahren zur Herstellung von Einzellerproteinen (single cell proteins) auf Basis von Methanol wurden eingehend untersucht. Dabei werden zum Beispiel Bakterien des Typs Methylophilus methylotropha in Airlift-Reaktoren fermentiert, wobei als Stickstoffquelle Ammoniak genutzt wird. Dabei werden proteinreiche Produkte erhalten, deren Aminosäurekomposition der von Fischmehl ähnlich ist. Die Nutzung von Einzellerproteinen auf der Basis von Methanol für Futterzwecke ist toxikologisch und ernährungsphysiologisch unbedenklich. Die Eiweiße können nach entsprechender Aufarbeitung als Lebensmittel dienen. Ein Verfahren der ICI wurde bereits großtechnisch realisiert, die Produkte konnten aber gegenüber preiswerten Soja- und Fischmehlprodukten nicht vermarktet werden.[94] Der Vorteil der Verwendung von Methanol gegenüber anderen Kohlenstoffquellen ist neben der Mischbarkeit mit Wasser der geringere Sauerstoffbedarf sowie die geringere Wärmeentwicklung bei der Fermentierung.
Deuteriertes Methanol
Es gibt drei verschiedene deuterierte Varianten von Methanol:
- Methanol-d1, auch MeOD, bei dem nur das Wasserstoffatom der Hydroxygruppe gegen Deuterium ausgetauscht wurde[95]
- Methanol-d3, bei dem die Wasserstoffatome der Methylgruppe ersetzt wurden[96]
- Methanol-d4, bei dem alle Wasserstoffatome ausgetauscht sind[97]
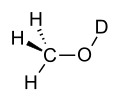 Struktur von monodeuteriertem Methanol (Methanol-d1, MeOD)
Struktur von monodeuteriertem Methanol (Methanol-d1, MeOD)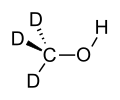 Struktur von trideuteriertem Methanol (Methanol-d3)
Struktur von trideuteriertem Methanol (Methanol-d3)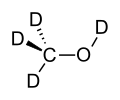 Struktur von perdeuteriertem Methanol (Methanol-d4)
Struktur von perdeuteriertem Methanol (Methanol-d4)
Methanol-d4 (Perdeuteromethanol) findet in der Kernresonanzspektroskopie (NMR) als Lösungsmittel Verwendung.
Toxikologie
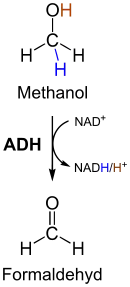
Methanol wird leicht durch Inhalation, Verschlucken oder Hautkontakt aufgenommen.[98] Durch Körperflüssigkeit wird es schnell im Körper verteilt. Kleine Mengen werden unverändert über Lunge und Nieren ausgeschieden.
Metabolismus und Giftwirkung entsprechen den bei Ethylenglycol festgestellten. Unverstoffwechseltes Methanol ist nur von geringer Giftigkeit (Toxizität). Giftig sind seine Abbauprodukte (Metaboliten), so der durch ADH (Alkoholdehydrogenase) gebildete Formaldehyd (vgl. Abbildung rechts) und die daraus entstehende Ameisensäure. Insbesondere Letztere führt nach einer häufig ohne Symptome verlaufenden Latenzzeit von 6 bis 30 Stunden zur Ausbildung einer metabolischen Azidose. Ameisensäure wird vom menschlichen Stoffwechsel nur sehr langsam abgebaut und sammelt sich so während des vergleichsweise zügigen Abbaus des Methanols im Körper an. Die Giftigkeit des Formaldehyds ist bei der Methanolvergiftung umstritten. Es wird durch die katalytische Einwirkung des Enzyms Aldehyddehydrogenase sehr schnell weiter zur Ameisensäure abgebaut, so dass es zu keiner Anreicherung von Formaldehyd im Körper kommt.[99] Dosen ab 0,1 g Methanol pro kg Körpergewicht sind gefährlich, über 1 g pro kg Körpergewicht lebensbedrohlich.[100] Die niedrigste für den Menschen tödliche Dosis ([[LDLo]]) bei Verschlucken beträgt 143 mg/kg Körpergewicht[101].
Die Vergiftungssymptome einer Methanolintoxikation verlaufen in drei Phasen. Direkt nach Aufnahme von Methanol zeigt sich wie beim Ethanol ein narkotisches Stadium, die berauschende Wirkung ist jedoch geringer als bei Ethanol. Nach der Latenzphase treten Kopfschmerzen, Schwächegefühl, Übelkeit, Erbrechen, Schwindel und eine beschleunigte Atmung auf in Zusammenhang mit der sich ausbildenden metabolischen Azidose. Charakteristisch für die dritte Phase, die Azidose, ist die Schädigung von Nerven, insbesondere des Sehnervs (Nervus opticus). Sehstörungen, die wieder zurückgehen können, entstehen zunächst durch Ödeme an der Netzhaut. Die Degeneration des Sehnervs – in diesem Fall eine toxischen Optikusneuropathie – führt anschließend zur Erblindung.[102] Dieser Schaden ist irreversibel. Der Tod kann als Folge einer Atemlähmung eintreten.
Zur Behandlung von Methanolvergiftungen wird der Abbau des Methanols im menschlichen Körper unterbunden, sodass die toxischen Folgeprodukte nicht entstehen. Dazu können etwa 0,7 g Ethanol (vulgo: Alkohol) pro kg Körpergewicht verabreicht werden, die den Methanolabbau kompetitiv hemmen, da das Enzym eine höhere Affinität zu Ethanol besitzt und diesen somit bevorzugt abbaut (Substratspezifität). Für eine effektive Therapie muss abhängig vom Grad der Vergiftung und der körperlichen Verfassung des Vergifteten ein Blut-Ethanolspiegel von 0,5 bis 1 ‰ über Tage aufrechterhalten werden. Wirksamer ist die Einnahme des ADH-Inhibitors 4-Methylpyrazol (Fomepizol), der den Methanolabbau ebenfalls kompetitiv hemmt. Gleichzeitig kann der Abbau der Ameisensäure im Körper durch die Gabe von Folsäure gefördert werden. Mit Natriumhydrogencarbonat kann der Übersäuerung des Körpers (Azidose) entgegengetreten werden. Bei schweren Vergiftungen oder bei besonderen Krankheiten wie Leberzirrhose oder ähnlichen wird gegebenenfalls eine Hämodialyse notwendig. Die Behandlung muss fortgesetzt werden, bis der Methanolgehalt im Blut unter einen bestimmten Grenzwert abgesunken ist.[103]
Durch die Verordnung Nr. 110/2008 des Europäischen Parlaments und des Rates ist der Methanolgehalt der verschiedenen Alkoholika in der Europäischen Union begrenzt. So gilt bei einem Obsttresterbrand ein Methanolgehalt von 15 g·l−1 (auf reinen Ethanolgehalt berechnet) als Obergrenze.[104]
In seltenen Fällen können Alkoholika durch unsachgemäßes Maischen, Gären und Destillieren oder Ausfrieren erhöhte Mengen an Methanol enthalten. Enthält die Maische Trester (Schalen, Kerne, Stängel), entsteht mehr Methanol. Da Methanol niedriger siedet als Äthanol, tritt es beim Destillieren zuerst auf und ist folglich im ersten Destillat (Vorlauf) angereichert.[105] Die meisten bekannten Fälle von Methanolvergiftung, etwa während der Prohibition[106] oder dem Methanolwein-Skandal 1986,[107] sind jedoch auf den Genuss von Trinkalkohol, der bewusst oder unbewusst mit Methanol vermischt wurde, zurückzuführen.
Methanol wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Methanol waren die Besorgnisse bezüglich Verbraucherverwendung, Umweltexposition, Exposition von Arbeitnehmern und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen. Die Neubewertung fand ab 2012 statt und wurde von Polen durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[108][109]
Nachweis

Methanol hat einen alkoholartigen Geruch. Wird Methanol mit Borax vermischt und angezündet, verbrennt der dabei entstehende Borsäuretrimethylester mit intensiv grüner Flamme. Diese Reaktion funktioniert mit ähnlichem Ergebnis, jedoch weniger intensiver Grünfärbung auch mit Ethanol unter einem Zusatz von konzentrierter Schwefelsäure. Deswegen können Ethanol und Methanol mit dieser sogenannten Boraxprobe unterschieden werden.[110]
Methanol wird häufig mit gaschromatografischen Methoden, etwa durch Flammenionisationsdetektion, oder mit gekoppelter Massenspektrometrie nachgewiesen. Je nach Ursprung der Probe wird diese mit verschiedenen Methoden entweder vorher aufkonzentriert oder extrahiert. Zum Nachweis von Methanol in der Luft wird diese zunächst über Silicagel oder Aktivkohle geleitet, um das Methanol zu adsorbieren und zu konzentrieren. Durch anschließende thermische Desorption wird das Methanol wieder freigesetzt. Bei flüssigen Proben, etwa zum Nachweis in Kraftstoff, wird die Probe vorher zum Beispiel mit Ethylenglycol extrahiert und anschließend gaschromatografisch untersucht. Bei festen Proben ist die Extraktion mit Wasser möglich.[111]
Produktionsanlagen können mittels Infrarotspektroskopie direkt während des Herstellungsvorgangs überwacht werden. Eine weitere Methode ist die Oxidation von Methanol mit starken Oxidationsmitteln, etwa Kaliumpermanganat, zu Formaldehyd, das mit den herkömmlichen Methoden nachgewiesen werden kann.[112]
Siehe auch
Literatur
- Holger Menrad, Alex König: Alkoholkraftstoffe. Springer, Wien/New York 1982, ISBN 3-211-81696-8.
- Der Bundesminister für Forschung und Technologie (Hrsg.): Entwicklungslinien in Kraftfahrzeugtechnik und Straßenverkehr. Forschungsbilanzen 1977 bis 1985, TÜV Rheinland, Köln.
- F. Asinger: Methanol, Chemie- und Energierohstoff. Akademie-Verlag, Berlin 1987, ISBN 3-05-500341-1.
- G. A. Olah, A. Goeppert, G. K. Surya Prakash: Beyond oil and gas: the methanol economy. Verlag Wiley-VCH (eingeschränkte Vorschau in der Google-Buchsuche).
- Bernd Höhlein: Neue Energieträger für den Verkehr: Methanol und Alkoholgemische. Verlag Forschungszentrum Jülich, 1991, ISBN 3-89336-068-9.
- VDI-Buch: Energiehandbuch: Gewinnung, Wandlung und Nutzung von Energie. Springer Verlag, 2002, ISBN 3-540-41259-X.
- Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry: Important Raw Materials and Intermediates. Wiley-VCH Verlag, 2003, ISBN 3-527-30578-5, S. 30 ff.
- Martin Bertau, Heribert Offermanns, Ludolf Plass, Friedrich Schmidt, Hans-Jürgen Wernicke: Methanol: The Basic Chemical and Energy Feedstock of the Future: Asinger’s Vision Today. Verlag Springer, 2014, ISBN 978-3-642-39708-0.
- Karl-Heinz Hochhaus: Alternative Kraftstoffe in der Seeschifffahrt. In: Schiffs-Ingenieur Journal. Nr. 2/2017.
Weblinks
- Oktanzahlsteigernde Wirkung von Methanol in Benzin (Quelle Menrad, motorlexikon.de)
- Methanol Institut, Arlington (englisch).
- Eintrag zu Methanol. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD.
Einzelnachweise
- Eintrag zu METHYL ALCOHOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Methanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Autorengemeinschaft: Organikum. 19. Auflage. Johann Ambrosius Barth, Leipzig · Berlin · Heidelberg 1993, ISBN 3-335-00343-8, S. 459.
- Eintrag zu Methanol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Juni 2014.
- Hans Lohninger: Anorganische Chemie: Dipolmomente (Tabelle), anorganik.chemie.vias.org, abgerufen am 9. März 2021.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-326.
- Eintrag zu Methanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 67-56-1 bzw. Methanol), abgerufen am 13. September 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press/Taylor and Francis, Boca Raton, FL, Thermochemistry, Electrochemistry, and Solution Chemistry, S. 5-26.
- Methanol auf der Seite der Gelsenchem abgerufen am 28. Februar 2020.
- Power to Methanol – als Langzeitspeicher unverzichtbar für den Klimaschutz – Solarenergie-Förderverein Deutschland (SFV) – Sonnenenergie, Photovoltaik, Solarthermie, Windenergie, Geothermie, Wasserkraft, Biomasse-Reststoffe und Stromspeicher für die Energiewende. Abgerufen am 8. September 2019.
- A. Gossauer: Struktur und Reaktivitat der Biomolekule. Verlag Wiley-VCH, S. 176 (eingeschränkte Vorschau in der Google-Buchsuche).
- G. A. Olah, A. Goeppert, G. K. Surya Prakash: Beyond oil and gas: the methanol economy. Verlag Wiley-VCH, 2009, ISBN 978-3-527-32422-4.
- S. Lee: Methanol synthesis technology. CRC Press, 1990, ISBN 0-8493-4610-X.
- J. R. Couper, O. T. Beasley, W. R. Penney: The chemical process industries infrastructure: function and economics. Verlag Marcel Dekker, 2000, ISBN 0-8247-0435-5.
- Über BASF. Geschichte 1902–1924. (Nicht mehr online verfügbar.) BASF, archiviert vom Original am 20. Juli 2012; abgerufen am 6. September 2018.
- B. Höhlein, Th. Grube, P. Biedermann, H. Bielawa, G. Erdmann, L. Schlecht, G. Isenberg, R. Edinger: Methanol als Energieträger (Memento vom 13. August 2016 im Internet Archive) (PDF-Datei; 5,5 MB). In: Schriften des Forschungszentrums Jülich. Reihe Energietechnik. Band 28, ISBN 3-89336-338-6.
- T. Holst, A. Arneth, S. Hayward, A. Ekberg, M. Mastepanov, M. Jackowicz-Korczynski, T. Friborg, P. M. Crill, K. Bäckstrand: BVOC ecosystem flux measurements at a high latitude wetland site in Atmos. In: Chem. Phys. 10, 2010, S. 1617–1634.
- D. J. Jacob, B. D. Field, Q. Li, D. R. Blake, J. de Gouw, Carsten Warneke, A. Hansel, A. Wisthaler, H. B. Singh, A. Guenther: Global budget of methanol: Constraints from atmospheric observations. In: Journal of Geophysical Research. Vol. 110, 2005; doi:10.1029/2004JD005172.
- C. C. von Dahl, M. Hävecker, R. Schlögl, I. T. Baldwin: Caterpillar-elicited methanol emission: a new signal in plant–herbivore interactions? In: The Plant Journal. Band 46, 2006, S. 948–960; doi:10.1111/j.1365-313X.2006.02760.x.
- E. Kolb: Spirituosen-Technologie. Behr’s Verlag, 2002, ISBN 3-86022-997-4.
- Methanol: Wie sicher sind … (PDF) Untersuchungsämter für Lebensmittelüberwachung und Tiergesundheit Baden-Württemberg, abgerufen am 6. September 2018.
- H. G. Classen, P. S. Elias, M. Winter: Toxikologisch-hygienische Beurteilung von Lebensmittelinhaltsstoffen und Zusatzstoffen. Behr’s Verlag, 2001, ISBN 3-86022-806-4.
- W. Helferich, C. K. Winter: Food Toxikology. CRC Press, 2000, ISBN 0-8493-2760-1.
- L. Harvey-Smith, R. J. Cohen: Discovery of large-scale masers in W3(OH). In: Triggered Star Formation in a Turbulent ISM. (= Proceedings IAU Symposium. No. 237). 2006, doi:10.1017/S1743921307002104.
- E. S. Wirström1, C. M. Persson1, A. Hjalmarson1, J. H. Black, P. Bergman1, W. D. Geppert, M. Hamberg, E. Vigren: Observational constraints on the formation of interstellar methanol. In: Organic Matter in Space. (= Proceedings IAU Symposium. No. 251). 2008, doi:10.1017/S1743921308021406.
- Spitzer Spectra of Protoplanetary Disks bei caltech.edu
- Excerpt from the Methanol & Derivatives Global Outlook 2000–2012. (Memento vom 24. Juli 2012 im Webarchiv archive.today)
- Chinas Petrochemie boomt. (PDF; 99 kB) Dechema e.V., Februar 2007, abgerufen am 6. September 2018.
- F. Asinger: Methanol, Chemie- und Energierohstoff. Akademie-Verlag, Berlin 1987, ISBN 3-05-500341-1.
- The 5 % solution (Memento vom 29. November 2014 im Internet Archive), bei methanol.org, August 2009.
- M. Hennecke: Das Ingenieurwissen. Verlag Springer, Berlin 2007, ISBN 978-3-540-71851-2.
- H. Daniel: Physik: Mechanik, Wellen, Wärme. Verlag de Gruyter, 1997, ISBN 3-11-015602-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- Technische Informationen und Sicherheitsmerkblatt für den Umgang mit Methanol (Memento vom 26. August 2011 im Internet Archive) (PDF-Datei; 578 kB)
- A. Töpel: Chemie und Physik der Milch: Naturstoff – Rohstoff – Lebensmittel. Behr’s Verlag, 2004, ISBN 3-89947-131-8, S. 65 (eingeschränkte Vorschau in der Google-Buchsuche).
- L. Bergmann, T. Dorfmüller, C. Schaefer: Lehrbuch der Experimentalphysik: Mechanik, Relativität, Wärme. Verlag de Gruyter, 1998, ISBN 3-11-012870-5 (eingeschränkte Vorschau in der Google-Buchsuche).
- S. Lee, J. G. Speight, S. K. Loyalka: Handbook of alternative fuel technologies. CRC Press, 2007, ISBN 978-0-8247-4069-6 (eingeschränkte Vorschau in der Google-Buchsuche).
- NMR-002: Sample Devices and Magnetic Susceptibility
- Lange’s Handbook of Chemistry. 10. Auflage. 1967, S. 1669–1674.
- Eintrag zu Methyl alcohol (Condensed phase thermochemistry data). In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 17. November 2019.
- Lange’s Handbook of Chemistry. 10. Auflage. 1967, S. 1522–1524.
- Competition Science Vision, Jg. 3, Nr. 25, März 2000 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. Ambrose, C. H. S. Sprake: Thermodynamic Properties of Organic Oxygen Compounds. XXV. Vapor Pressures and Normal Boiling Temperatures of Aliphatic Alcohols. In: J. Chem. Thermodyn. 2, 1970, S. 631–645.
- L. Pauling: Die Natur der chemischen Bindung. 3. Auflage. Verlag Chemie, Weinheim 1973, S. 443.
- Technical Information & Safe Handling Guide for Methanol (Memento vom 16. September 2012 im Internet Archive) (PDF-Datei; 1,6 MB)
- K. J. Tauer, W. N. Lipscomb: On the crystal structures, residual entropy and dielectric anomaly of methanol. In: Acta Crystallographica. 5, 1952, S. 606–612, doi:10.1107/S0365110X52001696.
- Alkohole. (PDF; 303 kB) (Nicht mehr online verfügbar.) www.uni-tuebingen.de, archiviert vom Original am 26. Juni 2013; abgerufen am 10. Januar 2010.
- E. V. Ivash, D. M. Dennison: Journal of Chemical Physics 21, 1953, S. 1804.
- S. Hauptmann: Reaktion und Mechanismus in der Organischen Chemie. Verlag Teubner, S. 61 (eingeschränkte Vorschau in der Google-Buchsuche).
- Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry: Important Raw Materials and Intermediates. Wiley-VCH Verlag, 2003, ISBN 3-527-30578-5.
- G. W. Becker, D. Braun, L. Bottenbruch: Kunststoffhandbuch. 11 Bände in 17 Tl.-Bdn., Bd. 3/1, Technische Thermoplaste. BD 3 / Teil 1, Verlag Hanser Fachbuch, 1992, ISBN 3-446-16368-9.
- J. Buddrus: Grundlagen der Organischen Chemie. Verlag Gruyter, 2011, ISBN 978-3-11-024894-4.
- http://www.methanol.org/Methanol-Basics/Resources/MMSA-Global-Methanol-Supply-and-Demand.aspx (Link nicht abrufbar)
- Rectisol Process (Memento vom 16. Juni 2012 im Internet Archive)
- ICIS: Formaldehyde Uses and Market Data
- Formaldehyde (Memento vom 27. August 2013 im Internet Archive), von MMSA.
- Formaldehyde Uses and Market Data. ICIS, abgerufen am 9. Januar 2010 (englisch).
- A. Behr: Aliphatische Zwischenprodukte. In: Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Alfred Oberholz (Hrsg.): Winnacker, Küchler. Chemische Technik: Prozesse und Produkte.Band 5: Organische Zwischenverbindungen, Polymere. WILEY-VCH Verlag, Weinheim, ISBN 3-527-30770-2.
- W.Keim, A. Behr, G. Schmitt: Grundlagen der Industriellen Chemie: techn. Produkte u. Prozesse. 1. Auflage. Salle, Frankfurt/ Berlin/ München 1986, ISBN 3-7935-5490-2 (Sauerländer, ISBN 3-7941-2553-3).
- An Investigation Of The Feasibility Of Coal-Based Methanol For Application In Transportation Fuel Cell Systems (Memento vom 3. Februar 2013 im Internet Archive) (PDF-Datei; 766 kB)
- Power to Methanol – als Langzeitspeicher unverzichtbar für den Klimaschutz – Solarenergie-Förderverein Deutschland (SFV) – Sonnenenergie, Photovoltaik, Solarthermie, Windenergie, Geothermie, Wasserkraft, Biomasse-Reststoffe und Stromspeicher für die Energiewende. Abgerufen am 8. September 2019.
- Athanasios A. Tountas, Xinyue Peng, Alexandra V. Tavasoli, Paul N. Duchesne, Thomas L. Dingle: Towards Solar Methanol: Past, Present, and Future. In: Advanced Science. Band 6, Nr. 8, 2019, ISSN 2198-3844, S. 1801903, doi:10.1002/advs.201801903, PMID 31016111, PMC 6468977 (freier Volltext).
- Übersicht über die Verwendung von Methanol in Raketen- und Flugzeugtreibstoffen
- Tom B. Reed, R. M. Lerner: Methanol: A Versatile Fuel for Immediate Use. In: Science. 182.4119, 1973, S. 1299–1304; doi:10.1126/science.182.4119.1299.
- Alkoholkraftstoff, umweltlexikon-online.de
- POWERED BY METHANOL
- H. Heitland: Alternativen im Verkehr: Abschätzung ihrer Chancen und Risiken durch PC-Simulationsmodelle. Verlag Frank Timme, S. 65 (eingeschränkte Vorschau in der Google-Buchsuche).
- Inst. Francais Du Petrole (Hrsg.): VII. International Symposium on Alcohol Fuels. Editions Technip, ISBN 2-7108-0517-0, S. 277 (eingeschränkte Vorschau in der Google-Buchsuche).
- S. Geitmann: Erneuerbare Energien und Alternative Kraftstoffe. Mit neuer Energie in die Zukunft. Verlag Hydrogeit, 2005, ISBN 3-937863-05-2.
- J. J. Romm: Der Wasserstoff-Boom: Wunsch und Wirklichkeit beim Wettlauf um den Klimaschutz. Wiley-VCH Verlag, 2006, ISBN 3-527-31570-5.
- B. Aldrich: ABC’s of Afv’s: A Guide to Alternative Fuel Vehicles. Verlag Diane Pub, 1995, ISBN 0-7881-4593-2 (eingeschränkte Vorschau in der Google-Buchsuche).
- M. Trzesniowski: Rennwagentechnik: Grundlagen, Konstruktion, Komponenten, Systeme. Verlag Vieweg+Teubner, 2008, ISBN 978-3-8348-0484-6.
- Ulrike Schramm: SFC Energy und Beijing Green Century Technologies unterzeichnen Partnerschaftsvereinbarung für EFOY Pro Brennstoffzellen in China. In: Investoren, Pressemitteilung. SFC Energy AG, 24. April 2018, abgerufen am 18. Mai 2018.
- MTBE Fact Sheet #3 Use And Distribution Of MTBE And Ethanol (PDF-Datei; 20 kB)
- Biodieselproduktionskapazitäten in Deutschland
- K. Liu, C. Song, V. Subramani: Hydrogen and Syngas Production and Purification Technologies: Hydrocarbon Processing for H2 Production. Verlag John Wiley & Sons, 2010, ISBN 978-0-471-71975-5, S. 510 ff.
- Solange R. Blaszkowski, Rutger A. van Santen: Theoretical Study of C-C Bond Formation in the Methanol-to-Gasoline Process. (PDF-Datei; 222 kB). In: J. Am. Chem. Soc. 119, 1997, S. 5020–5027; doi:10.1021/ja963530x.
- Michael Seiler, Udo Schenk, Michael Hunger: Conversion of methanol to hydrocarbons on zeolite HZSM-5 investigated by in situ MAS NMR spectroscopy under flow conditions and on-line gas chromatography. In: Catalysis Letters. 62, 1999, S. 139–145; doi:10.1023/A:1019086603511.
- ThyssenKrupp Base: Methanol (Memento vom 8. Juli 2012 im Webarchiv archive.today)
- MTBE in Fuels, von EPA.gov.
- MTBE Ban in California (PDF-Datei; 674 kB), von GAO.gov.
- Umweltrelevanz des Stoffes Methyltertiärbutylether (MTBE) unter besonderer Berücksichtigung des Gewässerschutzes, von Umweltbundesamt.de.
- Annual Technical Progress Report for Project Entitled “Impact of DME-Diesel Fuel Blend Properties on Diesel Fuel Injection Systems” 16. Mai 2003.
- Patent US4341069: Method for generating power upon demand.
- Umwelt, Energie und Verkehr (PDF-Datei; 1,1 MB) EU-Forschungsergebnisse im Bereich Stadt- und Regionalverkehr.
- DME, Clean Fuel for Transportation, bei International DME Association.
- BioDME. BioDME, abgerufen am 6. September 2018.
- Patent US5264553: Method of forming uniform polymer spheres, composite particles and polymer encapsulated particles.
- B. E. A. Jacobs: Design of slurry transport systems. Verlag Elsevier, S. 254 (eingeschränkte Vorschau in der Google-Buchsuche).
- Verfahren zur Abtrennung aromatischer Kohlenwasserstoffe aus Gemischen (Memento vom 28. Januar 2012 im Internet Archive) (PDF-Datei; 424 kB).
- http://www.eawag.ch/about/personen/homepages/buergmhe/Stoffwechsel08/Stoffwechsel_Termin_6-2009.pdf (Link nicht abrufbar).
- H. Kloosterman, J. W. Vrijbloed, L. Dijkhuizen (2002): Molecular, biochemical, and functional characterization of a Nudix hydrolase protein that stimulates the activity of a nicotinoprotein alcohol dehydrogenase. In: J Biol Chem. 277 (38), S. 34785–34792. PMID 12089158; PDF (freier Volltextzugriff, engl.).
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 978-3-13-444608-1, S. 311.
- Cleanthis J. Israelidis: Nutrition – Single Cell Protein, Twenty Years Later. (Nicht mehr online verfügbar.) www.biopolitics.gr, archiviert vom Original am 7. Oktober 2011; abgerufen am 6. September 2018 (englisch).
- Externe Identifikatoren von bzw. Datenbank-Links zu Methanol-d1: CAS-Nummer: 1455-13-6, EG-Nummer: 215-933-0, ECHA-InfoCard: 100.014.485, PubChem: 123113, ChemSpider: 109729, Wikidata: Q82908334.
- Externe Identifikatoren von bzw. Datenbank-Links zu Methanol-d3: CAS-Nummer: 1849-29-2, EG-Nummer: 217-435-9, ECHA-InfoCard: 100.015.851, PubChem: 123132, ChemSpider: 109747, Wikidata: Q83041789.
- Externe Identifikatoren von bzw. Datenbank-Links zu Methanol-d4: CAS-Nummer: 811-98-3, EG-Nummer: 212-378-6, ECHA-InfoCard: 100.011.253, PubChem: 71568, ChemSpider: 64640, Wikidata: Q1100804.
- R. Kavet, K. M. Nauss: The Toxicity of Inhaled Methanol Vapors. (PDF-Datei; 2,2 MB). In: Critical Reviews in Toxicology. 1990.
- G. F. Fuhrmann: Toxikologie für Naturwissenschaftler. Vieweg+Teubner Verlag, 2006, ISBN 3-8351-0024-6, S. 269.
- B. Madea, B. Brinkmann: Handbuch gerichtliche Medizin, Band 2. Verlag Springer, ISBN 3-540-66447-5, S. 523 (eingeschränkte Vorschau in der Google-Buchsuche).
- Sicherheitsdatenblatt Methanol 99 % bei Carl Roth GmbH & Co. KG, abgerufen am 1. März 2022
- P. U. Fechner, K. D. Teichmann: Medikamentöse Augentherapie: Grundlagen und Praxis. Georg Thieme Verlag, 2000, ISBN 3-13-117924-4, S. 516–517.
- Methanol-Vergiftung – Effektive Therapie mit Formepizol – GFI
- Verordnung (EG) Nr. 110/2008 des Europäischen Parlaments und des Rates vom 15. Januar 2008 zur Begriffsbestimmung, Bezeichnung, Aufmachung und Etikettierung von Spirituosen sowie zum Schutz geografischer Angaben für Spirituosen und zur Aufhebung der Verordnung (EWG) Nr. 1576/89
- Max Roßmann: Woher kommt das Methanol und wie kann man sich schützen?.Mitteilung der Brennerei Rossmann, abgerufen am 1. März 2022
- Stuart A. Schneck: Methyl, alcohol. (PDF-Datei; 763 kB). In: Handbook of Clinical Neurophysiology. Vol. 36, 1979, S. 351–360.
- Wein: Umwerfende Idee. In: Der Spiegel. Nr. 16, 1986, S. 130–132 (online – 14. April 1986).
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Methanol, abgerufen am 26. März 2019.
- G. Blumenthal, D. Linke, S. Vieth: Chemie: Grundwissen für Ingenieure. Verlag Vieweg+Teubner, 2006, ISBN 3-519-03551-0, S. 242.
- P. J. Baugh: Gaschromatographie: eine anwenderorientierte Darstellung. Verlag Vieweg (eingeschränkte Vorschau in der Google-Buchsuche).
- Chemical Properties of Methanol (Memento vom 10. März 2010 im Internet Archive)


