Calciumacetat
Calciumacetat (auch essigsaurer Kalk[6]) (E 263) ist eine chemische Verbindung mit der chemischen Formel Ca(CH3COO)2. Es ist ein Calcium-Salz der Essigsäure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
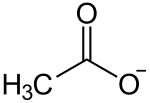 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Calciumacetat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H6CaO4 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit essigsäureartigem Geruch[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A12AA12 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 158,17 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
gut in Wasser (400 g·l−1 bei 0 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
Calciumacetat ist ein weißer Feststoff, mit leichtem Geruch nach Essigsäure und stark herbem Geschmack. In der Lieferform enthält Calciumacetat wechselnde Mengen Kristallwasser. Bei normalen Bedingungen (Raumtemperatur, 65 % Luftfeuchtigkeit) ist die Verbindung mit etwa 2 Mol Kristallwasser beständig. Bei 60 °C löst sich die Verbindung im eigenen Kristallwasser, was einem Schmelzen gleichkommt.
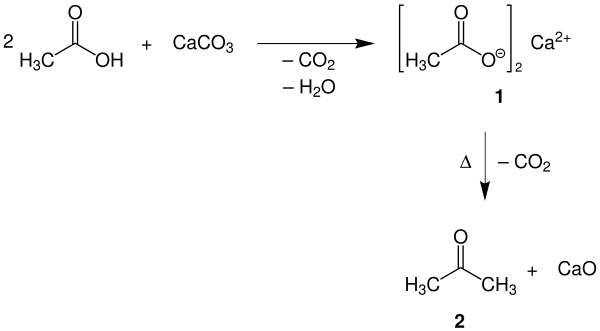
Calciumacetat ist ein Zwischenprodukt bei der Herstellung von Aceton (2) aus Calciumcarbonat (1) und Essigsäure mit der sogenannten "Kalksalzdestillation", da es beim Erhitzen u. a. in Aceton zerfällt:
Verwendung
Calciumacetat wird als säureregulierender, konservierender und festigender Lebensmittelzusatzstoff verwendet. Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 263 ohne eine Höchstmengenbeschränkung (quantum satis) für alle für Zusatzstoffe zugelassenen Lebensmittel zugelassen.
Calciumacetat wird oft als Extraktionsmittel für Bodenproben gebraucht. Zudem kann es in Kombination mit Brennspiritus als Brennpaste verwendet werden.
Darüber hinaus wird es als Medikament zur Behandlung erhöhter Phosphatspiegel bei chronischer Niereninsuffizienz in der Nephrologie eingesetzt.
Auch die vielerorts erhältlichen Wärmekissen enthalten eine Calcium- oder Natriumacetatlösung. Durch Verformung des Metallplättchens entsteht ein Kristallisationskeim. Nach wenigen Sekunden ist das gesamte Acetat kristallisiert, gibt aber über einen längeren Zeitraum die entstandene Kristallisationswärme ab. Die Dauer ist dabei vor allem von der Größe des Wärmekissens (Verhältnis von Volumen zu Oberfläche) und von der Umgebungstemperatur abhängig.
Einzelnachweise
- Eintrag zu E 263: Calcium acetate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu CALCIUM ACETATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Februar 2020.
- Eintrag zu Calciumacetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Mai 2017. (JavaScript erforderlich)
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 629.
- Datenblatt Calciumacetat (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- Essigsaurer Kalk. In: Meyers Großes Konversations-Lexikon. Band 6. Leipzig 1906, S. 122–123 (zeno.org).