Acetaldehyd
Acetaldehyd [aˈt͡seːt|aldehyːt], auch Ethanal genannt, ist ein Aldehyd und besitzt die Halbstrukturformel CH3-CHO.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
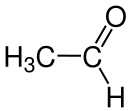 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Acetaldehyd | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H4O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit oder farbloses Gas mit stechendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 44,1 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig oder gasförmig[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
20 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
13,57 (25 °C)[4] | ||||||||||||||||||
| Löslichkeit |
mischbar mit Wasser[2] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,3316 (20 °C)[6] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Im menschlichen Körper entsteht Acetaldehyd als Zwischenprodukt beim Abbau von Ethanol durch die Alkoholdehydrogenase. Acetaldehyd ist neben anderen Stoffen für den „Kater“ am nächsten Morgen verantwortlich. Acetaldehyd wird im Regelfall schnell zu Acetat verstoffwechselt. Nach einer Einnahme von Disulfiram oder Coprin (Wirkstoff im Faltentintling) wird die Verstoffwechselung von Acetaldehyd gehemmt und es kommt zu einer Anreicherung im Körper, die mit (meist leichten) Vergiftungssymptomen einhergeht (Antabus- bzw. Coprinus-Syndrom). Bei der Verschwelung bzw. Verbrennung von Tabak entsteht es als Neben-/Pyrolyseprodukt[14] und gelangt so aus dem Tabakrauch über die Lungenbläschen ins Blut. Außerdem wurde Acetaldehyd in pflanzlichen Extrakten, ätherischen Ölen, geröstetem Kaffee und Mineralwasser (insbesondere bei in Plastik abgepackten Eigenmarken diverser Discounter) nachgewiesen.[14][15] Manche Laubbäume, wie z. B. Ahorn und Pappeln, geben Acetaldehyd beim Übergang von Licht zu Dunkelheit ab.[16]
Biochemisch gesehen ist Acetaldehyd ebenfalls ein häufiges Zwischenprodukt. So wandeln Hefezellen das in der Glykolyse entstandene Pyruvat in zwei Schritten zu Ethanol um, indem das Pyruvat zuerst mit Hilfe der Pyruvat-Decarboxylase, einem Enzym der Klasse der Lyasen, in Acetaldehyd umgewandelt und anschließend mit Hilfe der Alkoholdehydrogenase, einem Enzym der Klasse der Oxidoreduktasen, in Ethanol umgewandelt wird.
Nomenklatur
Der systematische IUPAC-Name Ethanal ist abgeleitet von Ethan durch Anhängen des Suffixes -al für Aldehyde. Die gemeinhin bevorzugte Bezeichnung Acetaldehyd geht auf „acetum“ zurück, das lateinische Wort für Essig, denn bei der Oxidation von Acetaldehyd („Essigsäurealdehyd“) entsteht Essigsäure.[17]
Geschichte
Acetaldehyd wurde wahrscheinlich erstmals im Jahre 1781 von Carl Wilhelm Scheele beim Versuch der Oxidation von Ethanol mit Braunstein in Gegenwart von Schwefelsäure synthetisiert.[14] Die Charakterisierung gelang jedoch erst Justus Liebig in Zusammenarbeit mit Johann Wolfgang Döbereiner im Jahre 1835. Er benannte die Verbindung Aldehyd (von lat. alcoholus dehydrogenatus).[18] Acetaldehyd kann somit als der historisch erste Vertreter der Stoffklasse der Aldehyde angesehen werden, während Formaldehyd (Methanal) der einfachste Vertreter der Klasse ist.
Gewinnung und Darstellung
Historisch wurde Acetaldehyd durch Oxidation von Ethanol mit einer Reihe von Oxidationsmitteln, beispielsweise Braunstein/Schwefelsäure (Scheele) oder Chromsäure (Liebig), nach folgender Gleichung erhalten:
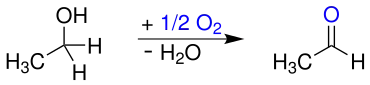
Zur großtechnischen Synthese wird im Rahmen des Wacker-Hoechst-Verfahrens Acetaldehyd durch katalytische Wasseraddition an Ethen bei gleichzeitiger Luftoxidation über Festbettkatalysatoren hergestellt.[14] Formal ergibt sich folgende Gleichung:
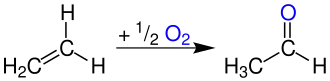
Eine Laborsynthese geht von Tetrahydrofuran als synthetisches Äquivalent aus. Dieses muss mit n-Butyllithium gespalten werden, wobei neben Ethen zunächst das Lithiumethenolat gebildet wird. Letzteres tautomerisiert durch Hydrolyse zum Acetaldehyd, welches somit bei Bedarf sogar in situ erzeugt werden kann. Der Mechanismus der Zersetzung des Tetrahydrofurans mit n-Butyllithium wurde 2002 ramanspektroskopisch und mittels Dichtefunktionaltheorie untersucht.[19] In den 1970er Jahren stieg die weltweite Produktionskapazität für Acetaldehyd auf über 2 Millionen Tonnen pro Jahr an. Auf Grund der Entwicklung neuer Synthesewege, welche nicht Acetaldehyd als Edukt benötigen, sinkt derzeit jedoch der Bedarf.[14]
Eigenschaften
Acetaldehyd ist eine farblose, sehr leicht flüchtige und leicht entzündliche Flüssigkeit, die mit Wasser in jedem Verhältnis mischbar ist; dabei bildet sich in einer Gleichgewichtsreaktion das Aldehydhydrat. Anders als bei Formaldehyd liegt das Gleichgewicht jedoch nur zu etwas über 50 % auf der Seite des Hydrats.
Acetaldehyd muss kühl gelagert werden, da es schon bei 20 °C siedet und explosive Dampf-Luft-Gemische bildet. Diese Dämpfe können sich aufgrund des extrem niedrigen Zündpunkts von 140 °C an heißen Heizflächen entzünden. Der Flammpunkt von Acetaldehyd liegt bei −39 °C und seine UN-Nummer ist 1089.
Acetaldehyd oligomerisiert leicht säurekatalysiert zu Aldoladditionsprodukten.
- Das „Dimer“ (CH3CHO)2 ist das sogenannte Aldol, welches unter Wasserabspaltung zum Crotonaldehyd weiterreagieren kann.
- Das Trimer (CH3CHO)3 hat eine cyclische Acetalstruktur (2,4,6-Trimethyl-1,3,5-trioxan). Es handelt sich um eine Flüssigkeit (Sdp. 124 °C) mit dem Trivialnamen Paraldehyd.
- Das Tetramer (CH3CHO)4 hat ebenfalls cyclische Acetalstruktur (2,4,6,8-Tetramethyl-1,3,5,7-tetroxocan). Es handelt sich um einen Feststoff (sublimiert bei 112 °C), auch Metaldehyd genannt. Es wird als Trockenbrennstoff und wegen seiner Giftigkeit auch als Schneckengift (Schneckenkorn) verwendet.[20]
- Zumeist enthält Trockenbrennstoff auch höhere Oligomere des Acetaldehyds, wie z. B. Pentamere (CH3CHO)5 und Hexamere (CH3CHO)6.
Die Oligomere mit Acetalstruktur können leicht wieder durch Säuren gespalten werden.
Tautomerie
Acetaldehyd besitzt ein instabiles Tautomer, den Vinylalkohol oder Ethenol. Dieses einfachste Enol isomerisiert in freiem Zustand unter Normalbedingungen sofort zu Acetaldehyd, sofern es nicht – etwa als Eisencarbonyl- oder Platin-Komplex Pt(acac)(η2-C2H3OH)Cl[21] – stabilisiert wird.

Wirkungen im menschlichen Körper
Acetaldehyd geht leicht Bindungen mit der menschlichen DNA ein und wirkt deshalb mutagen (erbgutschädigend) und ferner auch kanzerogen (krebserregend). Zunächst kann Acetaldehyd eine reversible Reaktion mit Nukleosiden der DNA eingehen. Die hierbei entstehenden instabilen Addukte können durch Reduktion mit Natriumborhydrid in stabile Addukte umgewandelt werden. Ein Guanosin-Acetaldehyd-Addukt wird nach einer solchen Reduktion in ein Produkt überführt, dem die Struktur von N2-Ethylguanosin zugeschrieben wird.
Acetaldehyd hat vielfältig schädliche Wirkungen auf Leber und Herz. Es bildet Proteinaddukte, die die sogenannten Kupffer-Zellen (Makrophagen der Leber) aktivieren. Diese sezernieren verstärkt Stoffe, die andere Zellen der Leber, die Itozellen, so verändern, dass diese daraufhin verstärkt Kollagen bilden. Das begünstigt die Ausbildung einer Leberzirrhose. Außerdem führt Acetaldehyd über die Aktivierung der NADPH-Oxidase (NOX2) zur vermehrten Bildung von Sauerstoffradikalen, welche die Membranen der Zellen schädigen, sodass diese zugrunde gehen. Davon betroffen sind auch die Mitochondrien der Kardiomyozyten, was zunächst die Fähigkeit der Herzmuskelzellen zur Kontraktion beeinträchtigt und diese im weiteren Verlauf zerstört, sodass es zu einer irreparablen Schädigung des Muskels und schließlich zur chronischen Herzinsuffizienz kommt.[22]
Verwendung
Acetaldehyd ist ein wichtiger Ausgangsstoff in der chemischen Industrie. Acetaldehyd dient beispielsweise zur Herstellung von Essigsäure, Essigsäureanhydrid, Butadien, Acrolein und Pentaerythrit.[23]
Weblinks
- www.wissenschaft.de: Was Kater und Krebs gemeinsam haben – Alkoholabbauprodukt Acetaldehyd verursacht einen schweren Kopf und erhöht das Krebsrisiko im Magen-Darm-Trakt
- Deutschlandfunk: Wandel in der Bewertung von Acetaldehyd
Einzelnachweise
- Eintrag zu ACETALDEHYDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Acetaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Stoffdaten Acetaldehyd bei Celanese Chemicals. Stand Dezember 1999.
- Eintrag zu Acetaldehyde in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-52.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-4.
- Eintrag zu Acetaldehyde im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. November 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 19. Juli 2019.
- Van M. Sim, M.D.; Richard E. Pattle, M.A.: Effect of possible smog irritants on human subjects, JAMA, Journal of the American Medical Association. 1957;165(15):1908-1913. doi:10.1001/jama.1957.02980330010003, PMID 13480837.
- National Technical Information Service. Vol. OTS0534485.
- Gigiena Truda i Professional'nye Zabolevaniya. Labor Hygiene and Occupational Diseases. Vol. 25(11), S. 57, 1981.
- Agents and Actions, A Swiss Journal of Pharmacology. Vol. 4, S. 125, 1974.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- Ullmann's Encyclopedia of Industrial Chemistry, 2007.
- test.de: Natürliche Mineralwässer: Schlechte Noten für Discounter, 24. Juli 2008.
- T. Karl, A.J. Curtis, T.N. Rosenstiel, R.K. Monson, R. Fall: Transient releases of acetaldehyde from tree leaves – products of a pyruvate overflow mechanism?. In: Plant Cell And Environment, Vol. 25, Issue 9, 2002, S. 1121–1131, doi:10.1046/j.1365-3040.2002.00889.x.
- Henri A Favre, Warren H Powell: Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Hrsg.: The Royal Society of Chemistry. Cambridge 2014, ISBN 978-0-85404-182-4, S. 908, doi:10.1039/9781849733069-FP001.
- Experimentelle Schulchemie der Sekundarstufe II, Aulis-Deubner Verlag GmbH & Co. KG, Bd. 1–12, Aldehyde, S. 91.
- Jacques Corset, Martine Castellà-Ventura, Françoise Froment, Tekla Strzalko, Lya Wartski: Formation mechanism of acetaldehyde lithium enolate by reaction of n-butyllithium with tetrahydrofuran: infrared and Raman spectroscopy and density functional theory calculations. In: Journal of Raman Spectroscopy. Band 33, Nr. 8, 2002, S. 652–668, doi:10.1002/jrs.896.
- Eintrag zu Metaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. Oktober 2014.
- F. A. Cotton, J. N. Francis, B. A. Frenz, M. Tsutsui: Structure of a dihapto(vinyl alcohol) complex of platinum(II), in: Journal of the American Chemical Society, 1973, 95, S. 2483–2486. doi:10.1021/ja00789a011.
- Moritz Brandt, Venkata Garlapati u. a.: NOX2 amplifies acetaldehyde-mediated cardiomyocyte mitochondrial dysfunction in alcoholic cardiomyopathy. In: Scientific Reports. 6, 2016, S. 32554, doi:10.1038/srep32554.
- Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.


