Homogene Katalyse
Von einer homogenen Katalyse wird gesprochen, wenn bei einer chemischen Reaktion der Katalysator und die Reaktante in derselben Phase vorliegen. Der Begriff findet in der technischen Chemie hauptsächlich seine Verwendung zur Unterscheidung von der heterogenen Katalyse.
Säure-/Basekatalysierte Reaktionen wie beispielsweise Veresterungen laufen homogenkatalytisch ab. Die Vorteile der homogenen Katalyse gegenüber der heterogenen Katalyse sind die milderen Reaktionsbedingungen wie niedriger Druck und moderate Temperaturen und die oft bessere Selektivität. Nachteilig ist jedoch die schwierige Abtrennung des Katalysators vom Reaktionsgemisch, da sich beide in der gleichen Phase befinden.
Geschichte der homogenen Katalyse

Als erste vom Menschen angewandte katalytische technischer Prozesse gelten die Alkoholvergärung aus Zucker, von den Sumerern in Mesopotamien bereits 6000 vor Christus angewendet, sowie die Essigsäureherstellung aus Alkohol mit Hilfe von katalytisch wirkenden Enzymen.
Nach diesen frühen Anfängen fand erst im 18. und frühen 19. Jahrhundert die Entdeckung einer ganzen Reihe von neuen katalytischen Reaktionen statt. So entdeckte Antoine-Augustin Parmentier 1781 die Stärkespaltung zu Zucker unter Säurekatalyse. Nur ein Jahr später entdeckte Carl Wilhelm Scheele 1782 die säurekatalysierte Veresterung von Alkoholen und Säure zu Estern und kurz darauf Joseph Priestley 1783 den Zerfall von Ethanol zu Ethylen und Wasser an Tonerde.
Als erstes Verfahren zur technischen Herstellung einer Grundchemikalie wurde von Desormes und Clement im Jahr 1806 das Bleikammerverfahren zur Herstellung von Schwefelsäure entwickelt, bei dem Stickoxide die Oxidation des Schwefeldioxids katalysieren.[1]
Schon 1903 arbeitete der französische Chemiker Victor Henri auf dem Gebiet der Enzymkatalyse. Er untersuchte die Spaltung von Saccharose mit Hilfe des Enzyms Saccharase in Glucose und Fructose. Durch die Fortsetzung seiner Arbeiten durch den deutschen Biochemiker Leonor Michaelis und die kanadische Medizinerin Maud Menten gelang 1913 die Formulierung der Michaelis-Menten-Theorie, dem bis heutige gültigen Grundstein der Enzymkinetik. Das Potential der Enzymkatalyse für die ressourcenschonende Herstellung von Feinchemikalien, Arzneimitteln, Vitaminen oder Waschmitteln ist bis heute, über 100 Jahre nach der Entdeckung der Grundlagen, bei weitem nicht ausgeschöpft.[2] Das Verständnis der Enzymkatalyse und dessen Stereochemie wurde durch die Arbeiten von Cornforth, der dafür mit dem Chemie-Nobelpreis ausgezeichnet wurde, erweitert. Neben der Entwicklung der katalytischen Verfahren für Grund- und Zwischenprodukte wurden im Laufe der Jahre zahlreiche Verfahren für die Herstellung von Feinchemikalien entwickelt.

Otto Roelen entdeckte 1938 mit der Hydroformylierung die Herstellung von Aldehyden aus Olefinen, Kohlenmonoxid und Wasserstoff an Cobalt-Katalysatoren, die er bis zum großtechnischen Prozess weiterentwickelte.[3] Die Hydroformylierung gilt als erste großtechnische Anwendung homogener Übergangsmetallkatalysatoren. Das ursprüngliche Verfahren Roelens wurde vielfach weiterentwickelt. Mit dem von Karl Ziegler am Max-Planck-Institut für Kohlenforschung entwickelten Niederdruckverfahren, bei dem Ethylen und Propylen an Titan/Aluminium-Katalysatoren zu Polyolefinen umgesetzt werden, wurde die Grundlage für die petrochemische industrielle Massenproduktion von Polymeren gelegt, die das Kunststoffzeitalter einläutete. Ziegler wurde zusammen mit Giulio Natta für diese Arbeiten mit dem Nobelpreis für Chemie ausgezeichnet. Am MPI in Mülheim an der Ruhr entstanden die grundlegenden Arbeiten von Günther Wilke, der die Herstellung von 1,5-Cyclooctadien aus 1,3-Butadien an Nickel-Katalysatoren entdeckte sowie die Arbeiten von Wilhelm Keim zum SHOP-Prozess.[4] So wurden die Arbeiten von William S. Knowles und Ryoji Noyori „für ihre Arbeiten über chiral katalysierende Hydrierungsreaktionen“ sowie die nach Barry Sharpless benannte Epoxidierung mit dem Nobelpreis ausgezeichnet. Ebenfalls in den 1970er Jahren entdeckte Richard F. Heck die mit homogenen Palladium-Komplexen katalysierte Kreuzkupplung, die eine direkte Olefinierung von Arylhalogeniden erlaubt. Ein weiterer Nobelpreis auf dem Gebiet der Katalyse wurde 2005 für die Entdeckung der Alkenmetathese von Olefinen an Ruthenium-Katalysatoren an Chauvin, Schrock und Grubbs verliehen.
Formen der Homogenen Katalyse
Brönsted-Säure/-Base Katalyse
Bei der Brönsted-Säure/-Base-Katalyse fungieren das Proton H+ beziehungsweise das Hydroxid-Ion OH− als Katalysator. Die Aktivierung des Substrats erfolgt durch Protonierung / Deprotonierung. Typische Brönsted-Säure/-Base-katalysierte Reaktionen sind Veresterungen, Umesterungen oder Aldolreaktionen.[1]
Lewis-Säure/-Base Katalyse
Bei der Lewis-Säure/-Base-Katalyse sind die Katalysatoren meist Metallionen wie etwa das Titankation Ti4+ oder das Zinnkation Sn4+, die oft in Form ihrer organischen Salze, etwa als Alkoholate eingesetzt werden. Typische Reaktionen sind etwa Veresterungen.[1]
Redoxkatalyse
Bei der Redoxkatalyse wirken Metallkomplexe als Katalysator, die den Elektronenaustausch zwischen einem Oxidations- und einem Reduktionsmittel katalysieren. Der Katalysator aktiviert das Substrat durch Elektronenübertragung.[1]
Komplexkatalyse
Bei der Komplexkatalyse wirken Metallkomplexe als Katalysatoren. Die Aktivierung des Substrats erfolgt durch koordinative Wechselwirkungen.[1]
Metallorganische Komplexkatalyse
Häufig werden bei der homogenen Katalyse Übergangsmetalle verwendet. Dabei wird das zentrale Metallatom von Liganden komplexiert, wodurch der Katalysator einen wesentlichen Einfluss auf Selektivität und Umsatz einer Reaktion haben kann.[5]
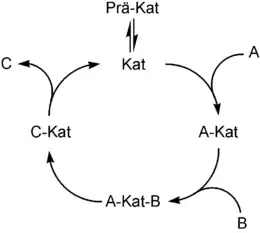
Die elementaren Schritte der homogenen Katalyse sind:
- Bildung der aktiven Katalysatorspezies (Prä-Kat → Kat)
- oxidative Addition eines Substrats an den Katalysator (A + Kat → A-Kat)
- Komplexbildung eines Substrats mit dem Katalysator (A-Kat + B → A-Kat-B)
- Insertion eines Substrats in eine Substrat-Katalysator-Bindung (A-Kat-B → C-Kat)
- gegebenenfalls eine Umlagerung
- reduktive Eliminierung des Produktes unter Freisetzung des Katalysators und des Produkts (C-Kat → C + Kat)
Neben der Umlagerung und der Insertion sind die oxidative Addition und die reduktive Eliminierung die zwei wichtigsten Elementarschritte der homogenen Übergangsmetallkatalyse. Bei der oxidativen Addition nimmt ein Metall zwei vorher kovalent miteinander verbundene Gruppen in seine Koordinationssphäre auf. Dadurch wird seine Oxidationszahl um zwei Einheiten erhöht. Der Ausgangskomplex muss hierfür zwei freie Koordinationsstellen aufweisen.
Die reduktive Eliminierung ist die Umkehr der oxidativen Addition. Hierbei werden zwei Liganden (A und B) als Molekül AB aus der Koordinationssphäre entfernt und die Oxidationszahl des zentralen Metallatoms um zwei erniedrigt.
Um eine bessere Abtrennung zu erreichen wird in manchen Prozessen der homogene Übergangsmetallkomplex durch den Einsatz spezieller, meist wasserlöslicher Liganden heterogenisiert und in eine Wasserphase überführt.
In einer Prozessvariante der Hydroformylierung, dem Ruhrchemie-Rhone-Poulenc-Verfahren, wird die Abtrennung des Katalysators durch einen Rhodium-Triphenylphosphantrisulfonat-Komplex (TPPTS) erreicht. Durch den sulfonierten Liganden verbleibt der Katalysator in der wässrigen Phase, während das Produkt des Prozesses, das aus Propen, Wasserstoff und Kohlenmonoxid hergestellte n-Butanal eine organische Phase bildet.
1966 gelang es Nozaki, durch den Einsatz eines chiralen Kupfer-Komplexes die erste asymmetrische Verknüpfung von Styrol und Ethyldiazoacetat zu cis- und trans-Cyclopropancarboxylaten im geringen Enantiomerenüberschuss.[1] In der Folgezeit wurde der Einfluss chiraler Liganden auf die stereochemische Steuerung katalytischer Reaktionen intensiv untersucht. Im Jahre 2001 wurden Barry Sharpless, Ryoji Noyori und William S. Knowles für ihre Forschungen auf dem Gebiet der asymmetrischen Katalyse mit dem Nobelpreis ausgezeichnet.
Organokatalyse
In der Organokatalyse wirken kleine organische Moleküle als Katalysator. Die Substrataktivierung erfolgt meist durch Bildung eines intermediären Moleküls. Dabei können sowohl organische als anorganische Stoffe erhalten werden. Ein bekanntes Beispiel ist das Anthrachinon-Verfahren, bei dem Wasserstoffperoxid hergestellt wird.
Enzymkatalyse
In der Enzymkatalyse wirken komplex aufgebaute Enzyme als Katalysatoren. Die Substrataktivierungsmechanismen sind vielfältig und reichen von Protonierungsreaktionen zu Redoxkatalyse, etwa bei Metalloenzymen.
Katalyse durch kleine anorganische Moleküle
Kleine anorganische Moleküle können als Katalysator wirken. Im Bleikammerverfahren, einem der ersten großtechnischen Anwendungen der homogenen Katalyse, wirkt Stickstoffdioxid als Katalysator.[6] Im OMEGA-Prozess wirkt ein Gemisch von Kaliumiodid/Kaliummolybdat gleichzeitig katalytisch sowohl auf die Carbonatisierung von Ethylenoxid als auch auf die Hydrolyse des gebildeten Ethylencarbonats.[7] In der Benzoin-Addition erfolgt die Addition von aromatischen Aldehyden unter Cyanid-Katalyse zu aromatischen α-Hydroxyketonen.
Lösungsmittel
Die Auswahl des Lösungsmittels hängt von der Polarität der Substrate ab. Polare Substrate werden typischerweise in Alkoholen oder Wasser umgesetzt, unpolare Substrate in Alkanen, oder einfachen Aromaten wie Benzol oder Toluol. Auch Ether, zum Beispiel Tetrahydrofuran finden Anwendung.
Das Lösungsmittel kann dabei neben seinen lösenden Eigenschaften als Ligand wirken und katalytisch aktive Zentren im Komplex besetzen.
Technische Prozesse
Ein großtechnischer homogenkatalytischer Prozess ist die Hydroformylierung (Oxosynthese, Roelen-Reaktion) von Olefinen zu Aldehyden mit Kohlenstoffmonoxid und Wasserstoff, z. B. von Propen zu n/iso-Butanal. Hier dient ein Rhodium-Triphenylphosphan-Komplex zur selektiven Umsetzung des Propens zum n-Butanal.
Mit der Reppe-Reaktion lässt sich aus Acetylen, Kohlenstoffmonoxid und Wasser mit Nickelcarbonyl-Katalysatoren Acrylsäure herstellen. Entsprechend lässt sich aus Ethen Propionsäure synthetisieren.
Mit Lewis-Säuren katalysierte Reaktionen erlauben Alkylierungsreaktionen und Synthesen von Carbonsäuren aus Olefinen, Kohlenmonoxid und Wasser oder Alkoholen.
Beim Hoechst-Wacker-Verfahren wird aus Ethylen und Luft oder reinem Sauerstoff mit löslichen Palladium-Komplexsalzen Acetaldehyd hergestellt.
Bei der Hydrocyanierung wird die Addition von HCN an ein Alken durch einen Nickelkomplex katalysiert. Eine wichtige Synthese ist die Hydrocyanierung von 1,3-Butadien zu Adipinsäuredinitril (DuPont).
Nach dem Ziegler-Natta-Verfahren wird Ethen im großtechnischen Maßstab zu Polyethylen polymerisiert. Entsprechend lassen sich Diene oligomerisieren, z. B. 1,3-Butadien mit Nickel-Komplexen zu Cyclododeca-1,5,9-trien beziehungsweise zu Cycloocta-1,5-dien.
Literatur
- J. Falbe, H. Bahrmann: Homogene Katalyse in der Technik. In: Chemie in unserer Zeit. 15, Nr. 2, 1981, S. 37–45. doi:10.1002/ciuz.19810150203
- Michael Röper: Homogene Katalyse in der chemischen Industrie. In: Chemie in unserer Zeit. 40, Nr. 2, 2006, S. 126–135. doi:10.1002/ciuz.200600373
- Arno Behr: Angewandte homogene Katalyse. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31666-3.
Weblinks
Einzelnachweise
- Dirk Steinborn: Grundlagen der metallorganischen Komplexkatalyse. Teubner, 2007, ISBN 978-3-8351-0088-6 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hubert Rehm, Friederike Hammar: Biochemie light. Harri Deutsch Verlag, 2008, ISBN 978-3-8171-1819-9, S. 23 (eingeschränkte Vorschau in der Google-Buchsuche).
- Boy Cornils, Wolfgang A. Herrmann, Manfred Rasch: Otto Roelen als Wegbereiter der industriellen homogenen Katalyse. In: Angewandte Chemie. Band 106, Nr. 21, 1994, S. 2219–2238, doi:10.1002/ange.19941062104.
- Dieter Vogt: Nonaqueous Organic/Organic Separation (SHOP Process). In: Boy Cornils, Wolfgang A. Herrmann (Hrsg.): Aqueous-Phase Organometallic Catalysis. John Wiley & Sons, 2004, ISBN 3-527-30712-5, S. 639 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Angewandte homogene Katalyse, von Arno Behr. books.google.de. Abgerufen am 26. November 2009.
- O. Wentzki: Zur Theorie des Bleikammerprozesses. In: Zeitschrift für Angewandte Chemie. 23, 1910, S. 1707–1714, doi:10.1002/ange.19100233603.
- Kazuki Kawabe: Development of Highly Selective Process for Mono-Ethylene Glycol Production from Ethylene Oxide via Ethylene Carbonate Using Phosphonium Salt Catalyst. In: Catalysis Surveys from Asia. 14, 2010, S. 111–115, doi:10.1007/s10563-010-9094-4.