Benzoesäure
Benzoesäure [ˈbɛnt͜soeˌzɔɪ̯ʀə] ist eine aromatische Carbonsäure. Sie besteht aus einem Phenylrest mit einer Carboxygruppe. Die Salze und Ester der Benzoesäure werden Benzoate genannt.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
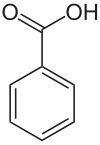 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Benzoesäure (IUPAC, gebräuchlich) | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C7H6O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit charakteristischem Geruch[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 122,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,27 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
250 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
4,2[5] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Brechungsindex |
1,504 (132 °C)[7] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Etymologie
Die Benzoesäure wurde nach ihrem Ausgangsmaterial, dem Benzoeharz, benannt. Diese Bezeichnung wiederum ist malaysischen Ursprungs und hieß ursprünglich "lubân djawi" = Weihrauch von Java. Mit der gleichnamigen Droge wanderte der Name nach Westen, zunächst in den Mittelmeerraum. Aus dem Fortfall des Anlautes lu- wurde über banjawi, beijoim, belzui, schließlich benzoe.[9]
Vorkommen
Als ein Hauptbestandteil des Harzes Benzoe ist Benzoesäure in Weihrauch – vorwiegend im russisch-orthodoxen Raum[10] – enthalten. Benzoe ist das Harz zweier Baumarten aus der Gruppe der Storaxbaumgewächse (Styracaceae), der „Siam-Benzoe“ (Styrax tonkinensis) und der „Sumatra-Benzoe“ (Styrax benzoin), die beide in Südostasien beheimatet sind.[11] Daneben findet sich Benzoesäure auch in Früchten, zum Beispiel im Paradiesapfel Malus pumila, Preiselbeeren (bis 0,24 % Gehalt), Himbeeren, Heidelbeeren und Pflaumen (Gehalt 0,1–0,2 %) und im Wehrsekret verschiedener Schwimmkäfer der Gattung Dytiscus. Weiterhin kommt Benzoesäure auch in vielen Lebensmitteln wie Milch und Milchprodukten sowie in Honig vor.[6]
Eigenschaften

Benzoesäure bildet farblose, glänzende Blättchen oder nadelförmige Kristalle, die in kaltem Wasser nur wenig, in warmem Wasser dagegen besser löslich sind. Bei über 370 °C zersetzt sich Benzoesäure langsam in Benzol und Kohlenstoffdioxid (CO2). Benzoesäure hat einen intensiven Geruch und ist brennbar. Der Flammpunkt liegt bei 140 °C, die Zündtemperatur bei 570 °C[3]
Darstellung
Benzoesäure kann über eine Grignard-Reaktion ausgehend von Brombenzol dargestellt werden. Das Brombenzol reagiert mit Magnesium zu Phenylmagnesiumbromid, welches mit Kohlenstoffdioxid zu C6H5COOMgBr und schließlich durch Zugabe einer Salzsäurelösung zu Benzoesäure reagiert.
Ferner kann Benzoesäure durch Carboxylierung von Benzol mittels Phosgen und Aluminiumtrichlorid (AlCl3) als Katalysator dargestellt werden. Diese Reaktion besteht aus einer Friedel-Crafts-Acylierung und anschließender Hydrolyse des Zwischenprodukts Benzoylchlorid:
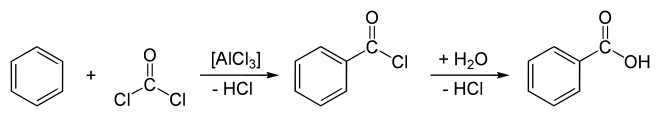
Technisch erfolgt eine Oxidation von Toluol mit Braunstein und Schwefelsäure in Gegenwart von Mangannaphthenat, oder durch die Reaktion mit Kaliumpermanganat. Industriell wird heute Toluol mit Sauerstoff in der Gasphase in Gegenwart von Katalysatoren wie Vanadiumpentoxid oxidiert.
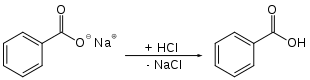
Im Labor kann Benzoesäure ausgehend von Natriumbenzoat synthetisiert werden. In Gegenwart von Salzsäure oder Essigsäure reagiert Natriumbenzoat zur Benzoesäure und Natriumchlorid bzw. Natriumacetat:
Verwendung
Benzoesäure wird bei der Herstellung von Benzoesäureestern gebraucht, die in der Parfümindustrie als Duftstoffe (wie Benzoesäureethylester) oder als Biozide (beispielsweise Benzoesäurebenzylester) Anwendung finden. Auch bestimmte Lokalanästhetika sind Ester der Benzoesäure.[12] Außerdem wird Benzoesäure für Weichmacher, bei der Darstellung von Benzoylverbindungen, wie Benzoylchlorid und Dibenzoylperoxid, verwendet.
In der Lebensmittelindustrie wird Benzoesäure (E 210) als Konservierungsmittel häufig in haltbaren Nahrungsmitteln eingesetzt, wie Ketchup, Senf und anderen Soßen, sowie Wurst, Margarine, Fischsalaten und vielen anderen Produkten, vor allem aber bei sauer eingelegten Lebensmitteln. Wegen besserer Löslichkeit ist eher die Verwendung der Salze üblich: Natriumbenzoat (E 211), Kaliumbenzoat (E 212), Calciumbenzoat (E 213).[13] Außerdem ist Benzoesäure in der europäischen Union als Futtermittelzusatzstoff für Mastschweine zugelassen.[14]
Weiterhin wird Benzoesäure häufig als Konservierungsstoff in Tabakprodukten verwendet. Die deutsche und die Schweizer Tabakverordnung gestattet den Einsatz von Benzoesäure und Natriumbenzoat.
Benzoesäure wird zur Behandlung von Hautpilzen eingesetzt und ist gemäß deutscher Kosmetik-Verordnung zur Konservierung von Kosmetika zugelassen. Die bakteriostatische und fungistatische Wirkung beruht auf dem Hemmeffekt gegenüber Enzymen, die reaktive Sauerstoffspezies abbauen (Katalase und Peroxidase), wodurch eine Wasserstoffperoxid-Ansammlung in den Zellen der Mikroorganismen erzeugt wird. Diese führt letztlich zu deren Absterben.
In der Umweltbeobachtung werden Bodenfallen mit gesättigter Benzoesäurelösung gefüllt, um erfasste Lebewesen wie Insekten oder Schnecken zu töten und bis zur nächsten Leerung zu fixieren.
Benzoesäure ist eine Urtitersubstanz nach Arzneibuch.
Toxikologie
Benzoesäure ist ein lungenschädigender Stoff und kann asthmaartige Symptome hervorrufen. Er wirkt ätzend und kann schwere Augenschäden verursachen.[3] Er wird auch im Zusammenhang mit Konzentrationsproblemen und Hyperaktivität bei Kindern diskutiert.[15] Das BfR wies auf eine mögliche Bildung von geringen Mengen giftigen Benzols aus Benzoesäure in Verbindung mit Ascorbinsäure (Vitamin C) in Erfrischungs- und Fruchtsäften hin.[16][17]
Weblinks
- zusatzstoffe-online.de: Benzoesäure
- Das chemisch konservierte Klima – Radiofeuilleton Mahlzeit
Einzelnachweise
- Eintrag zu BENZOIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 14. Januar 2020.
- Eintrag zu E 210: Benzoic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 15. August 2020.
- Eintrag zu Benzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Datenblatt Benzoesäure (PDF) bei Merck, abgerufen am 28. Dezember 2010.
- Charles E. Mortimer: Chemie – Das Basiswissen der Chemie, Thieme 2003, ISBN 3-13-484308-0.
- Eintrag zu Benzoesäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Dezember 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-38.
- Eintrag zu Benzoic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Christian Wiegand: Entstehung und Deutung wichtiger organischer Trivialnamen. In: Angewandte Chemie. A/60. Jahrg. 1948/Nr. 4
- Klaus D. Christof, Renate Haass: Weihrauch: der Duft des Himmels. J. H. Röll Verlag, 2006, ISBN 978-3-89754-252-5, S. 49–50.
- Eintrag zu Benzoeharz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Februar 2012.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 20.
- ZZulV: Anlage 5 (zu § 5 Abs. 1 und § 7) – Zusatzstoffe, die für Lebensmittel zur Konservierung oder als Antioxidationsmittel zugelassen sind (Memento vom 9. September 2017 im Internet Archive).
- Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: Liste der für Futtermittel zugelassenen Zusatzstoffe, Abschnitt 12: Säureregulatoren. Abgerufen am 27. Juni 2015.
- Kurzartikel auf Welt-Online vom 28. Mai 2008.
- Stellungnahme Nr. 013/2006 des BfR vom 1. Dezember 2005: Hinweise auf eine mögliche Bildung von Benzol aus Benzoesäure in Lebensmitteln (PDF; 58 kB)
- Fragen und Antworten - BfR vom 16. Dezember 2013: Fragen und Antworten zu Benzol in Erfrischungsgetränken und Karottensäften.

