Ionengitter
Unter einem Ionengitter oder Ionenkristall versteht man in der Chemie und der Festkörperphysik die regelmäßige räumliche Anordnung von Anionen und Kationen in einem homogenen Stoff im festen Zustand. Der Zusammenhalt des Gitterverbandes erfolgt durch Ionenbindungen.
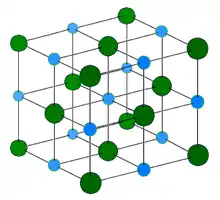
jedes Atom hat sechs direkte Nachbarn
Ionenkristalle sind die bekanntesten Beispiele für Kristalle mit kubischer Gitterstruktur:
- Natriumchlorid-Gitter (Natriumchlorid) für die kubisch flächenzentrierte Struktur
- Caesiumchlorid für die kubisch raumzentrierte Struktur.
Struktur
Die Struktur der Ionengitter hängt zum einen vom Größenverhältnis der Ionen, zum anderen vom Ladungsverhältnis ab.
| Stoffname | Verhältnisformel | Kation | Anion | Koordination[1] | Kristallsystem | weitere Beispiele | |
|---|---|---|---|---|---|---|---|
| Sphalerit (Zinkblende) Zinksulfid | ZnS | Zn2+ | S2− | 4:4 | Jedes Zinkkation ist tetraedrisch von 4 Sulfidanionen umgeben, jedes Sulfidanion ebenfalls tetraedrisch von 4 Zinkkationen. | kubisch | CuCl, CuBr, CuI, BeS, HgS |
| Wurtzit | ZnS | Zn2+ | S2− | 4:4 | hexagonal | NH4F, BeO, ZnO, AgI, CdS | |
| Rutil | TiO2 | Ti4+ | O2− | 3:6 | Jedes Titankation ist verzerrt oktaedrisch von 6 Oxidionen umgeben, jedes Oxidion planar von 3 Titankationen. Hier liegt der Bindungscharakter zwischen einer Ionen- und einer Atombindung | tetragonal | SnO2, MgF2, PbO2, MnO2 |
| Natriumchlorid | NaCl | Na+ | Cl− | 6:6 | Jedes Natriumkation ist oktaedrisch von 6 Chloridanionen umgeben, jedes Chloridanion ebenfalls oktaedrisch von 6 Natriumkationen. | kubisch | NaF, KF, AgF, KCl, AgCl, NH4Cl (über 184,3 °C), NaBr, KBr, AgBr, NaI, KI, NaH, KH, MgO, CaO, SrO, BaO, FeO, CoO, NiO, MgS, CaS, MnS, PbS |
| Calciumfluorid (Fluorit) | CaF2 | Ca2+ | F− | 4:8 | Jedes Calciumkation ist von 8 Fluoridionen würfelförmig umgeben, jedes Fluoridion tetraedrisch von 4 Calciumkationen. | kubisch | PbF2, BaF2, SrCl2, CdF2; Antifluoritstruktur: Li2O, Na2O, K2O |
| Caesiumchlorid | CsCl | Cs+ | Cl− | 8:8 | kubisch | NH4Cl (bei Raumtemp.), TiCl, CsBr, NH4Br, TlBr, CsI, NH4I,TlI | |
| Kaliumnitrat | KNO3 | K+ | NO3− | orthorhombisch | |||
| Calcit (Kalkspat) | CaCO3 | Ca2+ | CO32− | trigonal | |||
| Natriumchlorat | NaClO3 | Na+ | ClO3− | monoklin | |||
| Kupfersulfat | CuSO4 | Cu2+ | SO42− | triklin | |||
Sonderformen
- Bei Antistrukturen, z. B. der Antifluoritstruktur, sind die Position der Anionen und Kationen miteinander vertauscht.
- Ionengitter können auch stöchiometrische Mengen kleiner Moleküle in den Gitterlücken enthalten (zum Beispiel Kristallwasser).
- Schichtengitter:
- Orthoborsäure H3BO3 ist ein planares Molekül. Im festen Zustand bilden diese Moleküle untereinander Wasserstoffbrücken aus, so dass ein zweidimensionales Blatt entsteht. Diese Blätter sind übereinander gestapelt. Der Zusammenhalt zwischen den Schichten erfolgt durch Van-der-Waals-Wechselwirkung.
- Sandwich-Gitter:
- Bei Cadmiumiodid CdI2 und Cadmiumchlorid CdCl2 liegt eine Kationenschicht zwischen zwei Anionenschichten. Die Anziehungskräfte zwischen den Schichten sind relativ schwach. Diese Dreierlagen können auf zwei Arten übereinander gestapelt sein: ABAB… wie CdI2, Mg(OH)2 und PbI2 oder ABCABC… wie CdCl2, FeCl2 und MgCl2.
Siehe auch
Atomgitter, Molekülgitter, Metallgitter, Kristallgitter, amorpher Zustand, Gitterstruktur, Gitterkonstante, Gitterenthalpie
Einzelnachweise
- Die Koordination gibt an, wie viel Anionen ein Kation umgeben und wie viel Kationen ein Anion umgeben.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.