Elektrisches Dipolmoment
Das elektrische Dipolmoment charakterisiert eine räumliche Ladungstrennung. Hat man in einem Körper, z. B. einem Molekül, an unterschiedlichen Orten eine elektrische Ladung unterschiedlichen Vorzeichens, so dass der Schwerpunkt der negativen Ladungen (Elektronen) und der Schwerpunkt der positiven Ladungen (Atomkerne) nicht zusammenfallen, dann besitzt dieser Körper ein elektrisches Dipolmoment.
| Physikalische Größe | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Name | Elektrisches Dipolmoment | |||||||||||||||
| Formelzeichen | ||||||||||||||||
| ||||||||||||||||
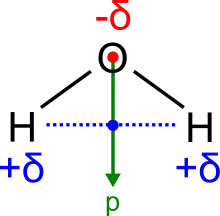
rot: negative Teilladung
blau: positive Teilladung
grün: gerichteter Dipol
In der Chemie ist das Dipolmoment ein Maß für die Stärke eines Dipolmoleküls und damit für die Polarität eines Moleküls. Diese wird durch polare Atombindungen oder im Extremfall durch ionische Bindungen hervorgerufen.
Es sind auch andere Dipole (z. B. magnetische Dipole) möglich, die folglich auch andere Dipolmomente ausbilden.
Richtungskonvention
Bezüglich der Richtung des Vektors des elektrischen Dipolmomentes herrschen in den verschiedenen Fachbereichen verschiedene Konventionen. Während in der Physik der Pfeil von der negativen Ladung zur positiven gezeichnet wird,[1] wird es beispielsweise in der Chemie genau andersherum gesehen, also von der positiven Ladung zur negativen.[2]
Berechnung
| Molekül | Dipolmoment in Debye | Dipolmoment in 10−30 C·m |
|---|---|---|
| CO[4] | 0,11 | 0,367 |
| HF[4] | 1,826178 | 6,0915 |
| HCl[4] | 1,109 | 3,700 |
| HBr[4] | 0,827 | 2,759 |
| HI[4] | 0,448 | 1,495 |
| NH3[4] | 1,471 | 4,907 |
| PF3[5] | 1,025 | 3,419 |
| H2O[6] | 1,84 | 6,152 |
| H2S[4] | 0,97 | 3,236 |
| CH2O[7] | 2,34 | 7,806 |
| NaCl[8] | 8,5 | 28,356 |
| KF[6] | 7,33 | 28,690 |
| KCl[6] | 10,48 | 34,261 |
| KBr[6] | 10,41 | 34,728 |
| KI[6] | 11,05 | 36,825 |
| CsCl[4] | 10,387 | 34,647 |
Befindet sich zu einer negativen Ladung im Abstand eine positive Ladung mit dem normierten Verbindungsvektor (dieser zeigt von der negativen Ladung in Richtung der positiven Ladung)[9] und sind diese Ladungen untereinander starr verbunden, so besitzt diese Struktur ein Dipolmoment der Größe:[10]
Je größer die Ladung , desto höher auch das Dipolmoment. Auch wenn die Ladungen weiter auseinanderrücken (wachsender Betrag von ), wird das Dipolmoment größer.
Befinden sich bei einer diskreten Ladungsverteilung Ladungen an den Orten relativ zum Schwerpunkt der Ladungsverteilung, so setzt sich das Gesamtdipolmoment aus den Einzeldipolmomenten zusammen:
Im allgemeinen Fall einer kontinuierlichen Ladungsverteilung wird das Dipolmoment über die Ladungsdichte berechnet:[10]
Der diskrete Fall geht aus dem allgemeinen hervor, wenn man die Ladungsdichte durch die einzelnen Ladungen und die Delta-Distribution darstellt:
Das Volumenintegral liefert dann nur Beiträge an den Orten der Ladungen, sodass sich ergibt:
Allgemein kann ein Potential in einen konstanten Teil und Multipolanteile, darunter eben das Dipolmoment, entwickelt werden.[11]
Einheit
Trotz der Umstellung auf das Internationale Einheitensystem (SI) wird weiterhin auch die cgs-Einheit Debye als Einheit des Dipolmoments verwendet, benannt nach dem holländischen Physiker Peter Debye. Der Grund dafür liegt darin, dass man bei der Verwendung der SI-Einheiten Coulomb und Meter mit sehr kleinen Zahlen umgehen müsste:[12]
Für Moleküle liegt das Dipolmoment meist im Bereich von 0 Debye bis 12 Debye. Die polarste nichtionische, vollständig gesättigte Verbindung ist mit einem Dipolmoment von 6,2 Debye all-cis-1,2,3,4,5,6-Hexafluorcyclohexan.[13][14] Mit 14,1 Debye ist die ebenfalls nichtionische, aber ungesättigte Verbindung 5,6-Diaminobenzo-1,2,3,4-tetracarbonitril nochmals deutlich polarer.[15][16]
Das Dipolmoment kann man mit Hilfe der Debye-Gleichung durch Messung der Dielektrizitätskonstante bestimmen. Ferner geben Messungen des Stark-Effekts Auskunft über das Dipolmoment eines Stoffes.
Dipolmomente angeregter Zustände
Die Kenntnis der Änderung von molekularen Dipolmomenten bei elektronischer Anregung ist wesentlich für das Verständnis wichtiger natürlicher photoinduzierter Prozesse, wie der Photosynthese oder des Sehvorgangs. Zur Bestimmung der Dipolmomente angeregter Zustände kommt die Messung von solvatachromen oder thermochromen Wellenlängen-Verschiebungen in Lösungen in Frage.[17][18]
Die Dipolmomente
- μG im Grundzustand des Moleküls sowie
- μE im angeregten Zustand des Moleküls
lassen sich berechnen mit Hilfe der Lippert-Mataga-Gleichung:
mit
- der Stokesverschiebung
- dem Planckschen Wirkungsquantum
- der Lichtgeschwindigkeit im Vakuum
- der Permittivität ε des Lösungsmittels
- dem Brechungsindex n des Lösungsmittels
- dem Radius a der Lösungsmittelkavität.
Dipolmomente von Molekülen in der Gasphase können wesentlich genauer durch elektronische Stark-Spektroskopie bestimmt werden.[19]
Siehe auch
Literatur
- Otto Exner: Dipole Moments in Organic Chemistry. Stuttgart 1975, ISBN 3-13-523501-7.
Einzelnachweise
- Gordon M. Barrow: PHYSIKALISCHE CHEMIE. 6., berichtigte Auflage. Gesamtausgabe. Bohmann Verlag, Wien 1984, ISBN 3-528-53806-6, Teil I 7 – Elektrische und magnetische Molekülmomente, S. 247–259.
- Peter W. Atkins, Loretta Jones: Chemie – einfach alles. Hrsg.: Rüdiger Faust. 2. Auflage. WILEY-VCH, Weinheim 2006, ISBN 978-3-527-31579-6, S. 86.
- Bei einer Temperatur von 20 °C und einem Druck von 101,325 kPa.
- David R. Lide: CRC Handbook of Chemistry and Physics. 87. Auflage. B&T, 2006, ISBN 0-8493-0487-3.
- David Frank Eggers: Physical chemistry. Wiley, 1964, ISBN 978-0-471-23395-4, S. 572 (eingeschränkte Vorschau in der Google-Buchsuche).
- BI Bleaney, Betty Isabelle Bleaney, Brebis Bleaney: Electricity and Magnetism. 3. Auflage. Vol. 2. OUP Oxford, 2013, ISBN 978-0-19-964543-5, S. 303 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jean-Marie André, Joseph Delhalle, Jean Luc Brédas: Quantum Chemistry Aided Design of Organic Polymers An Introduction to the Quantum Chemistry of Polymers and Its Applications. World Scientific, 1991, ISBN 978-981-02-0004-6, S. 89 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jacob N. Israelachvili: Intermolecular and Surface Forces Revised Third Edition. Academic Press, 2011, ISBN 978-0-12-391927-4, S. 72 (eingeschränkte Vorschau in der Google-Buchsuche).
- Paul Allen Tipler, Gene Mosca: Physik für Studierende der Naturwissenschaften und Technik. Hrsg.: Peter Kersten, Jenny Wagner. 8. Auflage. Springer Spektrum, Berlin/Heidelberg 2019, ISBN 978-3-662-58281-7, S. 684.
- Ernst-Wilhelm Otten: Repetitorium Experimentalphysik. Springer, Berlin/Heidelberg 2008, ISBN 978-3-540-85788-4, S. 464 (eingeschränkte Vorschau in der Google-Buchsuche).
- Armin Wachter, Henning Hoeber: Repetitorium Theoretische Physik. Springer, Berlin/Heidelberg 2013, ISBN 978-3-662-09755-7, S. 175 (eingeschränkte Vorschau in der Google-Buchsuche).
- Ralf Steudel: Chemie der Nichtmetalle mit Atombau, Molekülgeometrie und Bindungstheorie. Walter de Gruyter, 1998, ISBN 978-3-11-015902-8, S. 137 (eingeschränkte Vorschau in der Google-Buchsuche).
- Neil S. Keddie, Alexandra M. Z. Slawin, Tomas Lebl, Douglas Philp, David O’Hagan: All-cis 1,2,3,4,5,6-hexafluorocyclohexane is a facially polarized cyclohexane. In: Nature Chemistry. 7, 2015, S. 483–488, doi:10.1038/nchem.2232, PMID 25991526.
- Stephen K. Ritter: Molecule Claims Most Polar Title. In: Chemical & Engineering News. 93(13), 2015, S. 5.
- Stephen K. Ritter: Lopsided Benzene Sets A New Polarity Record. In: Chemical & Engineering News. 94(7), 2016, S. 23.
- Jakob Wudarczyk, George Papamokos, Vasilis Margaritis, Dieter Schollmeyer, Felix Hinkel, Martin Baumgarten, George Floudas, Klaus Müllen: Hexasubstituted Benzenes with Ultrastrong Dipole Moments. In: Angewandte Chemie International Edition. 55, 2016, S. 3220–3223, doi:10.1002/anie.201508249.
- E. Lippert: Spektroskopische Bestimmung des Dipolmomentes aromatischer Verbindungen im ersten angeregten Singulettzustand. In: Z. Electrochem. Band 61, 1957, S. 962.
- N. Mataga, Y. Kaifu, M. Koizumi: Solvent effects upon fluorescence spectra and the dipole moments of excited molecules. In: Bull. Chem. Soc. Jpn. Band 29, 1956, S. 465.
- Josefin Wilke, Martin Wilke, W. Leo Meerts, Michael Schmitt: Determination of ground and excited state dipole moments via electronic Stark spectroscopy: 5-methoxyindole. In: The Journal of Chemical Physics. Band 144, Nr. 4, 28. Januar 2016, ISSN 0021-9606, S. 044201, doi:10.1063/1.4940689.