Monsanto-Prozess
Der Monsanto-Prozess ist ein Verfahren zur industriellen Darstellung von Essigsäure. Der Prozess findet bei einem Druck von 30 bis 60 bar und einer Temperatur von 150 bis 200 °C statt mit einer Selektivität von über 99 %.
Geschichte
Er wurde 1960 von BASF entwickelt und 1966 von Monsanto durch Einführung eines anderen Katalysator-Systems verbessert.[1] Dabei wird Methanol mit Kohlenmonoxid katalytisch zu Essigsäure umgesetzt. Die Summengleichung lautet:
Mechanismus
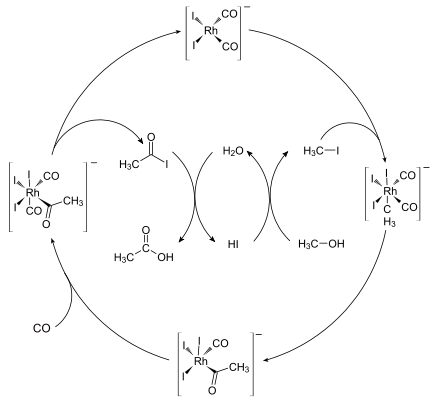
Die katalytisch aktive Spezies ist der anionische Komplex cis-[Rh(CO)2I2]− (1). Der katalytische Zyklus besteht aus sechs Schritten, von denen zwei nicht unter Beteiligung des Rhodiums ablaufen: die Konvertierung des Methanols in Methyliodid und die Hydrolyse des Acetyliodids in Essigsäure. Der erste Schritt ist die oxidative Addition des Methyliodids an den Rhodiumkomplex unter Bildung des Komplexes [(CH3)Rh(CO)2I3]− (2). Dieser Komplex lagert sich schnell, unter Insertion des Carbonyls in die Metall-Methylbindung, in den Acetylkomplex [(CH3CO)Rh(CO)I3]− (3) um.
An diesen fünffach-koordinierten Komplex lagert sich ein weiteres Kohlenmonoxid-Molekül an. Dieser Komplex zerfällt unter reduktiver Eliminierung des Acetyliodids CH3COI, welches unter Hydrolyse in Essigsäure und Iodwasserstoff (HI) zerfällt unter Bildung der Ausgangsverbindung. Die Reaktion ist erster Ordnung bezüglich des Katalysators und des Methyliodids. Daher wird angenommen, dass der geschwindigkeitsbestimmende Schritt die oxidative Addition des Methyliodids an den Katalysator ist.
Varianten
Cativa-Prozess
Der Monsanto-Prozess wurde mittlerweile durch den Cativa-Prozess ergänzt, der bei ähnlichem Reaktionsmechanismus einen Iridiumkatalysator verwendet und der von der BP entwickelt wurde. Im Cativa-Prozess[2][3] ist der Iridium-Komplex [Ir(CO)2I2]− die katalytisch aktive Spezies. Iridium ist einerseits ein billigeres Katalysatormetall, der Prozess erfordert auch weniger Wasser in der Reaktionslösung und erspart damit Trocknungsstufen in späteren Prozess-Schritten. Die Entwicklung des Prozesses begann in den 1990er Jahren, im November 1995 wurde in Texas City, USA, die erste kommerzielle Anlage in Betrieb genommen.[3]
Tennessee-Eastman-Essigsäureanhydrid-Prozess
Eine weitere Möglichkeit der Darstellung von Essigsäure bietet der Tennessee-Eastman-Prozess, unter Bildung von Essigsäureanhydrid. Die Bildung des Essigsäureanhydrids erfolgt durch die Carbonylierung von Methylacetat in einem Prozess, der sich an den Monsanto-Prozess anlehnt:[4]
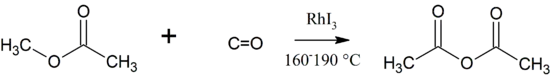
Als Katalysatoren werden Rhodiumiodid und Lithiumsalze verwendet. Im Gegensatz zu den obigen Verfahren wird dieses Verfahren wegen der Empfindlichkeit des Anhydrids unter Ausschluss von Wasser durchgeführt. Das Methylacetat wird dabei durch Lithiumiodid in Methyliodid und Litiumacetat gespalten. Das im katalytischen Zyklus gebildete Acetyliodid bildet mit dem Lithiumacetat das Produkt Essigsäureanhydrid.
Einzelnachweise
- Greener Industry: Ethanoic Acid - Production Method: The Monsanto Process, (englisch)
- Jones, J.H.: The CativaTM Process for the Manufacture of Acetic Acid. In: Platinum Metals Review. 44, Nr. 3, 2000, S. 94–105.
- Sunley G.J., Watson D.J.: High productivity methanol carbonylation catalysis using iridium - The CativaTM process for the manufacture of acetic acid. In: Catalysis Today. 58, Nr. 4, 2000, S. 293–307. doi:10.1016/S0920-5861(00)00263-7.
- Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. Eastman Chemical Company Acetic Anhydride Process In: Catalysis Today 1992, 13, S. 73–91. doi:10.1016/0920-5861(92)80188-S