Gliederfüßer
Die Gliederfüßer (Arthropoda, von altgriechisch ἄρθρον árthron, deutsch ‚Glied, Gelenk‘ und πούς poús, Gen. ποδός podós, deutsch ‚Fuß‘, gelegentlich eingedeutscht als Arthropoden)[1] sind ein Stamm des Tierreichs. Zu ihnen gehören Insekten, Tausendfüßer, Krebstiere (z. B. Krebse, Entenmuscheln), Spinnentiere (z. B. Spinnen, Skorpione, Milben) und die ausgestorbenen Trilobiten.
| Gliederfüßer | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Beispiele fossiler und rezenter Arthropodengruppen: Trilobiten, Kieferklauenträger wie Seeskorpione und Spinnentiere, Krebstiere, Tausendfüßer und Sechsfüßer | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Arthropoda | ||||||||||||
| von Siebold, 1848 | ||||||||||||
| Unterstämme | ||||||||||||
|
Gliederfüßer sind ein sehr erfolgreicher Stamm. Rund 80 Prozent aller bekannten rezenten (nicht fossilen) Tierarten sind Gliederfüßer. Sie verteilen sich auf beinahe eine Million Insektenarten, knapp 10.000 sonstige Sechsfüßer, etwa 16.000 Tausendfüßer, gut 100.000 Spinnentiere und knapp 50.000 Krebstiere[2] (nur Größenordnungen, genaue Zahlen schwanken je nach Autor und Jahr der Publikation). Sie entstanden vermutlich während der kambrischen Explosion, als zu Beginn des Kambriums vor etwa 540 Millionen Jahren die mehrzelligen Tierstämme plötzlich in der Fossilüberlieferung auftraten.
Die nächsten Verwandten der Gliederfüßer sind die Bärtierchen (Tardigrada) und Stummelfüßer (Onychophora), mit denen sie zu den Panarthropoda zusammengefasst werden. Einige Taxonomen nennen diese übergeordnete Gruppe Arthropoda, die „eigentlichen“ Arthropoden werden dann als „Euarthropoda“ bezeichnet.
In der traditionellen Systematik wird diese Gruppe aus morphologischen Gründen mit den Ringelwürmern zu den Gliedertieren (Articulata) zusammengefasst. Neuere molekularbiologische Daten sprechen aber für eine enge Verwandtschaft der Gliederfüßer mit den Fadenwürmern (Nematoda) und deren engster Verwandtschaft (Cycloneuralia). Diese gemeinsame Gruppierung wird Häutungstiere (Ecdysozoa) genannt.
Körperbau
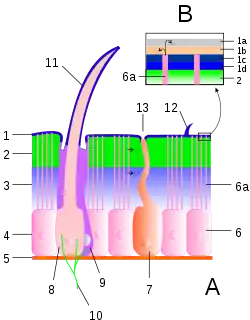
1 Epicuticula mit Details (B):
1a Cementum
1b Wachsschicht
1c Epicuticula externa
1d Epicuticula interna
2 Exocuticula, 3 Endocuticula
2 + 3 Procuticula
4 Epithelschicht, 5 Basalmembran
6 Epithelzelle, 6a Porenkanäle
7 Drüsenzelle
8 Cuticulagrube (Bothrion)
9 Wärmerezeptive Zellen
10 Nervenenden
11 Trichobothrium
12 Sensillum
13 Drüsenöffnungen
Außenskelett
Die Körperhülle der Arthropoden bildet ein Außenskelett, das von den Epithelzellen der obersten Zellschicht (Epidermis) nach außen abgeschieden wird; sie wird als Cuticula bezeichnet. Durch die feste Außenhülle ist ein Wachstum nur dadurch möglich, dass diese Hülle periodisch abgestreift und ersetzt wird (Häutung). Die verhärtete Außenhülle an Körper und Extremitäten ist das Merkmal, welches die Arthropoden am besten kennzeichnet, ähnliche Bildungen kommen nur noch bei den verwandten Bärtierchen vor.
Die Körperhülle besteht aus Chitin und zahlreichen Proteinen. Chitin und Proteine werden durch eingelagerte vom Dopamin abgeleitete Verbindungen untereinander netzartig fest verbunden („sklerotisiert“). Sie kann danach flexibel bleiben (z. B. am Hinterleib der meisten Spinnen oder zahlreicher Insektenlarven). Typischerweise sind aber ausgehärtete, stärker sklerotisierte Platten (Sklerite) eingelagert, die von schwächer sklerotisierten Gelenkmembranen unterbrochen, gelegentlich aber zu Hüllen oder Panzern fest verbunden sein können. Bei vielen Krebstieren und Tausendfüßern und wenigen Insekten(larven) ist die Hülle durch Kalkeinlagerung weiter verstärkt.
Die Hülle ist farblos, strohfarben oder gelblich, häufig durch Melanin, Pigmente, gelegentlich auch durch Strukturfarben dunkel oder bunt gefärbt. Bei den Insekten und Spinnen besitzt sie als äußere Lage eine Lipidschicht als Verdunstungsschutz, die den Tausendfüßern und auch allen landlebenden Krebstieren fehlt.
Segmente
Arthropoden besitzen einen in Segmente gegliederten Körper. Die Segmente weisen im Grundbauplan gleichen Bau mit gleichen Organen, Anhängen etc. auf (mit Ausnahme des ersten und des letzten). Bei allen Arthropoden ist dieser Grundbauplan durch zahlreiche Abwandlungen nur in Teilen tatsächlich verwirklicht, in der Regel sind die Segmente aber gut erkennbar gegeneinander abgegrenzt, und zahlreiche Organe (z. B. Gliedmaßen, Öffnungen des Herzens, Drüsen, Muskeln) sind segmental angelegt.
Traditionell wird angenommen, im Grundbauplan hätten die Gliederfüßer eine unbestimmte Anzahl in sich gleichartiger Segmente besessen, deren Anzahl erst später im Zuge der Spezialisierung fixiert worden sei. Diese Annahme beruht aber großenteils auf der Analogie mit den Ringelwürmern. Alle Gliederfüßer mit Ausnahme einiger Tausendfüßer, der Kiemenfußkrebse und der ausgestorbenen Trilobiten besitzen eine fixierte Segmentzahl; auch die aus dem Kambrium fossil überlieferten Lobopoden, die allgemein als Stammgruppenvertreter gelten, besaßen eine fixierte (und überschaubar große) Segmentzahl. Innerhalb der Forschung ist noch umstritten, ob die Segmentierung ein ursprüngliches Merkmal ist, welches die Gliederfüßer vom gemeinsamen Vorfahren der Bilateria geerbt haben, oder ob es sich um eine evolutive Neuheit handelt; in diesem Fall wäre bei den anderen im Grundbauplan segmentierten Tierstämmen (vor allem den Ringelwürmern und den Chordatieren) die Segmentierung konvergent entstanden.
An jedem Segment kann ein Paar ebenfalls in Abschnitte gegliederter Gliedmaßen (Beine, Mundwerkzeuge, Antennen) sitzen, welches aber an verschiedenen Segmenten auch fehlen kann. Die entwicklungsgeschichtliche Grundlage von Körpersegmenten und Beinabschnitten ist dabei vergleichbar, die Extremitäten können als sekundäre Körperachsen aufgefasst werden.
Auch das Nervensystem ist segmental angelegt und besteht aus einem auf der Bauchseite verlaufenden Doppelstrang mit einem Ganglion und einer Querverbindung (Kommissur) pro Segment („Strickleiternervensystem“). Typisch ist auch ein rückenseitiges (dorsales) Herz und ein offener Blutkreislauf.
Der ursprüngliche Aufbau eines Segments besteht aus dem Rumpfteil mit einem Ganglion und einem Paar zweiästiger (biramer) Gliedmaßen (Spaltbeine). Der (untere) Innenast wird Beinast oder Schreitbein genannt, der Außenast Kiemenast, womit auch die Funktionen angedeutet sind.
Verschmelzung mehrerer Segmente (Tagmatisierung)

Bei der Diversifizierung der Gliederfüßer im Laufe der Evolution kam es zu Gruppenbildungen oder auch Verschmelzungen von Segmenten. Welche Segmente miteinander zu einem Tagma verschmolzen sind, ist bei unterschiedlichen Gruppen verschieden. Bei allen Gliederfüßern ist es zur Verschmelzung einiger der vorderen Segmente zum Kopf gekommen, der ein aus mehreren Ganglien verwachsenes Gehirn und zu Mundwerkzeugen und Antennen geformte ein- oder zweiästige Gliedmaßen besitzt. Bei den verschiedenen Gruppen der Gliederfüßer ist eine unterschiedliche Anzahl von Segmenten zum Kopf verschmolzen.
Bei urtümlichen Gliederfüßern wie den Remipedia besteht die Gliederung des Körpers hinter dem Kopf zum großen Teil noch aus nahezu identischen Segmenten. Die Trilobiten hatten einen ähnlich repetitiven Körperbau.
Bei den Tausendfüßern sind aus Vorfahren mit relativ wenigen Segmenten (je nach Stammgruppe 12 bis 15) sekundär wieder Tiere mit zahlreichen gleichartigen Segmenten hervorgegangen; bei den Doppelfüßern (Diplopoda) sind jeweils zwei aufeinanderfolgende Segmente miteinander zu einem Doppelsegment verschmolzen, so dass jedes „Segment“ des Rumpfes zwei Beinpaare hat; bei vielen Hundertfüßern folgen jeweils ein breites und ein schmales Segment aufeinander.


Bei den Insekten ist die Tagmatisierung weiter fortgeschritten: Jeweils mehrere Segmente sind zu Kopf, Mittel- und Hinterleib verschmolzen. Die drei so entstehenden Körperabschnitte haben eine sehr unterschiedliche Funktion. Die Gliedmaßen der ursprünglichen Segmente des Kopfes sind zu Antennen und Mundwerkzeugen umgebildet. Im Mittelleib (Thorax) sind drei Segmente zu einem Tagma verwachsen, dessen drei Paar Gliedmaßen den Außenast verloren haben und als Schreitbeine dienen. Solche Gliedmaßen heißen einästig (uniram). Beim Hinterleib können die Gliedmaßen vollständig zurückgebildet sein oder zu besonderen Organen (Kiemen, Begattungsorgane, Legebohrer) umgebildet sein, sie dienen aber nie als Laufbeine der Fortbewegung. Bei Gliederfüßern, die über keine sichtbaren Kiemen verfügen, erfolgt die Atmung entweder über in die Körperoberfläche eingestülpte Kiemen (Lungen) oder über ästig verzweigte Einstülpungen der Körperwand, die Tracheen. Der Hinterleib kann aus unterschiedlich vielen Segmenten ohne Gliedmaßen bestehen. Die Insektenflügel werden traditionell nicht als Gliedmaßen, sondern als umgebildete Seitenplatten der Brustsegmente gedeutet. Neuere genetische und entwicklungsbiologische Erkenntnisse deuten aber darauf hin, dass sie auf den Kiemenast des ursprünglichen Spaltbeins zurückgehen. (In diesem Fall sind die Kiemen wasserlebender Insektenlarven, z. B. der Eintagsfliegen, homologe Bildungen. Aus dem Mesozoikum existieren fossile Insektenlarven, die sich als Übergangsglieder deuten lassen.)

Bei den anderen Unterstämmen ist die Verschmelzung der Segmente in anderen Varianten erfolgt. Spinnen bestehen aus zwei Abschnitten. Der Vorderleib (Prosoma) besteht aus sechs verschmolzenen Segmenten. Eines der Beinpaare wurde zu Mundwerkzeugen, den Cheliceren, umgebildet, eines zu Tastern und vier zu Beinen. Die Gliedmaßen des Hinterleibs (Opisthosoma) haben den Beinast verloren, der Kiemenast liegt als Fächerlunge in Einstülpungen des Hinterleibs; bei manchen Arten wurden diese Fächerlungen in Tracheen umgewandelt. Aus den letzten Beinpaaren sind die Spinnwarzen entstanden. Bei den Weberknechten und Scheinskorpionen sind Vorder- und Hinterkörper zu einem kompakten Körper verschmolzen.
.jpg.webp)
Bei den Pfeilschwanzkrebsen (Xiphosura) sind am Hinterleib noch Beine erhalten (Blattbeine), deren Kiemenäste Fächerkiemen bilden, die den Fächerlungen der Spinnen sehr ähnlich sind.
Bei den Krebstieren ist der Körper meist ebenfalls in Kopf, Thorax und Abdomen gegliedert, der Bauplan ist aber vielfältig abgewandelt. Bei zahlreichen Krebsordnungen sind ein oder zwei ursprüngliche Thoraxsegmente funktionell mit dem Kopf verschmolzen. Der Thorax weist eine sehr unterschiedliche Anzahl von beintragenden Segmenten auf. Ein gliedmaßenloses Abdomen ist je nach Verwandtschaftsgruppe vorhanden oder kann auch fehlen. Bei den Malacostraca ist anstelle des Abdomens ein gliedmaßentragendes Pleon ausgebildet. Am Körperende steht bei ihnen ein aus mehreren Anhängen verschmolzenes Schwanzruder. Viele andere Krebse tragen hier lange Anhänge (meist als Furca bezeichnet). Die Körpergliederung kann bei vielen Krebstieren durch eine Körperduplikatur, den Carapax, verdeckt sein. Diese kann einteilig oder zweischalig gegeneinander beweglich ausgebildet sein; bei einigen Gruppen (Ostracoda, Conchostraca) umhüllt sie den ganzen Körper, der dadurch muschelförmig aussieht. Bei den Malacostraca ist der ursprünglich nur am Kopf ansitzende Carapax mit dem Thorax fest verwachsen und bildet so einen einheitlichen, nicht mehr in sich beweglichen Cephalothorax. Bei einigen festsitzenden (Seepocken, Entenmuscheln), besonders aber bei parasitischen Gruppen kann der Körperbau vollkommen umgestaltet sein, so dass das Tier kaum noch als Gliederfüßer erkennbar ist.
Sinnesorgane
Augen
.png.webp)
Gliederfüßer besitzen am Kopf eine unterschiedliche Anzahl (bis zu neun) Augen mit sehr unterschiedlichem Aufbau und unterschiedlichen Funktionen.[3][4][5] Die Augen aller Gliederfüßer besitzen dabei einen Bauplan, der auf wenige Grundtypen zurückgeführt werden kann, deren teilweise stark abgewandelte Endpunkte durch Reihen miteinander verbunden werden können. Es ist daher anzunehmen, dass die Augen aller Gliederfüßer homologe Bildungen darstellen. Die Augen lassen sich in zwei Typen zusammenfassen, die jeweils durch Innervation, Rezeptor- und Transmittermoleküle gekennzeichnet sind, dies sind die Seitenaugen und die Mittelaugen.

Die nach außen gewölbten Seitenaugen sind Facettenaugen, die aus zahlreichen Einzelaugen bestehen (Komplexaugen). Die Einzelaugen werden Ommatidien genannt. Bei den Insekten und den Krebstieren ist der Bau der Ommatidien sehr einheitlich: Sie bestehen aus einer Netzhaut, die acht lichtempfindliche Sinneszellen enthält, darüber liegt ein durchsichtiger Kristallkegel aus vier sogenannten Semperzellen. Seitlich zu diesem liegen zwei Pigmentzellen, die seitlich einfallendes Licht abschirmen, diese scheiden auch die äußere Cornea ab. Die Cornea ist bei den meisten Gruppen linsenförmig verdickt. Neben diesen beiden sogenannten Hauptpigmentzellen existieren zahlreiche weitere Nebenpigmentzellen. Der Aufbau der Ommatidien kann in anderen Gruppen der Gliederfüßer sekundär abgewandelt oder vereinfacht sein.
Komplexaugen existieren bei den meisten Insekten (sie fehlen den anderen Hexapoda) und zahlreichen Krebstieren. Bei den Cheliceraten sind Komplexaugen nur in einer Gruppe vorhanden, bei den Pfeilschwanzkrebsen. Die einzigen Tausendfüßer, die Komplexaugen besitzen, sind die Spinnenläufer (Scutigeromorpha). Die Ommatidien dieser Gruppen weichen in ihrem Feinaufbau allerdings deutlich von denjenigen der Insekten und Krebstiere ab.[6][7] Beim Pfeilschwanzkrebs Limulus besteht jedes Ommatidium z. B. aus mehr als 300 Zellen.
Bei den Gruppen, bei denen sie vorhanden sind, sind die bildgebenden Komplexaugen in der Regel die wichtigsten Augen.[8][9] Die Sehzellen aller Retinazellen eines Ommatidiums wirken dabei zusammen und bilden einen Bildpunkt. Die Auflösung des Komplexauges richtet sich daher nach der Anzahl der Ommatidien, die von einigen wenigen über einige hundert (z. B. etwa 700 bei der Taufliege oder 1000 beim Pfeilschwanzkrebs) bis zu einem Maximum von 30.000 bei einigen Großlibellen-Arten reicht. Die räumliche Auflösung eines Komplexauges reicht dabei niemals an die hochentwickelten Linsenaugen der Wirbeltiere und der Kopffüßer heran, dafür ist ihre zeitliche Auflösung beim Bewegungssehen deutlich besser.
Neben dem räumlichen Sehen können zahlreiche Gliederfüßer aus allen Linien Farben unterscheiden. Wie beim Menschen geht das Farbsehen bei ihnen auf den Besitz unterschiedlicher Sehpigmente (wie generell im Tierreich Varianten von Opsin) zurück, die bei unterschiedlichen Wellenlängen ansprechen. Ebenfalls analog zum Menschen besitzen die meisten drei solcher Pigmente (trichromatisches Sehen). Im Unterschied zum Menschen ist allerdings die Empfindlichkeit vielfach zum kurzwelligen Teil des Spektrums verschoben. Viele Arten können deshalb kein Rot sehen, dafür einen Anteil im Ultraviolett. Eine weitere Sinnesqualität, die die Gliederfüßer dem Menschen voraus haben, ist das Sehen der Polarisationsebene von polarisiertem Licht. Dies ermöglicht ihnen zum Beispiel, bei bedecktem Himmel den Stand der Sonne zu erkennen, und erleichtert die Entdeckung von Wasserflächen.
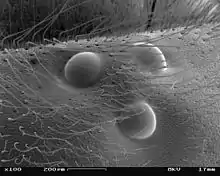
Fast alle Gruppen, die Komplexaugen besitzen, haben daneben noch weitere Augen, die auf die Mittelaugen zurückgehen (Ausnahme: Mittelaugen fehlen bei allen Tausendfüßern). Bei den anderen Arthropoden, bei denen die Augen nicht komplett rückgebildet sind, kommen ebenfalls weitere Augentypen vor. Bei den Insekten sind auf der Stirn in der Regel drei Punktaugen (Ocellen) vorhanden, deren Funktion nicht in allen Fällen geklärt ist, zumindest bei einigen Gruppen dienen sie zur Lageinformation im Flug. Bei den Krebstieren bilden in vielen Gruppen drei Mittelaugen (nur bei den Phyllopoden vier) ein zentrales Sehorgan, das Naupliusauge. Dieses ist das wichtigste Sinnesorgan der Krebslarven, aber auch bei zahlreichen Adulti vorhanden. Bei den Malacostraca sind häufig ein Paar rückenseitige (dorsale) und ein Paar bauchseitige (ventrale) Mittelaugen ausgebildet, bei anderen Gruppen kann eine andere Anzahl vorhanden sein.[10] Bei den echten Spinnen, die niemals Komplexaugen besitzen, existieren nur ein Paar Mittelaugen und meist zwei oder drei Paar Seitenaugen. Die Seitenaugen dienen bei ihnen aber nie zum bildlichen Sehen, sie sind bei den Wolfsspinnen, den Springspinnen und den Krabbenspinnen Bewegungs-Detektoren, bei den übrigen Gruppen dienen sie nur zur räumlichen Navigation nach dem Sonnenstand, häufig durch Erkennung von polarisiertem Licht.[11]

In der artenreichen Gruppe der Gliederfüßer existieren in zahlreichen Gruppen Spezialanpassungen, die jeweils besondere Sinnesleistungen ermöglichen. So haben die Springspinnen vergrößerte Mittelaugen, die ihnen ein Bildsehen nach ähnlichen Prinzipien wie beim Linsenauge der Wirbeltiere ermöglicht. Einige Gruppen (so beim Copepoden Labidocera oder den Larven des Schwimmkäfers Thermonectes) haben Augen mit minimalem Gesichtsfeld und hoher Auflösung entwickelt, mit denen sie mit einer Scanner-Bewegung einem Lesekopf gleich ihre Umgebung abtasten. Besonders verbreitet sind Anpassungen an schwache Lichtverhältnisse. Viele dämmerungsaktive oder in größeren Meerestiefen lebende Arten haben die Komplexaugen so umgebildet, dass von einem größeren Ausschnitt der Umgebung Licht jede Rezeptoreinheit erreichen kann (Superpositions-Auge). Einige vor allem bodenlebende Gruppen haben allerdings Augen vollkommen aufgegeben. Sie sparen dadurch einen erheblichen Energieverbrauch ein, denn neben den Augen selbst dient ein erheblicher Anteil des Gehirns bei allen Arthropoden mit Fähigkeit zum Bildsehen der optischen Auflösung.
Neben den Augen besitzen zahlreiche Gliederfüßer zusätzlich einen Haut- oder Nervenlichtsinn, der vollkommen unabhängig vom Besitz von Augen ist.[12] Dieser kann z. B. zur Feinderkennung durch Schattenwurf dienen (z. B. beim Flusskrebs Procambarus clarkii) oder durch Erkennung der Tageslänge die Gonaden steuern, wie bei einigen Schmetterlingsarten.
Mechanische Sinne


Arthropoden nutzen hauptsächlich zwei unterschiedliche Wege, um mechanische Reize wahrzunehmen, durch Sinneshaare bzw. -borsten und durch Rezeptoren, die die Verformung der Cuticula (des Außenskeletts) registrieren. Diese Organe dienen zur Wahrnehmung der Lage von Körperteilen im Raum (Propriorezeptoren), zur Nahorientierung (Tastsinn) und zur Fernorientierung (Vibrations-, Strömungssinn, Hören). Obwohl zahlreiche Sensoren mehrere dieser Aufgaben parallel erledigen können, existieren teilweise hochspezialisierte Organe für besondere Zwecke.[13][14]
Der Tastsinn der Arthropoden beruht großenteils auf einfachen Sinneshaaren. Daneben haben vor allem die luftlebenden Insekten und Spinnentiere extrem dünne Sinneshaare entwickelt, die als Strömungs- und Vibrationsfühler dienen, diese werden bei Insekten Fadenhaare, bei Spinnentieren Trichobothrien genannt.[15] Im Unterschied zu normalen Haaren sind diese in der Regel in einer ringförmigen Einsenkung der Cuticula eingelenkt. Direkt in der Cuticula sitzen bei allen Gliederfüßern Sensillen, die sowohl Berührungsreize als auch Vibrationen wahrnehmen können. Die Rezeptoren (Scolopidien) können besondere Sinnesorgane ausbilden, wie die Spaltsinnesorgane der Spinnentiere, die bei den echten Spinnen gruppenweise (lyraförmiges Organ) gebündelt sind. Die nur bei den Insekten und Krebstieren nachgewiesenen Chordotonalorgane sind von außen überhaupt nicht sichtbar. Ihre Skolopidien bestehen aus ein bis vier Sinnesneuronen, einer Hüllzelle (Skolopalzelle), mehreren Anheftungszellen und umhüllenden Gliazellen. Ihre Funktionsweise ist im Detail noch nicht geklärt, mit Sicherheit dienen aber modifizierte Cilien der eigentlichen Reizaufnahme.[16] Bei den Insekten kommen zusätzlich sogenannte kuppelförmige (campaniforme) Sensillen vor. Wichtige Tast-, Vibrations- und Strömungssinnesorgane sind bei ihnen die Fühler, zur Wahrnehmung dient ein besonders Organ in der Fühlerbasis, das Johnstonsche Organ.
Schwerkraft
Spinnen und viele Insekten nehmen die Schwerkraft durch Zugkräfte des an den Beinen aufgehängten Körpers wahr, bei Spinnen dienen dazu lyraförmige Organe, manche Insekten nehmen mit den Johnstonschen Organen den Zug der Schwerkraft an den Antennen wahr. In Wasser lebende Krebstiere weisen vielfach dem umgebenden Medium gegenüber kaum Dichteunterschiede auf (sie können im Wasser schweben). Sie haben daher eigene Schwersinnesorgane entwickelt, die Statocysten. Diese bestehen aus einer Kapsel mit zahlreichen nach innen zeigenden Haarsinneszellen. In diese Kapsel werden bei der Häutung von außen einige Sandkörnchen eingefügt, die durch den Druck auf Haare einer Seite die Richtung der Schwerkraft anzeigen. Die Funktionsweise entspricht beinahe völlig dem Schweresinnesorgan der Wirbeltiere. Statocysten sitzen meist in den basalen Antennengliedern, in einigen Gruppen aber auch am Körperende in den Uropoden oder im Telson.
Hören
Wahrnehmung von Schallwellen ist eine Sonderform des Vibrationssinns. Zahlreiche Gliederfüßer können dafür dieselben Haarsensoren nutzen, mit denen sie Luftbewegungen (z. B. durch einen sich nähernden Räuber) oder Erschütterungen wahrnehmen. Bei einigen echten Spinnen ist so eine Schallwahrnehmung mit den Trichobothrien nachgewiesen worden. Bei Stechmücken erkennen die Männchen die Weibchen an dem Schall, der durch die schnelle Vibration der Flügel erzeugt wird (und den auch Menschen hören können).[17] Dazu sind bei ihnen die Antennen stark vergrößert, Hörorgan ist das Johnstonsche Organ. Akustische Kommunikation durch Vibrationen, die mit den Trichobothrien wahrgenommen werden, sind auch bei einem Geißelskorpion nachgewiesen worden und möglicherweise weit verbreitet.[18] Bei den Insekten sind neben diesen eher im Nahbereich arbeitenden Sensoren, die auf direkter Wahrnehmung der Partikelbewegung beruhen, besondere Organe entwickelt worden, die auch auf Druckunterschiede reagieren, d. h. Schallwellen wie die Wirbeltierohren wahrnehmen, diese werden Tympanalorgane genannt. Neben der Wahrnehmung von Feinden dient Schallwahrnehmung bei den auch zur Lauterzeugung fähigen Heuschrecken und Zikaden (und möglicherweise bei Wasserwanzen) der Geschlechterfindung. Parasitische Fliegen haben dies ausgenutzt, indem sie Tympanalorgane entwickelt haben, die die Gesänge von Grillen ebenfalls hören können, die sie so suchen können, um ihre Eier auf ihnen abzulegen.[19] Die meisten Insekten mit Tympanalorganen nutzen diese allerdings nur zu einem einzigen Zweck: um die Ultraschall-Ortungslaute von Fledermäusen zu hören. Diese Fähigkeit hat sich unabhängig voneinander bei sieben Schmetterlingsfamilien, bei Fangschrecken, Florfliegen und zwei Käfergruppen (Sandlaufkäfer und Blatthornkäfer) entwickelt. Die Tympanalorgane sind in jedem Fall abgewandelte Chordotonalorgane, bei denen die Sinneszellen auf Luftsäcken (erweiterten Tracheen) im Körperinnern liegen. Die Lage ist dabei extrem verschieden, im Hinterleib (Zikaden, die meisten Schmetterlinge, Kurzfühlerschrecken, Sandlaufkäfer), im Thorax (Eulenfalter, Fangschrecken), in den Beinen (Langfühlerschrecken), an der Flügelbasis (Schwärmer, Florfliegen), hinter dem Kopf (Fliegen, Blatthornkäfer), an den Mundwerkzeugen (Schwärmer).[20] Während viele Gruppen nur ein schmales Frequenzband im Ultraschall hören können, besitzen einige ein hoch entwickeltes Entfernungs- und Richtungshören.
Erst seit wenigen Jahren ist nachgewiesen, dass auch Krebse (Decapoda) einen Hörsinn besitzen.[21] Diese können niederfrequente Schallwellen von etwa 100 bis 3000 Hertz mit ihren Statocysten wahrnehmen.
Chemische Sinne

Chemische Sinnesorgane zur Nahorientierung (Geschmackssinn) und zur Fernorientierung (Geruchssinn) liegen in Form einer Vielzahl von Sensillen-Typen bei allen Arthropoden vor.[22][23][24] Insbesondere bei allen Gruppen ohne hochentwickelte Augen handelt es sich in der Regel um die wichtigsten Organe zur Nahrungssuche. Außerdem beruht auch die soziale Kommunikation und die Geschlechterfindung bei zahlreichen Arthropoden auf Pheromonen, die über chemische Sinnesorgane wahrgenommen werden. Wichtigste Sinnesorgane zur chemischen Orientierung sind meistens die Antennen, häufig auch die Taster (Palpen) und die äußeren (distalen) Beinglieder. Fehlen Antennen und Taster, kann die Rezeptorausstattung der Beine ähnlich reichhaltig sein, wie z. B. bei den Geißelspinnen.[25] Sehr viele Gliederfüßer haben darüber hinaus chemische Sensoren verstreut auf der gesamten Körperoberfläche. Auf einer Gliederfüßer-Antenne werden regelmäßig ein bis mehrere hunderttausend Chemorezeptoren gefunden.
Die Sensillen vor allem der Antennen werden nach ihrer Morphologie in zwei verschiedene Gruppen eingeteilt, den Haarsensillen und den Grubensensillen, die durch Übergänge verbunden sind (stift- oder kegelförmige Fortsätze, die in einer Grube liegen). Des Weiteren werden ihrer Morphologie entsprechend verschiedene Arten von Haaren, nämlich kuppelförmige (campaniformia), flaschenförmige (ampullacea), kegelförmige (basiconia) und etliche andere Typen unterschieden. Zwar steht die Form der Rezeptoren in Beziehung zur Funktion, allerdings zeigt es sich, dass gleich geformte Sinnesorgane bei verschiedenen Tiergruppen unterschiedliche Funktion besitzen. Typisch für alle Typen von Chemorezeptoren ist es, dass ihre Oberfläche von Poren (im Mikro- bis Nanometerbereich) bedeckt ist. Durch diese Poren steht der hohle Innenraum (Lumen) der Sensille mit der Außenwelt in Kontakt. Hereindiffundierende Moleküle werden von spezialisierten Nervenzellen, die die eigentlichen Sinneszellen darstellen, registriert. Sehr häufig kann ein einzelnes Sinneshaar dabei verschiedene Sinneseindrücke verarbeiten, z. B. als kombinierter Chemo- und Mechanorezeptor, selten sogar drei (trimodal). Auf einer Antenne sind üblicherweise fünf bis zehn unterschiedliche Sensillentypen morphologisch unterscheidbar.
Dem Nahrungserwerb dienende Sensillen besitzen typischerweise ein relativ breites, aber zwischen verschiedenen Zellen recht differenziertes Sinnesspektrum für eine Vielzahl löslicher oder flüchtiger Substanzen wie Aminosäuren, Peptide, Zucker, Nukleotide oder Amine. Aus dem Erregungsmuster verschiedener Sensoren kann dann die entsprechende Substanz ermittelt werden (ähnlich wie der Geschmackssinn beim Menschen).[26] Daneben existieren vor allem für Botenstoffe (Pheromone) hochspezialisierte Sensoren, die nur diesen einzigen Stoff wahrnehmen.
Kohlendioxid-Sensoren
Eine Reihe von Arthropodenarten, darunter Schmetterlinge, Mücken, Landasseln, Tausendfüßer und Zecken besitzen spezielle Sensoren, die spezifisch auf Kohlendioxid ansprechen.[27][28] Meist handelt es sich um Sensillen auf der Antenne (häufig flaschenförmige Sensillen), aber auch spezielle Sinnesorgane auf der Kopfoberfläche sind hierfür entwickelt worden, z. B. von Tausendfüßern. Der biologische Zweck dieser Sinnesleistung besteht z. B. in der Wirtsfindung bei blutsaugenden Arten oder in Vermeidungsreaktionen gegen Ersticken bei bodenlebenden Arten, die in engen Hohlräumen leben.
Feuchte- und Temperatursensoren
Obwohl es sich dabei streng genommen nicht um chemische Sinne handelt, werden sie von Gliederfüßern von ähnlich aufgebauten Sensillen wahrgenommen. Häufig dienen kegelförmige Sensillen zur Abdeckung beider Eigenschaften, oft sogar kombiniert miteinander. Berühmt geworden sind die spezialisierten Infrarot-Strahlungsdetektoren des „Feuerkäfers“ Melanophila. Diese Tiere können bis in 12 Kilometer Entfernung Waldbrände feststellen, die sie gezielt anfliegen, um ihre Eier in das verkohlte Holz abzulegen.
Magnetischer und elektrischer Sinn
Wahrnehmung des Erdmagnetfelds ist im Tierreich weit verbreitet und auch bei vielen Gliederfüßern nachgewiesen. Zur Wahrnehmung dienen intrazelluläre Eisenoxid-Partikel, wie sie beispielsweise bei sozialen Insekten[29] und Krebsen[30] nachgewiesen worden sind. Der magnetische Sinn dient wohl in allen Fällen zur großräumigen Orientierung im Raum.
Während man früher dachte, ein Sinn für elektrische Felder würde bei Arthropoden fehlen, ist es inzwischen gelungen, einen solchen bei Krebsen doch nachzuweisen.[31] Dieser ist in seiner Sensitivität allerdings eine Größenordnung schlechter als die hochentwickelten elektrischen Sinnesorgane vieler Fischarten. Wofür die Krebse den Sinn nutzen, ist noch nicht geklärt, möglich wäre eine Beteiligung an der räumlichen Orientierung oder bei der Wahrnehmung von Beuteorganismen.
Fortpflanzung
Geschlechtsdimorphismus


Während einerseits bei vielen Arten der Arthropoden Männchen und Weibchen nur anhand ihrer Geschlechtsorganen unterscheidbar sind, unterschieden sich andererseits die Geschlechter bei diversen Arten auch äußerlich erheblich.
Ein Beispiel für deutliche Farbunterschiede zwischen den Geschlechtern findet sich bei der Großen Goldschrecke (Chrysochraon dispar) aus der Ordnung der Kurzfühlerschrecken. Ein weiteres Beispiel für deutlich ausgeprägten Geschlechtsdimorphismus ist der Hirschkäfer (Lucanus cervus) aus der Ordnung der Käfer. Hier haben die Männchen deutlich vergrößerte, geweihähnliche Mandibeln, mit denen sie gegeneinander um die weniger auffälligen Weibchen kämpfen.
Bei manchen Arten gibt es Zwergmännchen, die erheblich kleiner sind als ihre Weibchen, so beispielsweise beim Schwan (Euproctis similis) aus der Ordnung der Schmetterlinge oder bei der Wespenspinne (Argiope bruennichi) aus der Ordnung der Webspinnen.
Es gibt bei den Insekten viele Fälle, in denen die Männchen im Gegensatz zu den Weibchen geflügelt sind, beispielsweise bei der Gemeinen Küchenschabe (Blatta orientalis) aus der Ordnung der Schaben oder dem Schlehen-Bürstenspinner (Orgyia antiqua), einem Schmetterling. Im Extremfall ist das Weibchen larvenähnlich und ziemlich groß, während das Männchen flugfähig ist, voll, entwickelt und erheblich besser ausgebildete Sinnesorgane hat. Ein Beispiel hierfür ist der Kleine Mottenspinner (Heterogynis penella), ebenfalls aus der Ordnung der Schmetterlinge.
Lockstoffe, Lockstrategien

Bei den Arthropoden haben sich verschiedene Wege entwickelt, den jeweiligen Geschlechtspartner anzulocken.
Bei vielen Schmetterlingen haben die Weibchen einfache fadenförmige Fühler, während die männlichen Tiere gekämmte Fühler haben, da sie die größere Oberfläche nutzen, um den Sexuallockstoff des Weibchens auf möglichst große Entfernung wahrnehmen zu können.

Andere Arten nutzen optische Signale: So winken die männlichen Winkerkrabben mit ihrer vergrößerten Schere, Leuchtkäfer locken ihre Männchen durch einen arttypischen Blinkrhythmus an.
Auch Geräusche werden genutzt: Wolfsspinnen balzen mit Klopfzeichen. Riesenkrabbenspinnen locken die Weibchen an, indem sie die Oberfläche, auf der sie sitzen, in Vibration versetzen. Langfühlerschrecken zirpen (Stridulation).
Begattung und Befruchtung
Bei den meisten Arthropoden findet eine innere Befruchtung statt. Ausnahmen wie bei Limulus sind selten. Die Spermien sind dabei oft in einer Spermatophore zusammengefasst, die vom Weibchen aufgenommen oder vom Männchen im oder am Weibchen befestigt wird. Bei einigen Arten wurden deshalb Beine zu Gonopoden umgebildet, die der Befruchtung dienen. Die Spermatophoren öffnen sich oft erst lange nach der Begattung, um die Eier zu befruchten.
Bei manchen Insekten passen die Geschlechtsorgane der Männchen nur zu denen der Weibchen derselben Art (Schlüssel-Schloss-Prinzip), so dass eine Befruchtung zwischen verschiedenen äußerlich nicht zu unterscheidenden Arten oft allein deshalb nicht möglich ist. Manchmal fressen die weiblichen Tiere nach der Begattung die Männchen, wie beispielsweise bei der Großen Winkelspinne.
Sonderformen in der Ausbildung der Geschlechter
Parthenogenese ist recht häufig bei Arthropoden. Sie tritt bei einigen Milben (Acari), Krebsen (Crustacea) und bei Insekten auf. Beispiele hierfür sind die Große Sägeschrecke und die Sommergenerationen der Blattläuse, im Herbst treten geflügelte Geschlechtstiere auf.

Zwittertum ist bei den Arthropoda eine seltene Ausnahme. Cyatura carinate (Isopoda) und viele Scherenasseln (Tanaidacea) sind zuerst Weibchen und dann Männchen (protogynes Zwittertum).
Brutfürsorge

Im Bereich der Brutpflege gibt es bei den Gliederfüßern alle Varianten, von der Eiablage in freies Wasser ohne jegliche Fürsorge bis hin zu lebendgebärenden Tieren, wie bei Euscorpius mesotrichus.
Insekten legen ihre Eier oft an die Futterpflanzen. Endoparasiten wie Erzwespen und die Gemeine Eichengallwespe legen sie gleich in den Wirt. Weibliche Höhlenspinnen und Zitterspinnen der Gattung Pholcus umhüllen ihre Eier mit einem Gespinst und tragen den Eikokon mit sich herum. Der weibliche Edelkrebs trägt die Eier am Körper festgeklebt mit sich herum, bis sie schlüpfen. Einige Arten wie beispielsweise die Ohrwürmer bewachen ihre Eier in einer geschützten Höhle, bis sie schlüpfen.

Die Asseln haben ähnlich den Beuteltieren eine Brusttasche, in denen sie ihre Jungen herumtragen, wie bei Kellerassel und Wasserassel beschrieben. Die Fleckige Brutwanze bewacht und beschützt ihre Eier nicht nur, sie führt die Jungtiere später auch wie eine Ente ihre Jungen im Gänsemarsch zum Futter. Einige Arten wie der Gemeine Ohrwurm und die Kugelspinnen sowie die meisten staatenbildenden Insekten gehen noch weiter mit der Brutpflege und füttern ihre Jungen.
Entwicklung
In Arthropodeneiern beginnt die Embryonalentwicklung mit einer totalen Furchung bei dotterarmen und oberflächlichen Furchung an verschiedenen Stellen der Oberfläche bei dotterreichen Eizellen. Bei oberflächlicher Furchung entsteht eine kugelförmige einzellige Schicht um den Dotter herum, häufig mit zahlreichen Zellkernen, aber ohne Zellgrenzen (Syncytium). Als Nächstes wandern die Zellen zu einer Seite des Dotters und bilden dort eine Keimscheibe, aus der der Embryo entsteht.

Nur bei primär wasserlebenden Gruppen schlüpft eine primäre Larve aus dem Ei, dies sind neben den meisten Krebstieren die zu den Chelicerata gehörenden Asselspinnen. Die Krebstiere schlüpfen mit drei Gliedmaßenpaare tragenden Segmenten (diejenigen der ersten und zweiten Antennen und der Mandibeln) als Naupliuslarve, Asselspinnen mit ebenfalls drei Segmenten (Anlagen der Cheliforen, Palpen und Brutbeine) als Protonymphon-Larve. Bei den folgenden Häutungen werden jeweils in einer hinteren Wachstumszone weitere Segmente angefügt. Die Gliedmaßen dieser Segmente werden häufig nur als ungegliederte Knospen angelegt und erhalten erst im Laufe weiterer Häutungen nach und nach funktionsfähige Gestalt. Auch die Gliedmaßen der bereits vorhandenen vorderen Extremitäten werden bei den späteren Häutungen umgestaltet, in manchen Fällen werden sie eingeschmolzen (d. h. sie sind bei den Larven, aber nicht bei adulten Tieren vorhanden). Bei den Krebstieren kann das Tier im Laufe einer langen Entwicklung mit zahlreichen Häutungen so nacheinander mehrere anatomisch und funktional völlig unterschiedliche Larvenformen mit unterschiedlicher Lebensweise durchlaufen. Diese für die Arthropoden ursprüngliche Entwicklung, bei der die Segmentzahl des adulten Tiers nach und nach erreicht wird, wird als Anamorphose (oder Anamerie) bezeichnet. Im ursprünglichsten Fall wird bei jeder Häutung genau ein Segment hinzugefügt. Bei vielen Gliederfüßern mit anamorpher Entwicklung können aber in einem Schritt gleich mehrere Segmente neu entstehen.
Bei zahlreichen Gruppen wird diese ursprüngliche Entwicklung dadurch abgewandelt, dass die frühen Entwicklungsstadien bereits im Ei durchlaufen werden, so dass das erste frei lebende Larvenstadium bereits in seiner Entwicklung fortgeschrittener ist (auch frei lebende Naupliuslarven vieler Krebstiere nehmen keine Nahrung auf). Dass es sich dabei um abgewandelte Formen handelt, kann sich zum Beispiel daran zeigen, dass der Embryo im entsprechenden Stadium eine Kutikula abscheidet. Schließlich ist es in zahlreichen Gruppen unabhängig voneinander dazu gekommen, dass alle Larvenstadien im Embryo durchlaufen werden, oder die Entwicklung wurde vollkommen abgewandelt, so dass keine Spur dieser Stadien übrigblieb. In diesen Fällen schlüpft aus dem Ei ein Jungtier, das in seiner Gestalt bereits dem Adultus weitgehend entspricht. Dieser Fall ist bei landlebenden Arthropoden die Regel, da dem Nauplius oder Protonymphon entsprechende Stadien hier nicht lebensfähig wären, dies gilt z. B. auch für die zu den Krebstieren gehörenden Landasseln. Besitzt die erste frei lebende Larve bereits alle Segmente des adulten Tiers, spricht man von Telomorphose (oder Telomerie). Die Entwicklung ohne (primäre) Larvenstadium wird direkte Entwicklung genannt. Larven, die dem adulten Tier in seiner Organisation weitgehend entsprechen, zeigen zum Beispiel auch die primär marinen Pfeilschwanzkrebse, die zu den Chelicerata gehören. Direkte Entwicklung ist typisch z. B. für alle echten Spinnen und die ursprünglicheren hemimetabolen Insekten. Bei den Tausendfüßern und bei den zu den Sechsfüßern gehörenden Beintastlern (Protura) entspricht das geschlüpfte Tier in Gestalt und Lebensweise weitgehend dem Adultus, es werden aber bei späteren Häutungen noch weitere Segmente gebildet.
Eine vollkommen abgewandelte Entwicklung zeichnet die holometabolen Insekten aus. Bei ihnen ist es sekundär wieder zur Ausbildung einer Larve gekommen, die eine vollkommen andere Gestalt und Lebensweise als die Imago aufweist. Die Herkunft dieser Larvenstadien ist nicht vollkommen geklärt, möglicherweise geht sie auf ein als Prolarve bezeichnetes Stadium zurück, das bei vielen hemimetabolen Insekten zwischen den Embryo und das eigentliche erste Larvenstadium eingeschoben ist. Das Gewebe der holometabolen Larve wird in einem Ruhestadium, der Puppe, weitgehend aufgelöst und die Imago aus knospenartigen Anlagen (den Imaginalscheiben) völlig neu gebildet.
Mit nur wenigen Segmenten (Anamorphose) schlüpfen
- die Schwertschwänze (Xiphosura) und Asselspinnen (Pycnogonida) unter den Kieferklauenträgern (Chelicerata)
- die meisten Tausendfüßer (Myriapoda) (außer epimorphe Chilopoda)
- die Protura unter den Sechsfüßern (Hexapoda)
aus und erlangen ihre endgültige Segmentzahl erst nach dem Schlüpfen.

Mit der vollen Segmentzahl (Telomorphose) verlassen das Ei
- die allermeisten Kieferklauenträger (Chelicerata)
- Insekten (Insecta), Doppelschwänze (Diplura) und Springschwänze (Collembola) unter den Sechsfüßern
- die Riesenläufer (Scolopendromorpha) und Erdläufer (Geophilomorpha) unter den Hundertfüßern (Chilopoda)
Bei den Insekten kommen alle Übergänge vor zwischen Formen, die bereits im Embryo alle oder fast alle Segmente gleichzeitig anlegen („Langkeim“), und solchen, bei denen die Anamorphose bei der Embryonalentwicklung im Ei beibehalten worden ist („Kurzkeim“).
Körpergröße
Die meisten Gliederfüßer sind kleine Tiere. Obwohl sie sich im Größenspektrum mit den Wirbeltieren überschneiden, sind sie weit überwiegend deutlich kleiner als diese. Wodurch die Körpergröße der sonst so vielgestaltigen und erfolgreichen Arthropoden nach oben begrenzt wird, ist eine alte Streitfrage. Eine Theorie geht davon aus, dass sich die wesentliche Begrenzung aus dem Außenskelett ergibt. Zwar ist ein auf Außenskelett beruhender Körperbau prinzipiell wohl zu beinahe jeder Größe imstande, zumal tiefe Einsenkungen (Apodeme genannt) als Muskelansatzstellen ins Innere verlagert sind. Achillesferse des Außenskeletts ist aber die Häutungsphase. Vor allem landlebende Riesen-Arthropoden würden während der Häutung unter ihrem eigenen Körpergewicht buchstäblich zerfließen. Eine weitere Theorie sieht im offenen Blutkreislauf und dem gegenüber den Wirbeltieren weniger leistungsfähigen Atmungssystem die wesentliche Begrenzung. Ein Argument für diese Ansicht ist, dass Rieseninsekten mit gegenüber rezenten Formen deutlich vergrößertem Körper in Perioden des Paläozoikums auftraten, in denen der Sauerstoff-Partialdruck der Atmosphäre gegenüber heute deutlich höher war.[32] Landlebende Gliederfüßer atmen über luftgefüllte Röhren (Tracheen), während das Blut für den Sauerstofftransport zwar nicht bedeutungslos, aber viel weniger wichtig als bei den Wirbeltieren ist. Entgegen mancher Ansicht ist der Lufttransport in den Tracheen auch nicht rein passiv, sondern die Tiere können sie gezielt zusammenpressen und damit die Atmung deutlich beschleunigen.[33][34] Dennoch ist vermutlich bei steigender Körpergröße ein überproportionales Ansteigen des Tracheen-Durchmessers erforderlich, der Effekt wird besonders in den Beinen deutlich.[35] Demzufolge ist irgendwann nicht mehr genügend Platz für andere lebenswichtige Organe. Gleichzeitig lässt der offene Blutkreislauf keinen wesentlichen Blutdruckanstieg zu, so dass der Sauerstofftransport über das Blut nur schwer optimiert werden kann. Eine dritte Theorie nimmt an, dass wegen der nicht von Schwannschen Zellen umhüllten, nackten Nervenfasern der Gliederfüßer bei höherer Körpergröße die Reaktionsgeschwindigkeit zu gering ist. Allerdings sind Myelinhüllen auch bei Krebstieren nachgewiesen worden.[36] Außerdem besitzen Gliederfüßer Riesenfasern, die für lebenswichtige Bewegungen (z. B. Fluchtreflexe) genauso hohe Übertragungsgeschwindigkeiten wie bei Wirbeltiernerven erreichen können. Möglicherweise ist es einfach so, dass durch das Vorhandensein der Wirbeltiere eine Vergrößerung keine ökologischen Vorteile mehr bietet, weil der zur Verfügung stehende Nischenraum bereits gefüllt ist. Eine Vergrößerung des Körpers bietet dabei durchaus nicht nur Vorteile. Erhebliche Nachteile sind z. B. Verlängerung der Entwicklungszeit (und damit längere Generationsdauer), höherer Nahrungsbedarf durch erhöhten Metabolismus und damit erhöhten Ruhestoffwechsel, erhöhtes Risiko, Prädatoren zum Opfer zu fallen. Ob es so etwas wie eine für den jeweiligen Bauplan optimale Körpergröße gibt und wo diese ggf. für die Gliederfüßer liegen würde, ist eine offene Streitfrage innerhalb der Wissenschaft.[37] Es fällt aber auf, dass es mehr mittelgroße Gliederfüßer mit Körpergrößen im Zentimeterbereich gibt als sehr große und sehr kleine.
Der größte bekannte lebende Arthropode ist eine im Meer lebende Krabbe, die Japanische Riesenkrabbe. Der Palmendieb (Birgus latro) ist mit einer Körperlänge von bis zu 40 cm und einer Masse von bis zu 4 kg der größte landlebende Vertreter der Arthropoden. Besonders kleine Gliederfüßer (um 0,1 Millimeter) gibt es u. a. innerhalb der Milben, der Springschwänze und der Ruderfußkrebse. Die kleinsten Insekten (parasitische Hautflügler) sind mit 0,15 mm kaum größer. Bei diesen Zwergformen sind viele Organsysteme reduziert. Auch die Segmentierung des Körpers und der Beine wird meist undeutlich.
Lebensweisen
Gliederfüßer bewohnen nahezu alle bekannten Lebensräume und besetzen dort die unterschiedlichsten ökologischen Nischen. Arthropoden können deshalb als die erfolgreichste Tierordnung der Erde gelten.
Wasser und Land

Die ursprünglichen Arthropoden lebten wie die Trilobiten im Meer. Von den heute lebenden (rezenten) Gruppen besitzen die Krebstiere die meisten marinen Vertreter. Bei den Cheliceraten sind die Asselspinnen und die Pfeilschwanzkrebse alle marin, aus den anderen Gruppen nahezu keine Art (Ausnahme: wenige marine Milben[38]). Weder Tausendfüßer noch Sechsfüßer haben echte marine Vertreter hervorgebracht, einige wenige Insektenarten wie die Zuckmücke Clunio sind nur bis ins Gezeitenwatt vorgedrungen.
Im Süßwasser leben ebenfalls zahlreiche Krebstiere, wobei es Gruppen gibt, die im Süßwasser weitaus artenreicher als im Meer sind, wie z. B. die Kiemenfußkrebse. Unter den Kieferklauenträgern sind die Milben mit den Süßwassermilben sekundär ins Süßwasser vorgedrungen, d. h. ihre Vorfahren waren landlebend. Auch die zahlreichen im Süßwasser lebenden Insektenarten gehen auf landlebende Vorfahren zurück. Dies zeigt sich z. B. daran, dass sie zur Atmung ein Tracheensystem besitzen, während die primär wasserlebenden Krebse mit Kiemen atmen. Viele wasserlebende Insektenlarven wie die Larven der Eintagsfliegen oder der Kleinlibellen haben sekundär wieder Kiemen entwickelt, die aber von (luftgefüllten) Tracheen durchzogen sind. Viele Insektenlarven nehmen Sauerstoff nur durch die Haut auf, einige besitzen zur Vergrößerung der Oberfläche mit Hämolymphe gefüllte einfache Schlauchkiemen.
Viele im Süßwasser lebende Gliederfüßer sind tatsächlich luftatmend. Sie besitzen dann ein Tracheensystem mit offenen Stigmen. Manche können mit schnorchelartigen Atemrohren an der Wasseroberfläche „Luft tanken“ wie die Larve der Mistbiene. Andere leben in einer Luftblase wie die Wasserspinne oder halten eine Lufthülle an der Körperoberfläche fest wie der Gelbrandkäfer.
Landlebend sind die allermeisten Insekten, beinahe alle Spinnentiere und alle Tausendfüßer. Von den Krebsen sind einige Entwicklungslinien unabhängig voneinander sekundär zum Landleben übergegangen. Am besten an das Landleben angepasst sind dabei die Landasseln, während landlebende Zehnfußkrebse (wie die Landeinsiedlerkrebse und Landkrabben) und Flohkrebse zumindest zur Fortpflanzung ins Wasser zurückkehren müssen.

Fortbewegung

Die Arthropoden sind neben den Wirbeltieren die einzige Gruppe des Tierreichs, die Organismen hervorgebracht hat, die auf Beinen laufen (d. h. sich nicht nur vorwärts stemmen). Die Funktionsweise des Arthropodenbeins ist dabei bei wasser- und landlebenden Formen genau entsprechend, es ist z. B. nicht möglich, anhand der Laufbeine zu entscheiden, ob eine fossil erhaltene Art wasser- oder landlebend war. Nur wenige Gruppen haben sekundär die Beine wieder aufgegeben, weit überwiegend parasitische Formen. Bei vielen Krebstieren besitzen die Extremitäten gleichzeitig zwei Funktionen: Sie dienen sowohl der Fortbewegung wie dem Nahrungserwerb. Bei anatomisch stärker abgeleiteten, moderneren Formen sind diese Funktionen meist getrennt, d. h. verschiedene Extremitäten sind auf die eine oder die andere Funktion spezialisiert. Die meisten wasserlebenden Entwicklungslinien haben schwimmende Formen hervorgebracht. Schwimmorgane sind in der Regel umgebildete und spezialisierte Extremitäten. Einige Entwicklungslinien der Krebstiere haben konvergent Blattbeine entwickelt, die nicht mehr zum Laufen geeignet sind. Zum Zooplankton gehörende Formen (neben Krebstieren einige Milben und Insektenlarven) sind Dauerschwimmer. Von extrem hoher Bedeutung für die Radiation der Insekten war die Entwicklung von Flügeln. Der Erwerb der Flugfähigkeit war vermutlich das Schlüsselmerkmal, das die Fluginsekten zur weitaus artenreichsten Organismengruppe des gesamten Planeten machte. Im Gegensatz zu Dauerschwimmern gibt es dabei keine Dauerflieger. Allerdings können z. B. viele Libellenarten mit ihren Beinen nicht laufen, sie dienen bei ihnen ausschließlich zum Festhalten und zum Nahrungserwerb. Häufig nicht beachtet wird, dass auch die Webspinnen in gewisser Weise eine Flugfähigkeit entwickelt haben. Der Flug vor allem von Jungspinnen an einem selbst abgegebenen Faden Spinnenseide („ballooning“) ermöglicht ihnen eine rasche Ausbreitung in alle geeigneten Lebensräume. Einige Entwicklungslinien haben besondere Arten der Fortbewegung entwickelt. Viele Arten wie Springspinnen, Flöhe und Springschwänze können sehr gut springen. Selten sind Formen, die wie Schnecken kriechen, wie etwa die Larven der Schneckenspinner.
Räuber
_2.jpg.webp)
Viele Krebse, die meisten Spinnen und diverse Insekten leben räuberisch.
Parasitismus bei Tieren
Viele Arten saugen Blut, wie die Hirschlausfliege bei Hirschen, die Rote Vogelmilbe bei Vögeln, Fischläuse bei Fischen oder die Varroamilbe bei der Westlichen Honigbiene. Die Larve der Roten Samtmilbe saugt sich ähnlich wie der Holzbock (Ixodes ricinus) beim Menschen an Insekten fest.
Milbenbefall des Ohrs führt zu Ohrräude. Haarbalgmilben leben im Haarbalg von Säugetieren und Federmilben auf den Federn der Vögel. Viele dieser Arten sind für den Wirt unschädlich, andere rufen die Räude hervor.
Dasselfliegen leben im Magen, Nasen- und Rachenraum und/oder der Lunge von Säugetieren.
Schlupfwespen sind innere Parasiten, die zum Tod des Opfers führen, deshalb nennt man sie Parasitoide.
Ernährung durch Pflanzen
Diverse Arten wie Spinnmilben und Blattläuse saugen an Pflanzen.
Viele Schmetterlinge, die Honigbienen und diverse andere Tiere leben vom Nektar der Blütenpflanzen.
Larven von Schmetterlingen und Käfern fressen die Blätter von Pflanzen. Gallwespen legen ihre Eier in das Innere der Pflanzen.
Eindringlinge in Insektenstaaten

Staatenbildende Insekten haben eine komplexe geruchliche Kommunikation, was einige Arten ausnutzen, um ungefährdet in die Staaten anderer Insekten eindringen zu können.
Der Totenkopfschwärmer ernährt sich von Honig direkt aus den Bienenwaben – von den Bienen wird er vermutlich wegen einer geruchlichen Tarnkappe nicht angegriffen.
Die Schlupfwespenart Ichneumon eumerus ist ein Hyperparasit: Sie parasitiert den Kreuzenzian-Ameisenbläuling (Maculinea rebeli), der selber bei Ameisen parasitiert.
Pilzzucht und Haustierhaltung bei Ameisen
Manche Ameisen züchten Pilze wie die Blattschneiderameisen oder halten Blattläuse als Haustiere wie die Rote Waldameise (Formica rufa) oder die Schwarze Wegameise (Lasius niger). Zu den Bläulingen haben Ameisen sehr unterschiedliche und interessante Beziehungen, die von Symbiose bis zu Parasitismus reichen können.
Systematik
Äußere Systematik
Die Systematik der Arthropoden beruht traditionell vor allem auf dem äußeren Körperbau mit der Abfolge der Segmente und Gliedmaßen. Seit Ende der 1990er Jahre werden verstärkt Merkmale des Nervensystems, molekulare Stammbäume und entwicklungsgenetische Merkmale in die Betrachtung einbezogen, daneben weitere Merkmale wie z. B. der Feinbau der Spermien. Zahlreiche sehr gut abgesichert geglaubte Gruppierungen des traditionellen Systems mussten daraufhin modifiziert oder aufgegeben werden. Wichtigstes Resultat der „neuen“ Systematik ist die Zweiteilung der Protostomia in zwei Großgruppen Ecdysozoa und Lophotrochozoa. Wenn dieses inzwischen auf verschiedenen Wegen gut abgesicherte Modell zutrifft, können die Ringelwürmer (Annelida) nicht die Schwestergruppe der (Pan-)Arthropoden sein. Diese Gruppierung (Gliedertiere oder Articulata) galt vorher als bestens abgesichert. Neuere Resultate deuten darauf hin, dass sowohl die Bildungsweise der Kopfsegmente[39] wie auch die Entwicklung der Körperanhänge (Beine bzw. Parapodien) in beiden Gruppen sehr ähnlich gesteuert wird. Da eine konvergente Bildung dieser komplizierten Abfolge nicht sehr wahrscheinlich erscheint, wäre es möglich, dass bereits der gemeinsame Vorfahre der Ecdysozoa und Lophotrochozoa („Ur-Protostomier“) oder sogar dessen gemeinsamer Vorfahre mit den Deuterostomia („Ur-Bilaterier“) segmentiert war. Problematisch an dieser Annahme ist es allerdings, dass dann in den zahlreichen nicht-segmentierten Tierstämmen die Segmentierung viele Male unabhängig voneinander sekundär aufgegeben worden sein müsste. Die heutigen Erkenntnisse der Forschung sind für eine Beantwortung dieser Frage nicht ausreichend.
Innerhalb der Ecdysozoa ist die Schwestergruppe der Panarthropoda ein Taxon aus wurmartigen Tieren mit fester, periodisch gehäuteter Körperhülle und einem „Gehirn“, das ringförmig den Verdauungstrakt umgibt, nach diesem Merkmal Cycloneuralia benannt. Eine weitere Gemeinsamkeit ist ein in fast allen Gruppen ausstülpbarer Mundabschnitt. Ungeklärt ist das Verhältnis zwischen den drei Gruppen, die gemeinsam die Panarthropoda ausmachen: Bärtierchen, Stummelfüßer, Gliederfüßer. Obwohl inzwischen die meisten Taxonomen ein Schwestergruppenverhältnis der Gliederfüßer und der Stummelfüßer für wahrscheinlicher halten,[40] hat auch die Gruppierung der Gliederfüßer mit den Bärtierchen weiter zahlreiche Anhänger. Die (traditionelle) Zusammenfassung der Bärtierchen und Stummelfüßer als gemeinsame Schwestergruppe wird weniger oft genannt, ist aber ebenfalls nicht auszuschließen.
Innere Systematik
Den neueren Untersuchungen zufolge gliedern sich die Gliedertiere in folgende monophyletische Gruppen:
- Chelicerata (Kieferklauenträger). Etwas problematisch ist die Position der marinen Asselspinnen (Pycnogonida oder Pantopoda), die in einigen Untersuchungen als basale Gruppe allen anderen Arthropoden gegenübergestellt worden waren. Die dafür vorgebrachten Argumente sind aber inzwischen größtenteils widerlegt.
- Myriapoda (Tausendfüßer).
- Tetraconata (auch Pancrustacea genannt). Diese umfassen die Krebstiere und die Hexapoda (Insekten und Sackkiefler).
Die Gruppierung der Sechsfüßer mit den Krebstieren ist inzwischen durch zahlreiche voneinander unabhängige molekulare Stammbäume recht gut abgesichert und wird auch durch die Anatomie des Nervensystems und des Auges gestützt. Obwohl auch etliche Studien die Monophylie der Krebstiere unterstützen, erscheint es nun am wahrscheinlichsten, dass diese in Bezug auf die Sechsfüßer paraphyletisch sind, das bedeutet, die Sechsfüßer sind mit einigen Krebsordnungen näher verwandt als diese untereinander. Die Sechsfüßer wären danach so etwas wie eine zum Landleben übergegangene Linie der Krebstiere. Welche Krebstiere Schwestergruppe der Sechsfüßer sein könnten (d. h. unter den Krebstieren am nächsten mit ihnen verwandt), ist noch nicht geklärt. Mögliche Kandidaten sind die „höheren“ Krebse (Malacostraca), die Kiemenfußkrebse (Branchiopoda) bzw. die urtümlichen Remipedia[41] und Cephalocarida. Die früher favorisierte Zusammenfassung der Sechsfüßer mit den Tausendfüßern („Atelocerata“ oder „Tracheata“) erscheint inzwischen kaum noch plausibel. Die wichtigsten Gemeinsamkeiten beider Gruppen sind vermutlich durch die beiden gemeinsame landlebende Lebensweise entstandene Konvergenzen. Das wichtige anatomische Argument, der in beiden Gruppen ähnliche Aufbau des Kopfes mit Beißmandibeln und Rückbildung der zweiten Antennen, ist allein nur eine schwache Begründung. Zwischenzeitlich aufgekommene Vermutungen, die Collembola (Springschwänze) könnten unabhängig von den anderen Hexapoda von Krebstieren abstammen, wodurch auch die Hexapoda gegenüber den Crustacea paraphyletisch wären, haben sich nicht bestätigt.
Noch umstritten ist die Stellung der Tausendfüßer. Aufgrund von morphologischen Befunden wurde eine Zusammenfassung mit den Tetraconata zu einer Mandibulata genannten Gruppe für gut abgesichert gehalten. Völlig überraschenderweise ergaben einige molekulare Stammbäume einen engeren Zusammenhang mit den Chelicerata;[42] die resultierende Gruppe, für die es zunächst überhaupt kein morphologisches Argument gab, wurde deshalb „Paradoxopoda“ genannt (auch: Myriochelata). Neuere molekulare Stammbäume auf verbesserter Datengrundlage stützen wieder überwiegend die Mandibulata-Hypothese, die Befunde sind aber keinesfalls eindeutig. Zusätzlich wurde (aufgrund der embryonalen Entwicklung des Nervensystems) auch ein morphologisches Argument für die Paradoxopoda vorgebracht,[43] während andere neuroanatomische Studien die Mandibulata stützen.[44] Obwohl die Sachlage damit keinesfalls als geklärt gelten kann, stützen neuere Daten überwiegend die Mandibulata. Inzwischen wurde vermutet, dass die auf Basis der ribosomalen RNA aufgestellten Stammbäume – die die wesentliche Grundlage für die Paradoxopoda-Hypothese bildeten – nicht geeignet sind, das Problem zu lösen.[45]
Weitere Hypothesen sind nur noch von historischem Interesse, z. B. die Zusammenfassung aller Gruppen mit einästigen Beinen (d. h. ohne Spaltbein) als „Uniramia“ oder die (vor allem bei Paläontologen beliebte) Vereinigung der Crustacea mit den Chelicerata („Schizoramia“).
Damit ergibt sich folgende Hypothese über die Verwandtschaftsverhältnisse (ohne fossile Gruppen):[46][47][48][49][50]
| Gliederfüßer (Arthropoda) |
| ||||||||||||||||||
Evolution der Gliederfüßer
Fossilien von Stammgruppenvertretern der Gliederfüßer sind seit dem frühesten Kambrium nachgewiesen. Ihre tatsächliche Entstehung fällt daher mit hoher Wahrscheinlichkeit ins ausgehende Präkambrium (Ediacarium), wenn auch aus dieser Zeit noch keine überzeugenden Fossilien vorliegen. Da auch die frühesten Fossilien von Spuren ins älteste Kambrium fallen, ist eine wesentlich frühere Entstehung des Stamms unwahrscheinlich. Im frühkambrischen Maotianshan-Schiefer aus China oder im mittelkambrischen Burgess-Schiefer aus Kanada sind Arthropoden bereits formenreich und differenziert mit zahlreichen Arten und Individuen vertreten.
Stammgruppe der Panarthropoden sind mit hoher Wahrscheinlichkeit die Lobopoden (oder auch Tardypolypoden), eine im Ordovizium ausgestorbene Gruppe fossiler „Würmer mit Beinen“, die in ihrem Organisationsniveau (nicht unbedingt in ihrer tatsächlichen Abstammung) an die rezenten Onychophora erinnern.[51][52] Primitive Formen wie Aysheaia zeigen einen gegliederten Körper mit repetitiven (gleichförmig wiederholten) Strukturen wie den geringelten Beinen, aber ohne erkennbare echte Segmente. An einem ungegliederten Kopf sitzen seitlich zwei längere Anhänge mit steifen Borsten, die vermutlich im Dienst der Nahrungsbeschaffung standen; diese sind die einzigen differenzierten Körperanhänge. Sklerotisierte Platten traten weder am Rumpf noch an den Beinen auf. Inzwischen ist ein ganzer „Zoo“ von teilweise bizarr abgewandelten Lobopoden bekannt, die etwa zeitgleich lebten. Einige von ihnen zeigen sklerotisierte Platten oder Dornen und einen primitiv segmentierten Kopf mit ein oder zwei Paar Anhängen (wie Onychodictyion oder die berühmte Hallucigenia). Eine Art, das „Kaktustier“ Diania cactiformis, wies Extremitäten mit gelenkig verbundenen Skleriten ähnlich dem Bein der Arthropoden auf.[53]

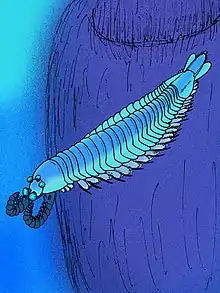
Fossilien, die als Stammgruppenvertreter der echten Arthropoden interpretiert werden wie z. B. Fuxianhuia, Canadaspis oder Shankouia, weisen gegenüber den Lobopoden eine Reihe neuer Merkmale auf.[55][56] Die Lage des Mundes verschiebt sich vom vorderen Körperende etwas bauchwärts (ventral). Am Vorderende sitzt ein von einem dorsalen Sklerit (Tergit) geschützter Kopf aus zwei Segmenten, deren erstes ein Paar gestielter Augen trägt, am zweiten sitzen sklerotisierte, gegliederte Anhänge, die antennen- oder beinähnlich ausgebildet sein können. Der übrige Körper ist in sich recht gleichförmig in Segmente gegliedert, die jeweils durch eine dorsale, stark sklerotisierte Platte (Tergit) geschützt sind. An der Unterseite sitzen stummel- oder blattförmig ausgebildete Beine, die meist nicht oder nur schwach sklerotisiert waren und die das Tier in einer Art schwimmend-laufender Bewegung über den Grund transportieren konnten. Außen an den Beinen sitzende blatt- oder lappenförmige Anhänge dienten vermutlich als Kiemen. Weiter fortgeschrittene Formen weisen einen Kopfschild auf, der neben dem Augen- und dem ersten Extremitätensegment drei weitere Segmente bedeckt, ohne dass deren Extremitäten sonderlich von den übrigen Rumpfgliedmaßen abweichen würden. Dieser fünfsegmentige Kopf wird von vielen Forschern als Grundbauplan der (Eu-)Arthropoden angesehen. Ob entsprechend gebaute Fossilien als Stammgruppenvertreter der Arthropoden oder als bereits fortgeschrittenere Vertreter einer bestimmten Arthropodenlinie wie der Crustacea oder der Chelicerata anzusehen sind, hängt in kritischer Weise von der Interpretation der vorderen Extremitäten und ihrer Segmente ab. Die meisten Forscher sehen in den „großen Anhängen“ zahlreicher Fossilien wie Leanchoilia oder Yohoia (beinartigen, stark beborsteten Mundanhängen, die vermutlich zum Ergreifen von Beutetieren dienten) homologe Bildungen der Cheliceren oder der (ersten) Antennen der lebenden Gliederfüßer. Folgt man dieser Deutung, können die meisten Formen als Stammgruppenvertreter der Chelicerata aufgefasst werden. Einige Forscher homologisieren diese Anhänge allerdings mit den Antennen der Onychophora, die am vordersten Kopfsegment (dem Segment, das den vordersten Gehirnabschnitt, das Protocerebrum, hervorbringt) sitzen, den Antennen oder Cheliceren der Arthropoden also nicht direkt entsprechen; dementsprechend gehören dieselben Fossilien ihrer Ansicht nach in die Stammgruppe aller Arthropoden.[57] Kylinxia war ein fünfäugiges ~5 cm großes garnelenartiges Tier, welches vor 518 Mio. Jahren lebte, mit einigen Unterscheidungsmerkmalen – wie den vorderen Anhängen – den "Missing Link" zwischen Anomalocaris (Radiodonta) und Deuteropoda (echten Gliederfüßern) schließt und damit laut einigen Wissenschaftlern der erste Gliederfüßer sein könnte bzw. deren evolutionären Wurzel zuzuordnen ist.[54][58]
Die Stammgruppe der Krebstiere ist bereits vom unteren Kambrium an (also parallel zu den Lobopoden) fossil überliefert. Besonders aussagekräftig sind körperlich erhaltene, phosphatisierte Fossilien (sogenannte „Orsten“), die allerdings nur mikrometer- bis millimetergroß werden, aber feinste Einzelheiten des Körperbaus erkennen lassen. Stammgruppenvertreter und Vertreter der modernen Krebse (der „Kronengruppe“) sind sich morphologisch sehr ähnlich, unterscheiden sich aber vor allem im Aufbau des Kopfes, der aus unterschiedlich vielen Segmenten bestehen kann. Die Antennenpaare von Arten wie Oelandocaris[59][60] dienten ihrem Aufbau nach wohl ebenso wie die „großen Anhänge“ primär der Nahrungsaufnahme.

Neben den Formen, die zu den modernen Gliederfüßern hinführen, existieren vom Kambrium an zahlreiche weitere Arthropodenlinien, die ohne moderne Nachkommen ausgestorben sind. Die berühmteste dieser Linien sind die Trilobiten. Bevor die reichen kambrischen Fossillagerstätten mit erhaltenen Weichteilen entdeckt worden waren, waren die Trilobiten die einzige fossile Quelle für die frühe Arthropodenentwicklung, weshalb sie die früheren Vorstellungen über die Stammgruppe der Gliederfüßer stark beeinflusst haben. Heute gelten die Trilobiten als bereits stark abgeleitete und morphologisch in vieler Hinsicht fortgeschrittene Sonderformen. Ihre traditionelle Zusammenfassung mit den Cheliceraten in ein Taxon Arachnomorpha wird neuerdings mit guten Argumenten bezweifelt.[61] Eine weitere berühmt gewordene Seitenlinie sind die Anomalocarididen. Anomalocaris zählt zu den berühmtesten Fossilien des Burgess-Schiefers, seine Verwandten waren mit Körpergrößen bis zwei Meter die größten Räuber im kambrischen Meer. Eine weitere Seitenlinie, die Thylacocephala, starben am Ende der Kreidezeit aus, sie sind z. B. in den Plattenkalken von Solnhofen gefunden worden. Kambrische Vorläufer wie Isoxys zählten damals zu den häufigsten frei schwimmenden Gliederfüßern im Meer.[62] Eine weitere Gruppe, die Euthycarcinoidea, sind trotz gut erhaltener Fossilien vollkommen rätselhaft geblieben und wurden mit so ziemlich jeder Verwandtschaftsgruppe der Arthropoden in Verbindung gebracht, ohne dass ihre tatsächliche Verwandtschaft geklärt werden konnte.[63] Wenn die Interpretation in Amerika gefundener kambrischer Spurenfossilien richtig ist, wären sie die ersten landlebenden Arthropoden gewesen.
Fossilien der primär landlebenden Hexapoda und Myriapoda liegen zwar in großer Zahl und teilweise exzellenter Erhaltung vor, sie werfen aber nur wenig Licht auf die Entstehung dieser Klassen. Die ältesten Fossilien beider Gruppen stammen aus der gleichen Lagerstätte, den devonischen Ablagerungen von Rhynie, Schottland. Die hier gefundenen Tiere waren bereits landlebend und besaßen einen im Großen und Ganzen recht modernen Körperbau. Fossilien von Stammgruppenvertretern (z. B. marinen Formen) sind unbekannt, alle entsprechend gedeuteten Fossilien sind entweder fragwürdig oder in ihrer Einordnung sogar widerlegt worden.
Bedeutung für den Menschen
Wirtschaftliche Bedeutung

Die für Menschen vorrangige Rolle von Gliederfüßern liegt wohl in der Landwirtschaft, da sie eine herausragende Rolle bei der Bestäubung von Pflanzen und damit einem Gutteil unserer Nahrungsmittel spielen. Einige Arten werden selbst gegessen, wie beispielsweise der Hummer und die Nordseegarnele, in vielen Kulturen aber auch Insekten (Entomophagie). Die Honigbiene versorgt uns mit Honig. Diverse Gliederfüßer dienen als Nahrung für Speisefische. Andererseits gibt es unter den Gliederfüßern Agrarschädlinge wie die Blattlaus und Vorratsschädlinge wie den Mehlwurm, die sich von unseren Nahrungsmitteln ernähren.
Die Raupen des Seidenspinners produzieren beim Verpuppen Seide, die zur Herstellung von Stoffen verwendet wird. Im Gegensatz dazu fressen die Raupen der Kleidermotte Stoffe aus Wolle.
In der Forstwirtschaft treten Gliederfüßer als wichtige Holzschädlinge in Erscheinung, aber auch als deren Feinde und deshalb als Nützlinge. Holzschädlinge betreffen auch den Haus- und Möbelbau.
Giftbisse
Während Gliederfüßer gewöhnlich nicht groß genug sind, um dem Menschen Verletzungen zuzufügen, die allein durch ihre Größe gefährlich sind, sind doch einige ihrer Stiche und Bisse sehr unangenehm, da die Tiere gleichzeitig Gift in der Wunde hinterlassen, wie das beispielsweise bei Wespen oder Wasserspinnen der Fall ist. Diese sind aber meist nicht ernsthaft gefährlich. Seltener sind Arten, bei denen schon ein einzelner Stich oder Biss tödlich sein kann, wie bei der Schwarzen Witwe (Latrodectrus tredecimguttatus, Sterblichkeit ohne Behandlung 5 %) oder dem Skorpion Leiurus quinquestriatus. Einige Insekten und Spinnen haben Brennhaare zur Abwehr von Fressfeinden, die auch für Menschen unangenehm werden können.
Parasiten und Krankheitsüberträger
Auch als Parasiten des Menschen und Krankheitsüberträger spielen Gliederfüßer eine große Rolle.
Es gibt diverse Gliederfüßer, die beim Menschen Blut saugen, wie die Kopflaus, die Filzlaus, die Bettwanze und der Gemeine Holzbock, auch Zecke genannt (Ixodes ricinus). Einige davon sind gefürchtete Krankheitsüberträger, so überträgt der Rattenfloh die Pest, die Tsetsefliege verbreitet die Schlafkrankheit und die Anophelesmücke die Malaria. Zecken übertragen Erkrankungen wie Borreliose und Frühsommer-Meningoenzephalitis (FSME). Die Krätzmilbe frisst Bohrgänge in die oberste Hautschicht von Säugetier und Mensch und ruft dadurch die Krätze hervor.
Literatur
- Heiko Bellmann: Der neue Kosmos-Insektenführer. Kosmos, Stuttgart 1999, ISBN 3-440-07682-2.
- Heiko Bellmann: Der neue Kosmos-Schmetterlingsführer. Schmetterlinge, Raupen und Futterpflanzen. Franckh-Kosmos, Stuttgart 2003, ISBN 3-440-09330-1.
- Heiko Bellmann: Spinnentiere Europas. Kosmos, Stuttgart 2001, ISBN 3-440-09071-X.
- Klaus Dumpert: Das Sozialleben der Ameisen (= Pareys Studientexte, Band; 18), Parey, Berlin / Hamburg 1994, ISBN 3-489-63636-8.
- R. C. Brusca, G. J. Brusca: Invertebrates. 2. Auflage. Sinauer Associates, 2003, Kap. 19, ISBN 0-87893-097-3, S. 475.
- E. E. Ruppert, R. S. Fox, R. P. Barnes: Invertebrate Zoology – A functional evolutionary approach. Brooks/Cole 2004, Kap. 16, ISBN 0-03-025982-7, S. 517.
- D. T. Anderson: Invertebrate Zoology. 2. Auflage. Oxford Univ. Press, 2001, Kap. 10, ISBN 0-19-551368-1, S. 225.
- J. Moore: An Introduction to the Invertebrates. Cambridge Univ. Press, 2001, Kap. 12, ISBN 0-521-77914-6, S. 174.
- Jens-Wilhelm Janzen: Arthropods in Baltic Amber. Ampyx, Halle (Saale) 2002, ISBN 3-932795-14-8.
- H. Paulus: Euarthropda, Gliederfüßer i. e. S. In: Rieger Westheide (Hrsg.): Spezielle Zoologie. Teil 1: Einzeller und Wirbellose Tiere. Springer Spektrum, Berlin / Heidelberg 2013, ISBN 978-3-642-34695-8.
Wissenschaftliche Literatur
- Erna Aescht, Stephan Weigl, Björn Berning, Fritz Gusenleitner (Hrsg.): Krank durch Arthropoden. (= Denisia, Band 30). Biologiezentrum – Oberösterreichische Landesmuseen, Linz 2010, (Volltexte verfügbar bei ZOBODAT).
- M. Akam: Arthropods: Developmental diversity within a (super) phylum. In: Proceedings of the National Academy of Sciences (USA). 97 (2000), S. 4438.
- P. Ax: Das System der Metazoa II. Ein Lehrbuch der phylogenetischen Systematik. Gustav Fischer Verlag, 1999.
- R. C. Brusca: Unraveling the history of arthropod diversification. In: Annals of the Missouri Botanical Garden. 87 (2000), S. 13.
- C. E. Cook, M. L. Smith, M. J. Telford, A. Bastianello, M. Akam: Hox genes and the phylogeny of the arthropods. In: Current Biology. 11 (2001), S. 759.
- G. D. Edgecombe, G. D. F. Wilson, D. J. Colgan, M. R. Gray, G. Cassis: Arthropod cladistics: Combined analysis of histone H3 and U2 snRNA sequences and morphology. In: Cladistics. 16 (2000), S. 155.
- G. Giribet, G. D. Edgecombe, W. C. Wheeler: Arthropod phylogeny based on eight molecular loci and morphology. In: Nature. 413 (2001), S. 157.
- U. W. M. Hwang, M. Friedrich, D. Tautz, C. J. Park, W. Kim: Mitochondrial protein phylogeny joins myriapods with chelicerates. In: Nature. 413 (2001), S. 154.
- Jan Zrzavý, Pavel Štys: The basic body plan of arthropods: Insights from evolutionary morphology and developmental biology. In: Journal of Evolutionary Biology. 10 (1997), S. 353.
- Hans Ekkehard Gruner (Hrsg.), M. Moritz, W. Dunger: Lehrbuch der speziellen Zoologie. Band I: Wirbellose Tiere. 4. Teil: Arthropoda (Ohne Insekta). 1993.
- Volker Storch, Ulrich Welsch: Kükenthal Zoologisches Praktikum. 26. Auflage. Spektrum, Akademischer Verlag, Heidelberg 2009, ISBN 978-3-8274-1998-9.
Weblinks
- arthropods.de
- Taz.de, 30. Januar 2016, Jörg Zittlau: Das große Krabbeln unter dem Bett
Einzelnachweise
- Andreas Hassl: Medizinische Entomologie & Hirudineologie & Vertebratologie. 2. Deutsche Auflage v6.3. Skriptum zur Vorlesung WS 2011/12. Eigenverlag, Wien, A. 25 pp.
- Arthur D. Chapman: Numbers of Living Species in Australia and the World. 2. Auflage. Report for the Australian Biological Resources Study, Canberra, Australia September 2009, ISBN 978-0-642-56861-8. (online)
- Michael F. Land, Dan-E. Nilsson: General purpose and special purpose visual systems. In: Invertebrate Vision. Cambridge University Press, Cambridge, UK 2006, ISBN 0-521-83088-5, S. 167–210. doi:10.2277/0521830885 Download
- Dan-Eric Nilsson: The evolution of eyes and visually guided behaviour. In: Philosophical Transactions of the Royal Society. Series B 364. (2010), S. 2833–2847. doi:10.1098/rstb.2009.0083
- T. Ryan Gregory: The evolution of complex organs. In: Evolution. Education and Outreach. 1 (2008), S. 358–389. doi:10.1007/s12052-008-0076-1
- Carsten H. G. Müller, Andy Sombke, Jörg Rosenberg: The fine structure of the eyes of some bristly millipedes (Penicillata, Diplopoda): additional support for the homology of mandibulate ommatidia. In: Arthropod structure & development. 36(4) 2007, S. 463–476. doi:10.1016/j.asd.2007.09.002
- Steffen Harzsch, Kathia Vilpoux, David C. Blackburn, David Platchetzki, Nadean L. Brown, Roland Melzer, Karen E. Kempler, Barbara A. Battelle: Evolution of Arthropod Visual Systems: Development of the Eyes and Central Visual Pathways in the Horseshoe Crab Limulus polyphemus Linnaeus, 1758 (Chelicerata, Xiphosura). In: Developmental Dynamics. 235 (2006), S. 2641–2655. doi:10.1002/dvdy.20866
- Thomas W. Cronin, Megan L. Porter: Exceptional Variation on a Common Theme: The Evolution of Crustacean Compound Eyes. In: Evolution: Education and Outreach. 1: S. 463–475. doi:10.1007/s12052-008-0085-0
- Elke K. Buschbeck, Markus Friedrich: Evolution of Insect Eyes: Tales of Ancient Heritage, Deconstruction, Reconstruction, Remodeling, and Recycling. In: Evolution: Education and Outreach. 1: S. 448–462. doi:10.1007/s12052-008-0086-z
- Übersicht in: Rolf Elofsson: The frontal eyes of crustaceans. In: Arthropod Structure & Development. 35 (2006), S. 275–291. doi:10.1016/j.asd.2006.08.004
- Kaspar P. Mueller, Thomas Labhart: Polarizing optics in a spider eye. In: Journal of Comparative Physiology. 196(5) 2010, S. 335–348. doi:10.1007/s00359-010-0516-6
- Übersicht in: Carlo Musio, Silvia Santillo: Non-visual photoreception in invertebrates. 2009 Download
- Jerome Casas, Olivier Dangles: Physical Ecology of Fluid Flow Sensing in Arthropods. In: Annual Revue of Entomology. 55. (2010), S. 505–520. doi:10.1146/annurev-ento-112408-085342
- Sanjay P. Sane1 Matthew J. McHenry: The biomechanics of sensory organs. Integrative and Comparative Biology. (2009), S. i8–i23. doi:10.1093/icb/icp112
- Friedrich G. Barth: Spider mechanoreceptors Current Opinion. In: Neurobiology. 14 (2004), S. 415–422. doi:10.1016/j.conb.2004.07.005
- Jayne E. Yack: The Structure and Function of Auditory Chordotonal Organs in Insects. In: Microscopy Research and Technique. 63 (2004), S. 315–337. doi:10.1002/jemt.20051
- Martin Göpfert, Hans Briegel, Daniel Robert: Mosquito hearing: sound-induced antennal vibrations in male and female Aedes aegypti. In: The Journal of Experimental Biology 202. (1999), S. 2727–2738.
- Roger D. Santer & Eileen A. Hebets (2008): Agonistic signals received by an arthropod filiform hair allude to the prevalence of near-field sound communication. Proceedings of the Royal Society Series B 275: 363–368. doi:10.1098/rspb.2007.1466
- Daniel Robert & Martin C Göpfert: Novel schemes for hearing and orientation in insects. In: Current Opinion in Neurobiology. 12 (2002), S. 715–720.
- A. Stumpner & D. von Helversen: Evolution and function of auditory systems in insects. In: Naturwissenschaften. 88 (2001), S. 159–170 doi:10.1007/s001140100223
- J. M. Lovell, M. M. Findlay, R. M. Moate, H. Y. Yan: The hearing abilities of the prawn Palaemon serratus. In: Comparative Biochemistry and Physiology. Part A 140 (2004), S. 89–100. doi:10.1016/j.cbpb.2004.11.003
- K. Dumpert: Bau und Verteilung der Sensillen auf der Antennengeißel von Lasius fuliginosus (LATR.) (Hymenoptera, Formicidae). In: Zeitschrift für Morphologie der Tiere. 73 (1972), S. 95–116.
- J. Esslen, K. E. Kaissling: Zahl und Verteilung antennaler Sensillen bei der Honigbiene (Apis mellifera L. In: ). Zoomorphologie. 83 (1976), S. 227–251.
- Alfred Ernst, Jörg Rosenberg, Gero Hilken: Structure and distribution of antennal sensilla in the centipede Cryptops hortensis (Donovan, 1810) (Chilopoda, Scolopendromorpha). In: Soil Organisms. 81(3) 2009, S. 399–411.
- Rainer Foelix, Eileen Hebets: Sensory biology of whip spiders. (Arachnida, Amblypygi). In: Andrias. 15 (2001), S. 129–140.
- Charles D. Derby, Pascal Steullet, Amy J. Horner, Holly S. Cate: The sensory basis of feeding behaviour in the Caribbean spiny lobster, Panulirus argus. In: Marine and Freshwater Research. 52 (2001), S. 1339–1350.
- Gert Stange & Sally Stowe: Carbon-dioxide sensing structures in terrestrial arthropods. In: Microscopy research & technique 47. (1999), S. 416–427.
- Hugh M. Robertson, Lauren B. Kent: Evolution of the gene lineage encoding the carbon dioxide receptor in insects. In: Journal of Insect Science. Band 9, Nr. 1, 1. Januar 2009, ISSN 1536-2442, S. 19, doi:10.1673/031.009.1901 (oxfordjournals.org).
- Eliane Wajnberg, Daniel Acosta-Avalos, Odivaldo Cambraia Alves, Jandira Ferreira de Oliveira, Robert B. Srygley, Darci M. S. Esquivel: Magnetoreception in eusocial insects: an update. In: Journal of the Royal Society Interface. 7 (2010), S. S207–S225. doi:10.1098/rsif.2009.0526.focus
- Kenneth J. Lohmann: Magnetic remanence in the Western Atlantic Spiny Lobster, Panulirus argus. In: Journal of Experimental Biology. 113 (1984), S. 29–41.
- B. W. Pattullo, D. L. Macmillan: Making sense of electrical sense in crayfish. In: Journal of Experimental Biology. 213 (2010), S. 651–657. doi:10.1242/jeb.039073
- Jon F. Harrison, Alexander Kaiser, John M. VandenBrooks: Atmospheric oxygen level and the evolution of insect body size. In: Proceedings of the Royal Society. Series B 277 (2010), S. 1937–1946. doi:10.1098/rspb.2010.0001
- Karel Slama: A new look at insect respiration. In: Biological Bulletin. 175 (1988), S. 289–300.
- John J. Socha, Wah-Keat Lee, Jon F. Harrison, James S. Waters, Kamel Fezza, Mark W. Westneat: Correlated patterns of tracheal compression and convective gas exchange in a carabid beetle. In: The Journal of Experimental Biology. 211 (2008), S. 3409–3420. doi:10.1242/jeb.019877
- Alexander Kaiser, C. Jaco Klok, John J. Socha, Wah-Keat Lee, Michael C. Quinlan, Jon F. Harrison: Increase in tracheal investment with beetle size supports hypothesis of oxygen limitation on insect gigantism. In: Proceedings of the National Academy of Sciences USA. 104(32) 2007, S. 13198–13203. doi:10.1073/pnas.0611544104
- P. H. Lenz, D. K. Hartline, A. D. Davis: The need for speed. In: I. Fast reactions and myelinated axons in copepods. Journal of Comparative Physiology A 186. (2000), S. 337–345.
- vgl. dazu z. B.: Joel G. Kingsolver, Raymond B. Huey: Size, temperature, and fitness: three rules. In: Evolutionary Ecology Research. 10 (2008), S. 251–268.
- Ilse Bartsch (2004): Geographical and ecological distribution of marine halacarid genera and species (Acari: Halacaridae) Experimental and Applied Acarology 34: 37–58. doi:10.1023/B:APPA.0000044438.32992.35
- Patrick R. H. Steinmetz, Roman P. Kostyuchenko, Antje Fischer, Detlev Arendt: The segmental pattern of otx, gbx, and Hox genes in the annelid Platynereis dumerilii. In: Evolution & Development. 13(1) 2011, S. 72–79 doi:10.1111/j.1525-142X.2010.00457.x
- z. B. Lahcen I. Campbell, Omar Rota-Stabelli, Gregory D. Edgecombe, Trevor Marchioro, Stuart J. Longhorn, Maximilian J. Telford, Hervé Philippe, Lorena Rebecchi, Kevin J. Peterson, Davide Pisani: MicroRNAs and phylogenomics resolve the relationships of Tardigrada and suggest that velvet worms are the sister group of Arthropoda. In: Proceedings of the National Academy of Sciences USA. 2011. doi:10.1073/pnas.1105499108
- auch auf Basis des Blutfarbstoffs Hämocyanin begründet: Beyhan Ertas, Björn M. von Reumont, Johann-Wolfgang Wägele, Bernhard Misof, Thorsten Burmester: Hemocyanin Suggests a Close Relationship of Remipedia and Hexapoda. In: Molecular Biology and Evolution. 26 (12) 2009, S. 2711–2718. doi:10.1093/molbev/msp186
- z. B. J. Mallatt, G. Giribet: Further use of nearly complete 28S and 18S rRNA genes to classify Ecdysozoa: 37 more arthropods and a kinorhynch. In: Molecular Phylogenetics and Evolution. 40(3) 2006, S. 772–794. doi:10.1016/j.ympev.2006.04.021
- Georg Mayer, Paul M. Whitington: Velvet worm development links myriapods with chelicerates. In: Proceedings of the Royal Society London. Series B 276 (2009), S. 3571–3579. doi:10.1098/rspb.2009.0950
- Nicholas J. Strausfeld, David R. Andrew: A new view of insect–crustacean relationships I. Inferences from neural cladistics and comparative neuroanatomy. In: Arthropod Structure & Development. 40(3) 2011, S. 276–288. doi:10.1016/j.asd.2011.02.002
- Björn M. von Reumont, Karen Meusemann, Nikolaus U. Szucsich, Emiliano Dell’Ampio, Vivek Gowri-Shankar, Daniela Bartel, Sabrina Simon, Harald O. Letsch, Roman R. Stocsits, Yun-xia Luan, Johann Wolfgang Wägele, Günther Pass, Heike Hadrys, Bernhard Misof: Can comprehensive background knowledge be incorporated into substitution models to improve phylogenetic analyses? A case study on major arthropod relationships. In: BMC Evolutionary Biology. 9 (2009), S. 119. doi:10.1186/1471-2148-9-119 (open access)
- Maximilian J. Telford, Sarah J. Bourlat, Andrew Economou, Daniel Papillon, Omar Rota-Stabelli: The evolution of the Ecdysozoa. In: Philosophical Transactions of the Royal Society. Series B 363 (2008), S. 1529–1537. doi:10.1098/rstb.2007.2243
- Omar Rota-Stabelli, Lahcen Campbell, Henner Brinkmann, Gregory D. Edgecombe, Stuart J. Longhorn, Kevin J. Peterson, Davide Pisani, Hervé Philippe, Maximilian J. Telford: A congruent solution to arthropod phylogeny: phylogenomics, microRNAs and morphology support monophyletic Mandibulata. In: Proceedings of the Royal Society London. Band 278, Nummer 1703, Januar 2011, S. 298–306, doi:10.1098/rspb.2010.0590, PMID 20702459, PMC 3013382 (freier Volltext).
- Gregory D. Edgecombe: Arthropod phylogeny: An overview from the perspectives of morphology, molecular data and the fossil record. In: Arthropod Structure & Development. 39 (2010), S. 74–87. doi:10.1016/j.asd.2009.10.002
- Karen Meusemann, Björn M. von Reumont, Sabrina Simon, Falko Roeding, Sascha Strauss, Patrick Kück, Ingo Ebersberger, Manfred Walzl, Günther Pass, Sebastian Breuers, Viktor Achter, Arndt von Haeseler, Thorsten Burmester, Heike Hadrys, J. Wolfgang Wägele, Bernhard Misof (2010): A Phylogenomic Approach to Resolve the Arthropod Tree of Life. In: Molecular Biology and Evolution. 27(11) 2010, S. 2451–2464. doi:10.1093/molbev/msq130
- Jerome C. Regier, Jeffrey W. Shultz, Andreas Zwick, April Hussey, Bernard Ball, Regina Wetzer, Joel W. Martin, Clifford W. Cunningham: Arthropod relationships revealed by phylogenomic analysis of nuclear protein-coding sequences. In: Nature. 463 (2010), S. 1079–1083. doi:10.1038/nature08742
- Jianni Liu, Degan Shu, Jian Han, Zhifei Zhang, Xingliang Zhang: Origin, diversification, and relationships of Cambrian lobopods. In: Gondwana Research. 14 (2008), S. 277–283, doi:10.1016/j.gr.2007.10.001.
- Jerzy Dzik: The xenusian-to-anomalocaridid transition within the lobopodians. In: Bollettino della Società Paleontologica Italiana. 50(1) 2011, S. 65–74. Download.
- Jianni Liu, Michael Steiner, Jason A. Dunlop, Helmut Keupp, Degan Shu, Qiang Ou, Jian Han, Zhifei Zhang, Xingliang Zhang: An armoured Cambrian lobopodian from China with arthropod-like appendages. In: Nature. 470 (2011), S. 526–530, doi:10.1038/nature09704.
- A 520-million-year-old, five-eyed fossil reveals arthropod origin (en). In: phys.org.
- Dieter Waloszek, Junyuan Chen, Andreas Maas, Xiuqiang Wang: Early Cambrian arthropods — new insights into arthropod head and structural evolution. In: Arthropod Structure & Development. 34 (2005), S. 189–205, doi:10.1016/j.asd.2005.01.005.
- Jun-Yuan Chen: The sudden appearance of diverse animal body plans during the Cambrian explosion. In: International Journal of Developmental Biology 53. (2009), S. 733–751, doi:10.1387/ijdb.072513cj.
- Graham E. Budd, Maximilian J. Telford: The origin and evolution of arthropods. In: Nature. 457(12) 2009, S. 812–817, doi:10.1038/nature07890.
- Han Zeng, Fangchen Zhao, Kecheng Niu, Maoyan Zhu, Diying Huang: An early Cambrian euarthropod with radiodont-like raptorial appendages. In: Nature. 588, Nr. 7836, Dezember 2020, ISSN 1476-4687, S. 101–105. doi:10.1038/s41586-020-2883-7. PMID 33149303.
- Martin Stein, Dieter Waloszek, Aandreas Maas: Oelandocaris oelandica and its significance to resolving the stemlineage of Crustacea. In: S. Koenemann, R. Vonck (Hrsg.): Crustacea and Arthropod Relationships. Crustacean Issues 16 (2005), S. 55–71.
- Martin Stein, Dieter Waloszek, Aandreas Maas, Joachim T. Haug, Klaus J. Müller (2008): The stem crustacean Oelandocaris oelandica re-visited. In: Acta Palaeontologica Polonica. 53 (3) 2008, S. 461–484. Download (PDF; 2,0 MB).
- Gerhard Scholtz, Gregory D. Edgecombe: The evolution of arthropod heads: reconciling morphological, developmental and palaeontological evidence. In: Development, Genes and Evolution. 216 (2006), S. 395–415, doi:10.1007/s00427-006-0085-4.
- Jean Vannier, Jun-Yuan Chen, Di-Ying Huang, Sylvain Charbonnier, Xiu-Qiang Wang (2006): The Early Cambrian origin of thylacocephalan arthropods. In: Acta Palaeontologica Polonica. 51(2) 2006, S. 201–214. Download (PDF; 1,3 MB).
- N. E. Vaccari, G. D. Edgecombe, C. Escudero: Cambrian origins and affinities of an enigmatic fossil group of arthropods. In: Nature. 430 (2004), S. 554–557, doi:10.1038/nature02705.

