Mangan(II)-acetat
Mangan(II)-acetat ist eine chemische Verbindung aus der Gruppe der Manganverbindungen und Acetate mit der Konstitutionsformel Mn(CH3COO)2.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
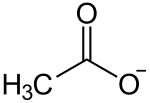 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Mangan(II)-acetat | |||||||||||||||
| Andere Namen |
Mangandiacetat | |||||||||||||||
| Summenformel | C4H6MnO4 | |||||||||||||||
| Kurzbeschreibung |
blassroter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
80 °C[1] | |||||||||||||||
| Siedepunkt |
>300 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit |
löslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Mangan(II)-acetat kann durch Reaktion von Essigsäure mit Mangan(II,III)-oxid oder Mangan(II)-carbonat gewonnen werden.[2][3]
Wird Mangan(II,III)-oxid als Ausgangsstoff verwendet, dann entsteht Mangan(III)-oxid als Nebenprodukt. Mangan(II)-acetat entsteht ebenso durch Reduktion von Mangan(III)-acetat.
Die wasserfreie Form kann durch Reaktion von Essigsäureanhydrid und Mangan(II)-nitrat gewonnen werden.[2]
Eigenschaften
Mangan(II)-acetat ist ein blassrosafarbener Feststoff, der sich bei Temperaturen größer 300 °C zersetzt.
Verwendung
Mangan(II)-acetat wird als Sikkativ, Düngemittel, Sauerstoff-Überträger, Katalysator sowie als Gerberei- und Textilhilfsmittel verwendet.[1]
Einzelnachweise
- Eintrag zu Mangan(II)-acetat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Mary Eagleson: Concise Encyclopedia Chemistry. Walter de Gruyter, 1994, ISBN 978-3-110-11451-5, S. 620 (eingeschränkte Vorschau in der Google-Buchsuche).
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, 2003, ISBN 978-0-070-49439-8, S. 552 (eingeschränkte Vorschau in der Google-Buchsuche).
