Ruthenium(VIII)-oxid
Ruthenium(VIII)-oxid oder Rutheniumtetroxid ist eine chemische Verbindung des Rutheniums und das Oxid mit der höchsten Oxidationsstufe des Elements. Es handelt sich um einen gelben, leichtflüchtigen Feststoff, der ein starkes Oxidationsmittel ist und mit organischen Verbindungen explosiv reagiert.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
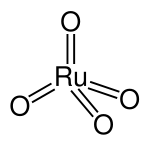 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ruthenium(VIII)-oxid | |||||||||||||||
| Andere Namen |
Rutheniumtetroxid | |||||||||||||||
| Summenformel | RuO4 | |||||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 165,07 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest bei RT | |||||||||||||||
| Dichte |
3,29 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
40 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−239 kJ·mol−1 [5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Ruthenium(VIII)-oxid wurde erstmals 1860 von Karl Ernst Claus isoliert. Dieser gilt auch als Entdecker des Rutheniums.[3]
Gewinnung und Darstellung
Rutheniumtetroxid lässt sich durch Oxidation von wässrigen Lösungen von Ruthenium(III)-chlorid oder Ruthenaten mit Natriumperiodat, Natriumhypochlorit oder Natriumbromat gewinnen.[3] Durch die schlechte Löslichkeit in Wasser entweicht es gasförmig aus der Lösung und lässt sich dann in geeigneten Lösungsmitteln auffangen.[6]
Eigenschaften
In Ruthenium(VIII)-oxid liegt das Ruthenium in seiner maximalen Oxidationsstufe +8 vor. Es ist die höchste bekannte Oxidationsstufe bei ungeladenen Verbindungen und wird nur bei wenigen weiteren Verbindungen, wie z. B. Osmiumtetroxid und Xenon(VIII)-oxid, erreicht. Nur vom IrO4+-Ion ist eine noch höhere Oxidationsstufe bekannt (+9 für Iridium).[7]
Das Ruthenium(VIII)-oxid-Molekül ist tetraedrisch gebaut und besitzt einen Ru-O-Abstand von 170,5 pm.[8] Es kristallisiert in Form von gelben, rhombischen Nadeln[9] und hat einen typischen an Ozon erinnernden Geruch[8].
Rutheniumtetroxid ist thermisch instabil und zersetzt sich beim Erhitzen in Ruthenium(IV)-oxid und Sauerstoff. Es ist instabiler als das entsprechende Osmiumanalogon. Auch durch Kalilauge wird Rutheniumtetroxid reduziert, es bilden sich sechswertige Ruthenate.[8] Explosiv reagiert die Verbindung mit Ammoniak, Ethanol, oxidierbaren organischen Verbindungen, Schwefel und Iodwasserstoff.[2]
Verwendung
Ruthenium(VIII)-oxid wird in der organischen Chemie als Oxidationsmittel genutzt. Beispiele sind die Djerassi-Rylander-Oxidation, bei der Alkene in Carbonylverbindungen gespalten werden, die Oxidation von Alkoholen zu Aldehyden, Ketonen oder Carbonsäuren oder von Alkinen zu 1,2-Diketonen. Häufig wird es in situ während der Reaktion erzeugt.[9]
Bei der Trennung der Platinmetalle und Gewinnung von elementarem Ruthenium ist Ruthenium(VIII)-oxid ein wichtiges Zwischenprodukt. Durch die Bildung dieser Verbindung kann Ruthenium von den anderen Platinmetallen abgetrennt werden.[6]
In der Transmissionselektronenmikroskopie kommt Ruthenium(VIII)-oxid als Kontrastierungsmittel von Polymeren und biologischen Proben zum Einsatz. Zu diesem Zweck lässt man Ruthenium(VIII)-oxid in die Probe eindiffundieren. Liegen innerhalb der Probe unterschiedliche Zusammensetzungen vor (z. B. Polymermischungen), so geht dies meist mit verschiedenen Diffusionsgeschwindigkeiten einher, was dazu führt, dass sich Ruthenium(VIII)-oxid in den Bereichen unterschiedlicher Zusammensetzung verschieden stark anreichert. Da Ruthenium auf Grund seiner vergleichsweise hohen Ordnungszahl jedoch die Elektronen stärker streut kommt in den Bereichen unterschiedlicher Rutheniumkonzentration zur Ausbildung von Kontrastunterschieden.
Sicherheitshinweise
Ruthenium(VIII)-oxid ist brandfördernd. Bei Kontakt mit oxidierbaren Stoffen (wie zum Beispiel organischen Materialien) besteht sogar schon bei Raumtemperatur Explosionsgefahr.[2]
Einzelnachweise
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-86.
- Eintrag zu Ruthenium(VIII)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. April 2010. (JavaScript erforderlich)
- William P. Griffith: Ruthenium and Osmium Oxo Complexes as Organic Oxidants. In: Platinum Metals Review. Band 33, Nr. 4, 1989, S. 181–185 (platinummetalsreview.com [PDF; 357 kB]).
- americanelements.com: CAS Number 20427-56-9, abgerufen am 31. Oktober 2016
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 2. Band: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049590-4, S. 1975 (Leseprobe: Teil C – Nebengruppenelemente. Google-Buchsuche).
- Hermann Renner et al.: Platinum Group Metals and Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2001, doi:10.1002/14356007.a21_075.
- Guanjun Wang, Mingfei Zhou, James T. Goettel, Gary G. Schrobilgen, Jing Su, Jun Li, Tobias Schlöder, Sebastian Riedel: Identification of an iridium-containing compound with a formal oxidation state of IX. In: Nature. Band 514, 21. August 2014, S. 475–477, doi:10.1038/nature13795.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1672–1673.
- Eintrag zu Ruthenium-Verbindungen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
