Hydrierung
Unter Hydrierung versteht man in der Chemie die Addition von Wasserstoff an andere chemische Elemente oder Verbindungen. Eine in der organischen Chemie sehr häufig durchgeführte chemische Reaktion ist die addierende Hydrierung von Kohlenstoff-Kohlenstoff-Doppelbindungen. Hydrierungen haben eine große industrielle Bedeutung wie z. B. bei der katalytischen Hydrierung von Fettsäuren (Fetthärtung) bei der Herstellung von Margarine. Die umgekehrte Reaktion heißt Dehydrierung.
Die katalytische Hydrierung wurde in den 1890er Jahren von Paul Sabatier, der dafür den Nobelpreis erhielt, in Zusammenarbeit mit Jean Baptiste Senderens in Frankreich entwickelt.
Heterogenkatalytische Hydrierung
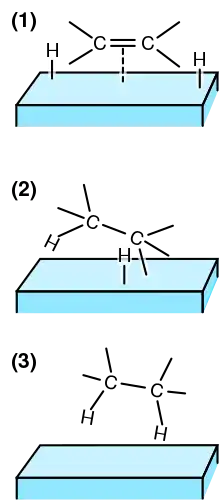
Aufgrund der hohen Stabilität des Wasserstoffmoleküls (die Dissoziations-Enthalpie ΔH0 für die Reaktion H2→2H* beträgt 434 kJ·mol−1) benötigt man für die Hydrierung in der Regel einen Katalysator. Das Wasserstoffmolekül bindet intermediär an das Katalysatormetall-Atom. Dabei wird die Bindung zwischen den beiden Wasserstoffatomen geschwächt, d. h. sie erfährt einen Elektronenmangel und kann nun mit einer elektronenreichen Mehrfachbindung wechselwirken. Die eigentliche Hydrierung findet statt, wenn formal jeweils zwei Wasserstoffatome auf die entsprechende Mehrfachbindung vom Katalysator-Wasserstoff-Komplex übertragen werden. Die Oxidationszahlen der betroffenen Elemente werden dabei um jeweils eins reduziert.
Homogenkatalytische Hydrierung
Die homogenkatalytische Hydrierung, etwa mit dem Wilkinson-Katalysator, wird überwiegend zur Hydrierung von Alkenen mit Wasserstoff genutzt.
Durch Abspaltung eines labilen Liganden wird in einem nachfolgenden Schritt Wasserstoff unter oxidativer Addition angelagert. Das Alken (bzw. Olefin) koordiniert dann zunächst am Metall und reagiert dann unter Insertion in die Metall-Wasserstoff-Bindung. Durch Reaktion mit dem zweiten gebundenen Wasserstoff wird unter reduktiver Eliminierung das Alkan freigesetzt und der ursprüngliche katalytisch aktive Komplex zurückgewonnen.[1]
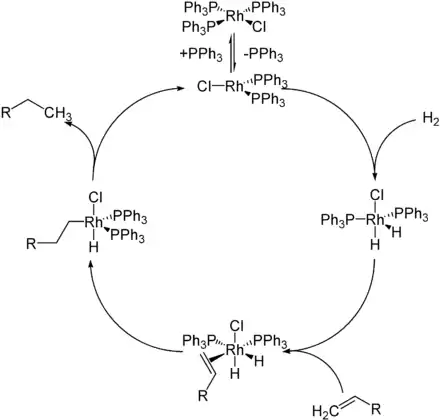
Mit dem Wilkinson-Katalysator können selektiv endständige Doppelbindungen hydriert werden.
Anwendungen der Hydrierung
Anwendung in der organischen Chemie
Die Hydrierung in der organischen Chemie dient dazu, Wasserstoff an Mehrfachbindungen anzulagern. Meist kommt dabei die heterogene katalytische Hydrierung und in Ausnahmefällen auch die homogene katalytische Hydrierung zum Einsatz. Als Katalysatoren dienen vor allem Übergangsmetalle, meist auf Trägermaterialien wie Aktivkohle aufgebracht, gegebenenfalls auch in Kombination mit Katalysatorgiften, welche die Selektivität verbessern. Für die Hydrierung wird meist elementarer Wasserstoff eingesetzt, wobei die erforderlichen Drücke und Temperatur in weiten Bereichen variieren.
Besonders im Labormaßstab haben auch katalytische Hydrierungen mit Hydrazin, Cyclohexadienen oder Ameisensäure als Wasserstoffquelle eine praktische Bedeutung. Bei diesen Methoden entstehen mit Stickstoff für Hydrazin, Benzol für die Cyclohexadiene und Kohlendioxid für die Ameisensäure thermodynamisch sehr stabile Verbindungen.
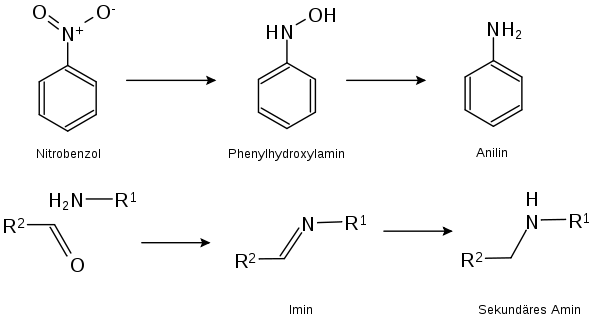
Alkene und Alkine können in Alkane und im Falle der Alkine auch selektiv in (E)- bzw. (Z)-Alkene umgewandelt werden. Katalytisch hydriert werden können aber auch funktionelle Gruppen, die Heteroatome enthalten, so z. B. Nitroverbindungen oder Imine zu Aminen.
Hydrierkatalysatoren
Als Hydrierkatalysatoren kommen vor allem Elemente der 8. Nebengruppe des Periodensystems zum Einsatz. Hier haben Palladium und Nickel besondere Bedeutung erlangt. Des Weiteren werden aber auch Platin, Rhodium, Ruthenium, Kobalt, Eisen, Kupferchromit und Zinkchromit als Hydrierkatalysatoren eingesetzt.
Katalysatorgifte
Zahlreiche Stoffe reagieren mit den aktiven Zentren auf der Katalysatoroberfläche und blockieren diese teilweise oder völlig. Solche „Katalysatorgifte“ sind häufig für das Misslingen katalytischer Hydrierungen verantwortlich. Andererseits kann die gezielte Vergiftung eines Katalysators genutzt werden, um seine Selektivität zu erhöhen (z. B. Lindlar-Katalysator). Klassische Katalysatorgifte sind schwefelhaltige Verbindungen (Thiole), bei denen die Giftwirkung mit der Länge der Alkylketten steigt. Grundsätzlich lassen sich die Katalysatorgifte in drei Gruppen einteilen:
- Gruppe: dazu gehören Elemente wie Stickstoff, Phosphor, Arsen, Antimon, Schwefel, Selen, Tellur, Brom, Iod und zum Teil auch Chlor.
- Gruppe: Metalle und Metallionen – für Platin als Katalysator sind das zum Beispiel: Cu2+, Cu+, Ag+, Au+, Zn2+, Cd2+, Hg22+, Hg2+, Mn2+, Fe2+, Co2+ und Ni2+.
- Gruppe: Komplexbildner für Übergangsmetalle wie z. B. Cyanidionen, Kohlenmonoxid oder Benzol.
Hydrierung von Kohlenstoff-Kohlenstoff-Mehrfachbindungen
Eine wichtige Anwendung der katalytischen Hydrierung ist die Hydrierung von Kohlenstoff-Kohlenstoff-Mehrfachbindungen; sie wird technisch in großem Umfang angewandt, beispielsweise in der Fetthärtung. Die Hydrierung erfolgt hier in der Regel mit Wasserstoff und einem nicht löslichen Katalysator wie Palladium, Platin, Iridium oder Nickel (Raney-Nickel).
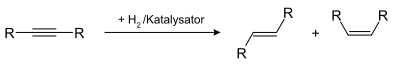
Bei der Hydrierung von Alkinen wird aus der Dreifachbindung zunächst eine Doppelbindung gebildet, die in der (E)- oder der (Z)-Form vorliegen kann. Mit geeigneten Katalysatoren kann das eine oder andere Stereoisomer bevorzugt erhalten werden. Gewöhnlich werden die Alkene schnell zu den Alkanen weiterhydriert; mit speziellen Katalysatoren (Lindlar-Katalysator) kann die Hydrierung aber auf der Stufe des Alkens angehalten werden.

Eine, besonders großtechnisch, viel größere Bedeutung als die Hydrierung von Alkinen hat die katalytische Hydrierung von Alkenen zu Alkanen, so zum Beispiel die in großem Umfang betriebene Fetthärtung. Hierbei werden ölige ungesättigte Fettsäureester in die gesättigten Fettsäureester umgewandelt, welche einen wesentlich höheren Schmelzpunkt haben. Dies ist ein wichtiger Schritt in der Margarine-Herstellung (siehe unterer Abschnitt).
Die Hydrierwärme (Hydrierenthalpie) kann als Maß für die Stabilität verschiedener ungesättigter Verbindungen herangezogen werden. So kann durch Vergleich der Hydrierwärmen von Cyclohexen und 1,3-Cyclohexadien die theoretische Hydrierwärme des nicht existenten Cylohexatriens berechnet werden und daraus mit dem Vergleich zur Hydrierwärme von Benzol auf die Resonanzstabilisierung durch das aromatische System im Benzol geschlossen werden.
Je nach sterischer Hinderung ist die katalytische Hydrierung leicht (bei Normaldruck und Raumtemperatur) möglich oder erfordert drastischere Bedingungen. Leicht sind monosubstituierte Olefine zu hydrieren, der Aufwand steigt mit der Anzahl an Kohlenstoffsubstituenten.
Im Labor wird für die katalytische Hydrierung in der Regel Palladium, aufgezogen auf Aktivkohle, und Wasserstoff aus einer Druckgasflasche verwendet. In der technischen Chemie bedient man sich hier eher optimierter Verfahren. Der Katalysator Palladium (aufgezogen auf Aktivkohle) ist kommerziell erhältlich, enthält je nach Qualität und damit auch Preis 1–10 % Palladium in einer Oxidationsstufe von Pd(II) und muss im Falle von Komplexliganden, wie Nitrogruppen, für Palladium vor der eigentlichen Hydrierung vorher selber hydriert (=reduziert zu Palladium (0)) werden.
Hydrierung anderer Mehrfachbindungen
Durch katalytische Hydrierung können auch Heteroatom-Kohlenstoff und Heteroatom-Heteroatom-Mehrfachbindungen reduziert werden. Besonders von Bedeutung sind hier die Hydrierung von Nitrogruppen, Iminen und Oximen zu den entsprechenden Aminen und von heterocylischen aromatischen Verbindungen zu den entsprechenden gesättigten Ringsystemen.
Hydrierungen als Verfahren zum Entfernen von Schutzgruppen
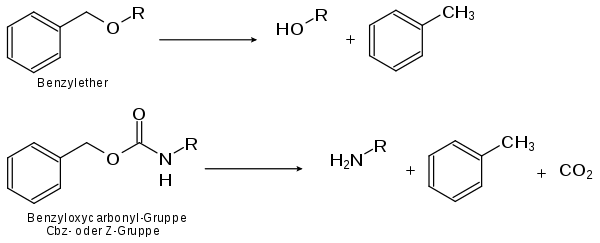
Aufgrund der häufig milden Bedingungen eignet sich die katalytische Hydrierung auch zum Entfernen von Schutzgruppen. Besonders sind hier zu nennen die Benzylgruppe die im Falle von Benzylethern, Benzylestern Alkohole bzw. Carbonsäuren schützen oder aber in der Peptidchemie die Benzyloxycarbonyl-Gruppe oder auch Z-Gruppe (Cbz) genannt.
Margarineherstellung durch Fetthärtung
Die Hydrierung wird auch bei der Fetthärtung von Pflanzenölen zur Herstellung von Margarine verwendet (Wilhelm Normann, 1901). Dabei werden Doppelbindungen in den Fettsäure-Ketten der Fettmoleküle mit Wasserstoff abgesättigt. Da die Verbindungen ohne Doppelbindungen einen höheren Schmelzpunkt haben, erhält man aus den flüssigen Ölen ein festes Fett. Die Hydrierung erfolgt an Nickel als Katalysator bei 120 bis 180 °C und einem Wasserstoff-Druck von 6 bis 7 bar. Unvollständige Hydrierung trägt dazu bei, dass als unerwünschte Nebenprodukte (E)-Fettsäuren (trans-Fettsäuren) entstehen.[2] Diese stehen im Verdacht, das Risiko für Herz-Kreislauferkrankungen zu erhöhen. Durch optimierte Hydrierverfahren kann heute die Bildung dieser unerwünschten Nebenprodukte auf wenige Prozente reduziert werden.
Literatur
- Felix Zymalkowski: Katalytische Hydrierung im organisch-chemischen Laboratorium (Sammlung chemischer und chemisch-technischer Beiträge/N.F.; Bd. 61). Ferdinand Enke Verlag, Stuttgart 1965.
Weblinks
Einzelnachweise
- Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 23. Aufl. Hirzel Verlag, Stuttgart 1998, S. 406f., ISBN 3-7776-0808-4.
- An Philippaerts, Pierre A. Jacobs, Bert F. Sels: Hat die Hydrierung von Pflanzenölen noch eine Zukunft?, Angew. Chem. 125 (2013) 5328–5334, doi:10.1002/ange.201209731.