Chemotherapie
Die Chemotherapie ist eine medikamentöse Therapie von Krebserkrankungen (antineoplastische Chemotherapie) oder Infektionen (antiinfektiöse bzw. antimikrobielle Chemotherapie). Umgangssprachlich (auch als Chemo bezeichnet[1]) ist meistens die zytostatische Behandlung von Krebs gemeint. Eine Chemotherapie kann unter kurativen, adjuvanten oder palliativen Gesichtspunkten durchgeführt werden.
Die Chemotherapie verwendet Stoffe, die ihre schädigende Wirkung möglichst gezielt auf bestimmte krankheitsverursachende Zellen beziehungsweise Mikroorganismen ausüben und diese abtöten oder in ihrem Wachstum hemmen. In der Krebstherapie heißen diese Substanzen Zytostatika; in der Behandlung von Infektionskrankheiten Antibiotika, Chemotherapeutika, Virustatika, Antimykotika und Anthelminthika. Bei der Behandlung bösartiger Tumorerkrankungen nutzen die meisten dieser Substanzen die schnelle Teilungsfähigkeit der Tumorzellen, da diese empfindlicher als gesunde Zellen auf Störungen der Zellteilung reagieren; auf gesunde Zellen mit ähnlich guter Teilungsfähigkeit üben sie allerdings eine ähnliche Wirkung aus, wodurch sich Nebenwirkungen wie Haarausfall oder Durchfall einstellen können. Bei der Behandlung von bakteriellen Infektionskrankheiten macht man sich den unterschiedlichen Aufbau von eukaryotischen (Mensch) und prokaryotischen Lebewesen (Bakterien) zunutze.
Bei der Krebstherapie mit monoklonalen Antikörpern und Zytokinen, wie beispielsweise Interleukinen und Interferonen, handelt es sich nicht um eine Chemotherapie, sondern oftmals um eine Krebsimmuntherapie.
Geschichte

Der im 18. Jahrhundert erstmals aufgetauchte Begriff wurde 1906 von Paul Ehrlich neu definiert und geprägt. Er beschrieb damit die Behandlung von Infektionskrankheiten mit chemischen Substanzen, die direkt gegen den Krankheitserreger wirken. Als erstes wirksames Chemotherapeutikum hatte er 1904 Trypanrot erkannt, mit dem er an der Schlafkrankheit erkrankte Mäuse heilte.[2] Ehrlich begann am 31. August 1909 in Frankfurt am Main weitere Versuche, indem er Erreger der Syphilis in Ratten injizierte und anschließend mit Hilfe chemotherapeutischer Verfahren behandelte. Diese Versuche hatten eine so überzeugende Wirkung, dass man hierin die neue „Waffe“ der Medizin gegen Infektionskrankheiten sah. Ehrlich wurde danach als „Schöpfer der Chemotherapie“ bezeichnet.[3] Die verwendeten Medikamente werden entweder künstlich hergestellt oder sind Abkömmlinge von in der Natur vorkommenden Stoffen.
Sensitivität
Das Ansprechen einer Chemotherapie hängt von verschiedenen Faktoren ab. Erstens wird ein Chemotherapeutikum unterschiedlich schnell im Menschen abgebaut, und je kürzer das Medikament im Körper wirksam beziehungsweise präsent ist, desto kürzer kann es auch nur wirken. Zweitens ist die Erreichbarkeit der krankheitsverursachenden Zellen oder Mikroorganismen ein wichtiger Faktor. So kann ein Tumor sehr kompakt geformt sein und über wenig Blutversorgung verfügen. Daraus resultiert, dass das Medikament den eigentlichen Wirkort nicht oder nur schlecht erreichen kann. Ein dritter Faktor bestimmt das Ansprechverhalten von Chemotherapeutika. Zum Beispiel können auch bei guter Erreichbarkeit des Tumors durch das Zytostatikum die Krebszellen resistent gegen das Medikament sein. Diese Eigenschaften werden als Chemosensitivität und Chemoresistenz bezeichnet.
Es ist möglich, die Wirksamkeit von Chemotherapeutika auf Bakterien im Rahmen eines Antibiogramms zu testen. Ebenso kann bei Krebszellen die Chemosensitivität in vitro getestet werden (Chemosensitivitätstest).
Prinzipien der antineoplastischen Chemotherapie
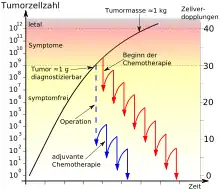
Die blaue Kurve stellt den Verlauf nach einer operativen Tumorentfernung mit adjuvanter Chemotherapie dar, die rote Kurve den Verlauf bei einem nicht operablen Tumor und Chemotherapie.
Von der ersten entarteten Zelle bis zum nachweisbaren Tumor werden etwa 30 Zellteilungszyklen benötigt (= 109 Krebszellen mit 1 g Masse). Von diesem Punkt bis zur normalerweise tödlichen Tumormasse von ungefähr 1 kg (= 1012 Krebszellen) werden nur noch zehn weitere Teilungszyklen benötigt.[4][5]
Wegen der höheren Bioverfügbarkeit wird in der Regel eine intravenöse Verabreichung gewählt. Einige Therapien sind aber auch oral möglich.
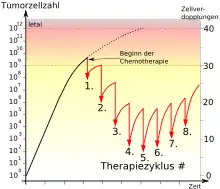
Eine bestimmte Zytostatikadosis kann immer nur einen bestimmten Anteil, z. B. 90 % der Zielzellen abtöten. Mit fortschreitender Behandlung bleibt dieser Anteil gleich, d. h., zwei Dosen erreichen 99 % der Zellen, drei Dosen 99,9 % usw. Dieser Mechanismus erklärt, warum eine Chemotherapie im Laufe der Behandlung nicht vermindert werden darf, auch wenn der sichtbare Tumor bereits verschwunden ist (Log cell kill, Howard E. Skipper 1964.[7]) Im Gegenteil: Es muss damit gerechnet werden, dass durch eine schwache Behandlung gerade die widerstandsfähigsten Tumorzellklone selektiert werden, d. h. übrig bleiben. Moderne Protokolle versuchen daher, „so früh und so hart wie möglich zuzuschlagen“.[8] Die Chemotherapie wird in schneller Abfolge appliziert, und fast immer werden zwei oder mehr Zytostatika kombiniert, um die Wirksamkeit zu erhöhen. Mangelnde Therapieerfolge bei einigen Tumorarten und neuere theoretische und tierexperimentelle Daten lassen jedoch Zweifel an der generellen Richtigkeit dieses Konzeptes aufkommen.[9]
Adjuvant nennt man eine Chemotherapie, die zur Erfolgssicherung nach einer vollständigen operativen Beseitigung des Tumors dienen soll. Neoadjuvant ist eine Chemotherapie vor der Operation. Sehr häufig wird die adjuvante, neoadjuvante oder alleinige Chemotherapie mit Strahlentherapie kombiniert (Radiochemotherapie).
Bei der Behandlung von alten Menschen muss berücksichtigt werden, dass diese oft eine verminderte Leber- und Nierenfunktion und eine verminderte Knochenmarksreserve haben und ihre Empfindlichkeit gegenüber den Substanzen daher erhöht ist. Wenn die Dosis nach dem Körpergewicht oder der Körperoberfläche abgeschätzt wird, ist der erhöhte Anteil an Körperfett im Alter einzurechnen.
Resistenzen der Tumorzellen gegen einzelne oder mehrere der eingesetzten Zytostatika sind nicht selten. Außerdem sollte man während einer Chemotherapie nicht rauchen, denn bei einigen Standard-Chemotherapeutika wurde nachgewiesen, dass ihre Wirkung durch Nikotin abgeschwächt wird. Resistenzen können viele Ursachen haben, beispielsweise verminderten Transport der Substanz in das Zellinnere oder erhöhten Transport aus der Zelle (Multiple Drug Resistance). Auch kann die Zelle inaktivierende Enzyme besitzen. Gute Durchblutung des Tumors (Angiogenese) führt wegen hoher Nährstoffversorgung zu schnellem Wachstum, aber auch zu besserem Ansprechen auf die Chemotherapie, da der Anteil der sich teilenden Zellen höher ist. Viele der durch die Zytostatika in den Zellen erzeugten Schäden setzen voraus, dass vorhandene Kontrollsysteme (beispielsweise p53) in den Tumorzellen noch aktiv sind und diese Fehler bemerken. Reparaturmechanismen (beispielsweise Exzisionsreparatur) dürfen hingegen nicht aktiviert sein, stattdessen muss ein kontrolliertes Absterben der Zelle eingeleitet werden. Resistenzen müssen frühzeitig erkannt werden, um Änderungen des Therapieregimes rechtzeitig wirksam werden zu lassen, sonst häufen sich Mutationen im Tumor an, die ihn schwerer kontrollierbar machen. Auch das Auffinden der für den speziellen Tumor optimalen Kombinationstherapie durch Labortests wird diskutiert und wurde erfolgreich eingesetzt.[10][11]
Prinzipiell können bei der Chemotherapie zwei unterschiedliche Wege zur Bekämpfung der Krebszellen eingeschlagen werden. Mit Zytotoxinen soll die Apoptose, das heißt der programmierte Zelltod der malignen Zellen, herbeigeführt werden. Dies ist der in den meisten Fällen angestrebte Weg, den Tumor zu eradizieren, das heißt vollständig aus dem Körper des Erkrankten zu beseitigen.[12] Zytostatika (griechisch cyto=Zelle und statik=anhalten) sind dagegen definitionsgemäß Substanzen, die Krebszellen nicht abtöten, sondern deren Zellwachstum und die Zellteilung (Proliferation) unterbinden. Konventionelle klassische Chemotherapeutika wirken im Wesentlichen zytotoxisch, während zielgerichtete neuere Therapien aus dem Bereich der Krebsimmuntherapie, wie beispielsweise monoklonale Antikörper, zytostatische Eigenschaften haben.[13][14]
In der Literatur wird allerdings in vielen Fällen nicht zwischen Zytostatika und Zytotoxinen unterschieden. Die meisten derzeit angewandten Chemotherapeutika wirken zudem sowohl zytotoxisch als auch zytostatisch.[13]
Anwendungsgebiete
- Eine örtliche Behandlung reicht bei soliden Tumoren (d. h. fest, im Gegensatz z. B. zu Leukämien) nicht mehr aus, wenn bereits Metastasen nachweisbar sind.
- Leukämien und maligne Lymphome breiten sich oft von Anfang an über mehrere Körpergebiete aus. Dann ist in jedem Fall eine systemische Abgabe von Zytostatika notwendig.
- Eine adjuvante (= ergänzende, helfende) Zytostatikagabe wird vor oder nach der chirurgischen Entfernung eines Tumors auch ohne Nachweis von Metastasen gegeben, wenn das Rückfallrisiko erfahrungsgemäß hoch ist.
Gegenanzeigen
Kontraindikationen für eine antineoplastische Chemotherapie können vorliegen, wenn
- der Tumor durch eine Operation oder Bestrahlung komplett und mit großer Wahrscheinlichkeit kurativ entfernt werden kann,
- die Abwägung ergibt, dass die zu erwartenden Nebenwirkungen der Behandlung schwerer sind als der zu erwartende Verlauf des Tumorleidens ohne Chemotherapie,
- der Allgemeinzustand des Patienten oder die Funktion wesentlicher Organe zu weit eingeschränkt sind.
Beispiele für Krebserkrankungen, bei denen eine Chemotherapie zu einer dauerhaften Heilung führen kann:
- Brustkrebs ohne Fernmetastasen
- Chorionkarzinom der Frau
- Hodentumore
- akute Leukämien
- malignes Lymphom
- Morbus Hodgkin
- Tumoren bei Kindern, auch mit Metastasen.
Wahl des Chemotherapeutikums
Die Wahl des Chemotherapeutikums richtet sich nicht nur nach dem Organ der Krebserkrankung (z. B. Brust-, Lungen-, Darmkrebs), sondern auch nach individuellen Kriterien, die bei verschiedenen Patienten mit „derselben“ Krebserkrankung unterschiedlich sein können. Solche Kriterien können beispielsweise sein:
- der Gewebstyp der Tumorzellen (z. B. kleinzellig, Plattenepithel, Drüsenepithel etc.)
- Rezeptoren, die die Tumorzellen tragen (bspw. HER2/neu)
- bestimmte Mutationen im Erbgut der Tumorzellen (bspw. KRAS, siehe auch Onkogene)
- die anfängliche Wirksamkeit der begonnenen Therapie
- andere Erkrankungen des Patienten
- die allgemeine Verfassung des Patienten
Trotz dieser individuellen Gesichtspunkte können für maligne Erkrankungen typische Chemotherapeutika genannt werden, die bei diesen regelhaft zum Einsatz kommen.
| Krebserkrankung | typisches Chemotherapeutikum oder Chemotherapie-Schema | zusätzliche medikamentöse Therapie |
|---|---|---|
| Darmkrebs | FOLFIRI, FOLFOX oder XELOX[15] | Bevacizumab, Cetuximab[15] |
| Brustkrebs | 5-Fluoruracil + Anthracyclin + Cyclophosphamid evtl. Capecitabin[16] | Trastuzumab bei HER2-positiven Tumoren Tamoxifen Lapatinib Sunitinib Eribulin Everolimus[16] |
| Leberzellkarzinom | 5-Fluoruracil + Folinsäure[16] | Sorafenib[16] |
Therapieschemata
Heutzutage werden bei der Chemotherapie fast immer (abgesehen von möglicherweise nebenwirkungsärmeren Monotherapien bei der palliativen zytostatischen Chemotherapie[17]) mehrere Wirkstoffe kombiniert. Dazu wurden Schemata entwickelt, in denen festgelegt ist, welche Wirkstoffe in welcher Abfolge und mit welchem Zeitabstand anzuwenden sind, um eine optimale Wirkung zu erzielen. Aus den Namen der beteiligten Wirkstoffe wird der Name des Schemas (meist als Akronym) abgeleitet:
- ABVD
- BEACOPP
- CMF (Cyclophosphamid, Methotrexat, 5-Fluoruracil)
- CHOP
- COPP
- CVI (Cyclophosphamid, Vincristin, Prednisolon)
- ECF (Epirubicin, Cisplatin, 5-Fluoruracil)
- FLP (5-Fluoruracil, Folinsäure (=Leucovorin), Cisplatin)
- FOLFIRI ist eine wöchentlich durchzuführende mittelgradig komplexe Chemotherapie mit folgenden Wirkstoffen:
- Folinsäure
- Fluorouracil als Bolus und anschließend als 24-Stunden-Infusion
- Irinotecan (wesentliche Nebenwirkung: cholinerges Syndrom)
- FOLFOX ist eine 14-täglich durchzuführende mittelgradig komplexe Chemotherapie mit folgenden Wirkstoffen:
- Folinsäure
- Fluorouracil als „Bolus“ und anschließend als 48-Stunden-Infusion.
- Oxaliplatin (wesentliche Nebenwirkung: Kribbelparästhesien; daher ist eine Magnesium- und Calciuminfusion indiziert)
- 5FUFS (5-Fluoruracil, Folinsäure)
- MCF (Mitomycin C, Cisplatin, 5-Fluoruracil)
- MTX (Methotrexat), in geringerer Dosierung auch gegen Autoimmunkrankheiten, z. B. Psoriasis
- PEB (Cisplatin, Etoposid, Bleomycin)
- PCV (Procarbazin, Lomustin, Vincristin)
- VAC beim Ewingsarkom
- TAC (Docetaxel, Adriamycin, Cyclophosphamid) ist ein dreiwöchentlicher Chemotherapiezyklus als Drei-Stunden-Infusion
- TEC (Docetaxel, Epirubicin, Cyclophosphamid)
- XELOX ist ein dreiwöchentlicher Chemotherapiezyklus bestehend aus folgenden Wirkstoffen:
- Capecitabin (oral, wesentliche Nebenwirkung: Hand-Fuß-Syndrom)
- Oxaliplatin
Nebenwirkungen
Die Nebenwirkungen einer Chemotherapie sind abhängig von der Art der Therapie und der individuellen Verträglichkeit. Die einzelnen Nebenwirkungen treten unabhängig voneinander auf und können ganz ausbleiben oder in verschiedener Stärke (von mild bis tödlich) auftreten.
Diese Nebenwirkungen sind Übelkeit und Erbrechen, Erschöpfung, Haarausfall, Geschmacksstörungen, Schleimhautentzündungen und Blutbildveränderungen. Sie werden nach den Common Toxicity Criteria eingeteilt.
Viele Zytostatika sind selbst karzinogen, etwa Busulfan, Chlorambucil, Cyclophosphamid oder Semustin.[18] Insgesamt ist die Rate an zytostatikainduzierten Leukämien zwar rückläufig, aber bei einigen Tumorarten steigt die Zahl der Erkrankungen immer noch an. Darunter fällt das Multiple Myelom, das Non-Hodgkin-Lymphom, Ösophaguskarzinom, Analkarzinom, Zervixkarzinom und Prostatakarzinom. Während bei den ersten beiden auch nach einem Jahrzehnt nach der Chemotherapie eine therapiebedingte akute myeloische Leukämie (tAML) auftreten kann, ist sie bei den übrigen Karzinomen auf die ersten zehn Jahre nach der Behandlung beschränkt.[19]
Bis zu drei Viertel der Tumorpatienten mit einer Chemotherapie erkranken an einer chemotherapieassoziierten Anämie. Ein hohes Risiko besteht vor allem bei Tumorentitäten wie dem Lymphom, multiplem Myelom, Bronchialkarzinom sowie bei gynäkologischen und urogenitalen Tumoren. Häufigkeit und Schweregrad der Anämie sind auch vom Tumorstadium abhängig.[20] Während die nach den Common Toxicity Criteria aufgelisteten Nebenwirkungen meist mit dem Absetzen der Chemotherapie verschwinden, kann es unter Umständen zu einer irreversiblen Herzmuskelschädigung sowie zu einer temporären oder endgültigen Unfruchtbarkeit kommen. Die Gabe von Anthracyclinen führt bei etwa zehn Prozent der Patienten zu einer bleibenden Schädigung der Herzmuskelzellen, welche Herzrhythmusstörungen und/oder eine Herzinsuffizienz (Herzschwäche) auslösen kann. Seit 2007 sind sogenannte Kardioprotektiva zugelassen, welche Herzschäden durch die Gabe der Anthracycline Doxorubicin oder Epirubicin verhindern können.[21]
Wegen einer etwaigen durch die Chemotherapie bedingten Unfruchtbarkeit wird vor der Behandlung bei Männern, falls vom Patienten gewünscht, eine Aufbewahrung des Samens (ähnlich wie es bei Samenspendern praktiziert wird) vorgenommen. Durch die fachgerechte Lagerung wird dann die Chance auf eigene Kinder erhalten. Fertilitätserhaltende Maßnahmen bei Frauen sind möglich, tragen jedoch zum Teil noch experimentellen Charakter. Das Netzwerk Fertiprotekt bemüht sich im deutschsprachigen Raum, über Maßnahmen bei Männern und Frauen zu informieren und sie anzubieten.
Manche Patienten erleben nach einer Chemotherapie eine meist vorübergehende Beeinträchtigung des Denk-, Merk- und Stressbewältigungsvermögens, die als Post-chemotherapy Cognitive Impairment (PCCI) (auch Chemotherapy-induced Cognitive Dysfunction oder „Chemo Brain“) bezeichnet wird. Die Ursache dieses Phänomens wird derzeit erforscht. Sie kann nach gegenwärtigem Forschungsstand entweder in der psychisch belastenden, traumaähnlichen Situation der Diagnose und Krankheit selbst, in den direkten physischen Auswirkungen der Chemotherapie oder in beiden Faktoren liegen.[22]
Zur Vorbeugung einer ausgeprägten Mukositis können mehrere Lokalanästhesien mit Vasokonstriktor im Mund-/Kieferbereich verabreicht werden, wodurch eine Anflutung des Chemotherapeutikums in die Schleimhaut vermindert wird. Zusätzlich kann eine Kältetherapie mittels Lutschen von Eiswürfeln die lokale Vasokonstriktion bei der Strahlentherapie verstärken. Die dadurch erreichte Sauerstoffunterversorgung des Gewebes vermindert die zelluläre Strahlenempfindlichkeit.[23]
Neben den allseits bekannten Nebenwirkungen der Chemotherapie wie Haarverlust und Übelkeit kann es bei der Chemotherapie (oder Stammzelltransplantation) auch zu Blutungen kommen. Zu diesen haben Estcourt und Mitarbeiter in den Jahren 2012 und 2015 Cochrane-Übersichtsarbeiten mit randomisierten kontrollierten Studien erstellt, um herauszufinden, welche Nutzung von Thrombozytentransfusionen die wirksamste ist, um Blutungen bei Patienten mit hämatologischen Erkrankungen zu verhindern, wenn sie eine Chemotherapie oder eine Stammzelltransplantation erhalten.[24][25]
Vielfach wurde eine Steigerung der Verträglichkeit bzw. Reduzierung der Nebenwirkungen durch kurzzeitiges Fasten in den Tagen der Therapie sowohl beim Menschen als auch bei Tieren (in Tierversuchen) beobachtet.[26][27][28][29]
Wirksamkeit
Die Wirksamkeit einer Chemotherapie hängt sehr stark von der Art des Tumors und seinem Stadium ab. Während es sehr viele Studien zu der Wirkung spezifischer Zytostatika auf entsprechende Tumorarten gibt, existiert bisher lediglich eine einzige Krebsregister-Studie, welche den Nutzen einer alleinigen Chemotherapie bei 22 Krebskrankheiten in Australien und den USA untersucht. Nicht ausgewertet wurden Krebskrankheiten, für die eine Chemotherapie die wichtigste Behandlung darstellt (z. B. Leukämie oder Lymphdrüsenkrebs), aber auch nicht die Krebsarten, bei der die Chemotherapie lediglich unterstützend (adjuvant) genutzt wird. Laut Studie sollen alleine angewandte zytotoxische Chemotherapien bei Erwachsenen zusätzliche 2,3 Prozent (in Australien) bzw. 2,1 Prozent (in den USA) zur jeweiligen Fünfjahresüberlebensrate beitragen. Die Studie bestätigt jedoch auch, dass bei bestimmten Krebsarten wie z. B. Hodenkrebs, Hodgkin-Lymphomen oder Zervixkarzinomen eine adjuvant angewandte Chemotherapie eine um 10 bis 40 Prozent bessere Prognose bringt.[30]
Die Studie wurde von australischen Onkologen stark kritisiert. Die Autoren hätten die verschiedenen Krebsarten nicht gewichtet (die Fallgruppe der Krebsarten, bei welchen die Chemotherapie schlecht wirkt und somit oft auch nicht angewendet wird, ist am größten) und es gebe methodische Mängel. Bei Anwendung sauberer Methodik würde aus dem gleichen Datenmaterial die Effektivität auf 6 Prozent über alle Fälle steigen. Außerdem wurden einige Krebsarten, welche hauptsächlich durch Chemotherapie behandelt werden (z. B. Leukämie) und wo diese Therapie sehr effektiv ist, nicht betrachtet. Überdies stammten die Daten aus den 1990er Jahren und seien folglich veraltet. Da die Wirkung einer Chemotherapie von der Art des Tumors abhängt, ist ein solcher Zusammenwurf aller Tumorarten nicht zielführend, denn er sage nichts über den Einzelfall aus.[31][32] Zudem verwendet die Studie nur Fünfjahresüberlebensraten – bei manchen Krebsarten wie Brustkrebs kann Chemotherapie aber das späte Auftreten eines Rezidivs verhindern.[33]
Tatsache ist, dass hochwirksame Zytostatika dazu beigetragen haben, die relative Fünfjahresüberlebensrate bei bestimmten Krebsarten in den letzten 20 Jahren signifikant – mit verbesserten Prognosen im zweistelligen Prozentbereich – zu erhöhen. Dies gilt einerseits bei der adjuvanten Anwendung beispielsweise bei Brustkrebs, Hodenkrebs und Lungenkrebs sowie andererseits bei der primären Anwendung der Chemotherapie als Mittel der ersten Wahl, wie beispielsweise bei Hodgkin-Lymphomen und Leukämie.[34]
Neben einer Steigerung der Verträglichkeit bzw. Reduzierung der Nebenwirkungen durch kurzzeitiges Fasten in den Tagen der Therapie, konnte in Versuchen beobachtet werden, dass die erwünschte krebsschädigende Toxizität der Chemotherapeutika anstieg und also die Therapie wirksamer wurde.[29][26][27][28]
Literatur
- Marcel H. Bickel: Chemotherapie. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 240 f.
Weblinks
- Chemotherapieseite Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg. Abgerufen am 3. September 2014.
- Wirkung der Chemotherapie hängt von der Tageszeit ab. Bild der Wissenschaft, 5. Februar 2005
Einzelnachweise
- Chemo. In: duden.de. Abgerufen am 21. August 2015.
- Bickel: Chemotherapie. S. 241.
- Hans Loewe: Paul Ehrlich. Schöpfer der Chemotherapie. Stuttgart 1950.
- Klaus Aktories, Ulrich Förstermann, Franz Hofmann, Klaus Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 10. Auflage. Elsevier, Urban & Fischer, München/Jena 2009, ISBN 978-3-437-42522-6.
- O. A. Adam: Antineoplastische Chemotherapie. (PDF; 1,6 MB) (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. LMU München
- H. D. Bruhn (Hrsg.) u. a.: Onkologische Therapie. Verlag Schattauer, 2003, ISBN 3-7945-2165-X, S. 89–92
- H. H. Skipper: Perspectives In Cancer Chemotherapy: Therapeutic Design. In: Cancer Res. 24, September 1964, S. 1295–1302. PMID 14221786.
- J. H. Goldie, A. J. Coldman: A mathematic model for relating the drug sensitivity of tumors to their spontaneous mutation rate. In: Cancer Treat Rep. 63, Nr. 11–12, 1979, S. 1727–1733. PMID 526911.
- R. A. Gatenby, A. S. Silva, R. J. Gillies, B. R. Frieden: Adaptive therapy. In: Cancer Res. 69, Nr. 11, Juni 2009, S. 4894–4903. doi:10.1158/0008-5472.CAN-08-3658. PMID 19487300.
- Chemotherapy experts refute ASCO recommendations on use of drug sensitivity and resistance assays. News-Medical.Net, 1. September 2004, abgerufen am 25. August 2010 (englisch, zwei Seiten).
- R. S. Mehta, R. Bornstein, I. R. Yu, R. J. Parker, C. E. McLaren, K. P. Nguyen, K. T. Li, J. P. Fruehauf: Breast cancer survival and in vitro tumor response in the extreme drug resistance assay. In: Breast Cancer Research and Treatment. Band 66, Nummer 3, April 2001, ISSN 0167-6806, S. 225–237, PMID 11510694.
- R. K. Gibb u. a.: Apoptosis as a Measure of Chemosensitivity to Cisplatin and Taxol Therapy in Ovarian Cancer Cell Lines. In: Gynecol Oncol 65, 1997, S. 13–22. PMID 9103385
- O. Rixe und T. Fojo: Is cell death a critical end point for anticancer therapies or is cytostasis sufficient? In: Clin Cancer Res 13, 2007, S. 7280–7287. PMID 18094408 (Review)
- J. A. Houghton und P. J. Houghton: Cellular responses to antimetabolite anticancer agents: cytostasis versus cytotoxicity. In: Prog Cell Cycle Res 2, 1996, S. 175–185. PMID 9552394
- Gerd Herold et al. In: Innere Medizin. 2011, S. 484
- M. Müller und Mitarbeiter: Chirurgie für Studium und Praxis. 2014/15, S. 154, S. 247
- Eberhard Aulbert, Wiebke Nehls: Palliative internistisch-onkologische Tumortherapie. In: Eberhard Aulbert, Friedemann Nauck, Lukas Radbruch (Hrsg.): Lehrbuch der Palliativmedizin. Schattauer, Stuttgart (1997) 3., aktualisierte Auflage 2012, ISBN 978-3-7945-2666-6, S. 633–663, hier: S. 641 f.
- Paolo Boffetta, John M. Kaldor: Secondary Malignancies Following Cancer Chemotherapy. In: Acta Oncologica. 33, Nr. 6, 1994, S. 591–598. doi:10.3109/02841869409121767.
- L. M. Morton, G. M. Dores, M. A. Tucker, C. J. Kim, K. Onel, E. S. Gilbert, J. F. Fraumeni Jr., R. E. Curtis: Evolving risk of therapy-related acute myeloid leukemia following cancer chemotherapy among adults in the United States, 1975–2008. In: Blood. 2013; doi:10.1182/blood-2012-08-448068.
- H. Ludwig, S. van Belle, P. Barrett-Lee et al.: The European Cancer Anaemia Survey (ECAS): a large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients. In: Eur. J. Cancer. 40, Nr. 15, Oktober 2004, S. 2293–2306. doi:10.1016/j.ejca.2004.06.019. PMID 15454256.
- Herzschutz bei Chemotherapie. (PDF) (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. Patientenratgeber: Vorbeugung von Anthrazyklin-bedingten Herzschäden. (PDF).
- Ludwig-Maximilians-Universität München: Krebs und das „Chemobrain“ – Wenn die geistigen Fähigkeiten von Tumorpatienten leiden. Abgerufen am 30. April 2011.
- W. Dörr, J. Haagen et al.: Behandlung der oralen Mukositis in der Onkologie. (Memento vom 23. November 2015 im Webarchiv archive.today) Im Focus Onkologie, 7–8, 2010
- Lise Estcourt, Simon Stanworth, Carolyn Doree, Sally Hopewell, Michael F Murphy: Prophylactic platelet transfusion for prevention of bleeding in patients with haematological disorders after chemotherapy and stem cell transplantation. In: Cochrane Database of Systematic Reviews. 16. Mai 2012, doi:10.1002/14651858.CD004269.pub3 (wiley.com [abgerufen am 9. Juli 2020]).
- Lise J Estcourt, Simon J Stanworth, Carolyn Doree, Sally Hopewell, Marialena Trivella: Comparison of different platelet count thresholds to guide administration of prophylactic platelet transfusion for preventing bleeding in people with haematological disorders after myelosuppressive chemotherapy or stem cell transplantation. In: Cochrane Database of Systematic Reviews. 18. November 2015, doi:10.1002/14651858.CD010983.pub2 (wiley.com [abgerufen am 9. Juli 2020]).
- Bei Brust- und Ovarialkrebs: Kurzzeitfasten macht Chemo wohl wirksamer und verträglicher. In: aerztezeitung.de. Abgerufen am 30. September 2019.
- NDR: Kann Fasten eine Chemotherapie unterstützen? Abgerufen am 30. September 2019.
- Judith Görs: Fasten im Kampf gegen den Krebs. In: n-tv.de. Abgerufen am 30. September 2019.
- Studien: Fasting mimicking diet as an adjunct to neoadjuvant chemotherapy for breast cancer in the multicentre randomized phase 2 DIRECT trial. In: Nature. 23. Juni 2020. Effects of short-term fasting on cancer treatment. In: Journal of Experimental & Clinical Cancer Research. 22. Mai 2019. A review of fasting effects on the response of cancer to chemotherapy. In: Science Direct. 04.2021. Diet and Chemotherapy: The Effects of Fasting and Ketogenic Diet on Cancer Treatment. In: karger.com. 12.2020.
- G. Morgan, R. Ward, M. Barton: The contribution of cytotoxic chemotherapy to 5-year survival in adult malignancies. In: Clin Oncol (R Coll Radiol)., 2004 Dec, 16(8), S. 549–560. PMID 15630849
- E. Segelov: The emperor’s new clothes – can chemotherapy survive? In: Australian Prescriber Februar 2008, Band 29, S. 2–3
- L. Mileshkin, D. Rischin, H. M. Prince, J. Zalcberg: The contribution of cytotoxic chemotherapy to the management of cancer. In: Clin Oncol (R Coll Radiol)., 2005 Jun; 17 (4), S. 294. PMID 15997929
- David Gorski: Does chemotherapy work or not? The "2% gambit". In: ScienceBlogs. 16. September 2011, abgerufen am 26. Juni 2021 (englisch).
- Verbreitung von Krebserkrankungen in Deutschland. (PDF; 1,2 MB) Robert Koch-Institut, 23. Februar 2010, abgerufen am 27. August 2012.