Kaliumpermanganat
Kaliumpermanganat (KMnO4) ist das Kaliumsalz der im freien Zustand nicht vorkommenden Permangansäure HMnO4. Kaliumpermanganat ist ein metallisch glänzender, fast schwarz erscheinender kristalliner Feststoff und ein starkes Oxidationsmittel. Das trockene, nicht allzu feine Pulver aus eher spitzwinkeligen Kristallen schimmert mehr grünlich als violett. Feinster Staub, Abrieb – der Strich, an rauen Flächen anhaftende oder in poröse Materialien eingedrungene Spuren erscheinen wie durch Spuren von Wasser angelöste Teile dunkel violett. Für die intensive Färbung des Salzes und seiner Lösung ist ausschließlich das Permanganat als Kristallgitterbaustein bzw. Anion verantwortlich. Die Farbe ist auf Charge-Transfer-Übergänge zurückzuführen. In Permanganaten liegt das Mangan in seiner höchsten Oxidationsstufe +VII vor.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
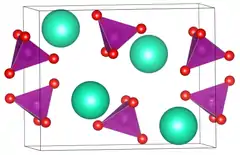 | ||||||||||||||||||||||
| _ K+ _ O2− _ Mn7+ | ||||||||||||||||||||||
| Kristallsystem |
orthorhombisch | |||||||||||||||||||||
| Raumgruppe |
Pnma (Nr. 62) | |||||||||||||||||||||
| Gitterparameter |
a = 9,128 Å, b = 5,728 Å, c = 7,436 Å | |||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Kaliumpermanganat | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | KMnO4 | |||||||||||||||||||||
| Kurzbeschreibung |
violetter geruchloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 158,03 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,70 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt |
Zersetzung oberhalb 240 °C[1] | |||||||||||||||||||||
| Löslichkeit |
mäßig in Wasser (64 g·l−1 bei 20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
0,5 mg·m−3[1] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
Kaliumpermanganat bildet dunkle rot-violett glänzende Kristalle, die mäßig in Wasser löslich sind und schon in geringer Konzentration eine intensiv violette Lösung ergeben. Kristallines Kaliumpermanganat ist bei Raumtemperatur stabil, seine wässrige Lösung zersetzt sich aber mit der Zeit zu Mangan(IV)-oxid und Sauerstoff. Es kristallisiert orthorhombisch, Raumgruppe Pnma (Raumgruppen-Nr. 62), mit den Gitterparametern a = 9,128 Å, b = 5,728 Å, c = 7,436 Å.[3]
Da im Permanganat-Anion das Mangan in seiner höchsten Oxidationsstufe vorliegt, tritt es in Redoxreaktionen als ein sehr starkes Oxidationsmittel auf. So oxidiert Kaliumpermanganat z. B. Salzsäure zu Chlorgas und stellt damit eine Labormethode zur Darstellung von Chlor dar:
Des Weiteren oxidiert es beispielsweise Sulfite und Sulfide zu Sulfaten, Fe(II)- zu Fe(III)-Ionen, Alkohole zu Aldehyden.[4] Es kann auch die Zersetzung organischer Substanzen verursachen.
Kaliumpermanganat zeigt keinen Schmelzpunkt. Es zersetzt sich ab 240 °C zu grünem Kaliummanganat (Kaliummanganat(VI), K2MnO4), Braunstein (MnO2), Kaliumoxid (K2O) und Sauerstoff (O2):[5] Dadurch ist Kaliumpermanganat brandfördernd.
Bei noch höheren Temperaturen zerfällt auch das Kaliummanganat:
Schema der Redoxreaktion von Sulfit mit Permanganat:
Als Komplex mit Kronenethern kann Kaliumpermanganat auch in unpolaren organischen Lösungsmitteln wie Benzol oder Toluol gelöst werden, was in der organischen Synthesechemie ausgenutzt wird.
Herstellung
Die technische Herstellung geht von Mangandioxid MnO2 aus, das mit hochkonzentrierter Kalilauge und Luftsauerstoff bei 250 °C zum grün gefärbten Kaliummanganat(VI) K2MnO4 reagiert. Dieses wird elektrochemisch zu Kaliumpermanganat weiterverarbeitet (anodische Oxidation) und kommt kristallin in den Handel.[6]
Im Labor ist eine gezielte zweistufige Synthese möglich, bei der MnO2 in stark basischem Milieu zuerst (durch z. B. KClO3) zu K2MnO4 oxidiert und anschließend nach dem Disproportionierungsgleichgewicht in KMnO4 und MnO44− überführt wird, welches durch anschließende Hydrolyse in MnO2 und OH− zerfällt und durch Einleiten von CO2 oder die Zugabe verdünnter Schwefelsäure neutralisiert wird.
Disproportionierung:
Durch die Neutralisation wird das Gleichgewicht auf die rechte Seite verschoben, da sich ausfallendes Mangan(IV)-oxid nicht mehr im basischen Milieu lösen kann, was die Ausbeute an Kaliumpermanganat steigert.
Anstatt der durch die Einleitung des CO2 resultierenden Kohlensäure kann auch die äquivalente Menge verdünnter Schwefelsäure verwendet werden.
Verwendung

Wegen der stark oxidierenden Wirkung wird Kaliumpermanganat in einer Vielzahl von Anwendungen eingesetzt:
- Allgemein wird es als Desinfektionsmittel, Deodorant und Algizid verwendet.
- In der quantitativen chemischen Analyse (Oxidimetrie, Manganometrie, eine Redoxtitration) wird es zur Bestimmung einer Vielzahl von Substanzen (beispielsweise Eisen, Nitrit, Oxalat, reduzierende Zucker und indirekt auch Calcium) eingesetzt; hierbei wird der Endpunkt der Bestimmung durch eine bleibende Violettfärbung angezeigt. Im Labor wird alkalische Kaliumpermanganatlösung auch zur Reinigung von Glasgeräten verwendet.
- In der Analogfotografie dient es zum Nachweis von Fixiersalz (Natriumthiosulfat) und als Abschwächer von überbelichteten Bildern; dabei wird das Silber oxidiert.
- Es wird zum Bleichen von Naturschwämmen verwendet, um die typische weißgelbe Farbe zu bekommen. Als Fungizid und Bakterizid ist Kaliumpermanganat zur Behandlung von Obstbäumen, Olivenbäumen und Reben laut EWG-Verordnung auch für den ökologischen Landbau zugelassen.[7]
- Beim Auftropfen von Glycerin auf einen Überschuss des Salzes entzündet sich das Gemisch nach einigen Sekunden bis Minuten[8] und verbrennt mit charakteristischer violetter Flamme. Diese zeitlich verzögert auftretende Reaktion wurde wegen der starken Hitze zum Start von Thermitreaktionen benutzt. Mischungen mit Magnesium- oder Aluminiumpulver reagieren explosionsartig unter grellem Lichtblitz. Mit Glycerin, Ethylenglycol, Mannit, Acetaldehyd und zahlreichen anderen Stoffen erfolgt Selbstzündung.
- Eine mengenmäßig wichtige Anwendung von Kaliumpermanganat erfolgt bei der Herstellung von Saccharin.
- In der organischen Chemie kann Kaliumpermanganat zur Dihydroxylierung von Alkenen genutzt werden. Da es dazu neigt, die gebildeten 1,2-Diole weiterzuoxidieren, sind die Ausbeuten meist schlechter als beispielsweise bei Dihydroxylierung mit Osmium(VIII)-oxid. Allerdings ist Kaliumpermanganat deutlich preiswerter und wesentlich weniger gesundheitsgefährdend, sodass es bei einfachen Synthesen weiterhin zum Einsatz kommt.
- Um Cinnamoylkokain und andere Verunreinigungen aus der Cocapaste zu entfernen, wird Kaliumpermanganat auch bei der Herstellung von Kokain verwendet.[9] Daher ist es in Deutschland im Grundstoffüberwachungsgesetz in der Kategorie 2 aufgelistet; somit sind Herstellung, Ein-, Ausfuhr und Handel ab einer Menge von 100 kg registrierungspflichtig.
- Eine weitere Verwendung findet sich im Beizen von Holz.[10]
- Große Mengen werden beim Bleichen (oxidieren) von Jeans-Farbe verwendet, um einen Vintage-Look zu kreieren.[11]
- In der Medizin wird Kaliumpermanganatlösung als Adstringens und Desinfektionsmittel zur äußerlichen Behandlung der Haut, u. a. bei Fußpilz oder Windeldermatitis, eingesetzt (ATC-Code D08AX06). In der Notfall-Toxikologie wird burgunderfarbene Kaliumpermanganat-Lösung (ca. 0,1 %) für Magenspülungen bei Vergiftungen nach oraler Aufnahme oxidierbarer Gifte eingesetzt.[12]
- Ebenso findet es Verwendung bei der Therapie von parasitären Fischkrankheiten.
- Kaliumpermanganat zerstört Geruchsstoffe und wirkt bakterientötend.
- Bei der Fettsäureherstellung durch Paraffinoxidation wurde Kaliumpermanganat als Oxidationsmittel verwendet.[13]
- Kaliumpermanganat zersetzt Wasserstoffperoxid katalytisch, wobei große Mengen Sauerstoffgas entstehen. Dieses kann zum Antrieb von Turbinen, wie bei der A4-Rakete oder für Verbrennungsmotoren in U-Booten genutzt werden.
Historisches
Kaliumpermanganat wurde zuerst 1659 durch Johann Rudolf Glauber beschrieben.[14] Kaliumpermanganatlösung kam früher als Condy's Fluid durch Henry Bollmann Condy (1826–1907) in den Handel und diente zum Desinfizieren und Bleichen. Die Fotografen früherer Zeit verwendeten Kaliumpermanganat als Bestandteil von Blitzlichtpulvern. Kaliumpermanganat wurde zum Gurgeln bei Halsschmerzen verwendet und im Fleischereigewerbe, um verdorbenem Fleisch den Geruch zu nehmen und es wieder genießbar erscheinen zu lassen. Des Weiteren färbt sich die Haut nach Kontakt mit Kaliumpermanganat-Lösung durch Abscheidung von Braunstein braun; deshalb wurden solche Lösungen auch gezielt als Bräunungsmittel eingesetzt.
 KMnO4-Kristalle
KMnO4-Kristalle KMnO4 in wässriger Lösung
KMnO4 in wässriger Lösung
Sicherheitshinweise
Kaliumpermanganat hat die Wassergefährdungsklasse 3 (stark wassergefährdend), was neben seiner Oxidationswirkung bei der Entsorgung von Permanganatresten zu beachten ist. Kaliumpermanganat ist von nur geringer akuter Toxizität (LD50(Ratte, oral) = 750 mg/kg), besitzt durch seine stark oxidierende Wirkung jedoch eine ausgeprägte Reizwirkung auf lebendes Gewebe, so dass es leicht zu Verätzungen kommt. Jeglicher Kontakt jenseits der medizinischen Anwendung oder gar orale Aufnahme ist also zu verhindern. Permanganatstäube verursachen am Auge eine Trübung der Hornhaut.
Die Verfärbung der Haut selbst, die bei Kontakt auftritt, ist hingegen harmlos und wird durch bei der Reduktion des Permanganats entstehenden Braunstein verursacht. Größere verfärbte Areale lassen sich durch Lösungen von Sulfiten wieder entfärben.
Infolge seiner stark oxidierenden Wirkung reagiert Kaliumpermanganat mit vielen reduzierend wirkenden bzw. brennbaren Stoffen teils sehr heftig; es kann Selbstentzündung eintreten. Mischungen mit solchen Stoffen, die nicht zu spontaner Reaktion führen, sind extrem feuergefährlich und reagieren dann unter Umständen explosionsartig.
Auf Vorschlag der französischen Chemikalienbehörde wurde 2016 die chemikalienrechtliche Einstufung von Kaliumpermanganat überarbeitet. Die französische Behörde beantragte die Einstufung als reproduktionstoxisch Repr 1B. Der Ausschuss für Risikobewertung (RAC) der Europäischen Chemikalienagentur (ECHA) folgte dem Antrag nur teilweise und hat am 9. Dezember 2016 die Einstufung für Kaliumpermanganat wie folgt ergänzt: Kaliumpermanganat wird als reproduktionstoxisch Repr 2 eingestuft. Der zusätzliche Warnhinweis wurde festgelegt auf H361d.[15] Diese Einstufung des RAC muss noch von der EU-Kommission in geltendes Recht umgesetzt werden aber sie stellt mit der Veröffentlichung den Stand des Wissens dar, der von Unternehmen und Behörden berücksichtigt werden muss.
Kaliumpermanganat wurde 2017 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Kaliumpermanganat waren die Besorgnisse bezüglich Verbraucherverwendung und Exposition empfindlicher Bevölkerungsgruppen sowie der möglichen Gefahr durch reproduktionstoxische Eigenschaften. Die Neubewertung fand ab 2017 statt und wurde von Frankreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[16][17]
Weblinks
Einzelnachweise
- Eintrag zu Kaliumpermanganat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2019. (JavaScript erforderlich)
- Eintrag zu Kaliumpermanganat im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 18. November 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- R. Hoppe, D. Fischer, J. Schneider: Zur Kenntnis von Oxyden A[MO4]: Über LiMnO4, KMnO4, RbMnO4, CsMnO4 sowie RbIO4 und CsIO4. (– Was heißt eigentlich “Die Kristallstruktur von …”? –). In: Zeitschrift für anorganische und allgemeine Chemie. 625(7), 1999, S. 1125–1142, doi:10.1002/(SICI)1521-3749(199907)625:7<1135::AID-ZAAC1135>3.0.CO;2-L.
- Eberhard Schweda: Jander/Blasius Anorganische Chemie 1. 17. Auflage. Hirzel Verlag, Stuttgart 2012, ISBN 978-3-7776-2134-0, S. 324.
- Eintrag zu Kaliumpermanganat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juni 2014.
- Arnold Willmes, Taschenbuch Chemische Substanzen, Harri Deutsch, Frankfurt (M.), 2007.
- Verordnung (EG) Nr. 889/2008 Anhang II: Pestizide.
- F. R. Kreißl, O. Krätz, Feuer und Flamme, Schall und Rauch., Wiley-VCH Weinheim, 2. Aufl. 2008, ISBN 978-3-527-32276-3, S. 123 (Eingeschränkte Vorschau in der Google-Buchsuche).
- Kokain und Crack auf der Webseite der EMCDDA, abgerufen am 24. Mai 2014.
- Bernhard Schultz: Farbwarenkunde. Vieweg+Teubner Verlag, Wiesbaden 1953, ISBN 3-322-97907-5, S. 46, doi:10.1007/978-3-322-98438-8_4.
- Kathrin Werner: Jetzt lasert ein Roboter den Gebraucht-Look in die Jeans. In: Tages-Anzeiger, Tages-Anzeiger. (tagesanzeiger.ch [abgerufen am 28. Februar 2018]).
- Lutz Roth, Max Daunderer, Kurt Kormann: Giftpflanzen-Pflanzengifte. Vorkommen, Wirkung, Therapie. 2. Auflage. Ecomed, Landsberg 1988, ISBN 3-609-64810-4, S. 810 ff.
- G. Wietzel: Herstellung synthetischer Fettsäuren durch oxydation von Paraffinischen Kohlenwasserstoffen mit Kolekularem Sauerstoff. In: Chemical Engineering Science. Band 3, 1954, S. 17–IN4, doi:10.1016/S0009-2509(54)80003-0.
- Derek Lowe, Das Chemiebuch, Librero 2017
- RAC-Entscheidung vom 9. Dezember 2016
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Potassium permanganate, abgerufen am 26. März 2019.




