Chlorate
Chlorate sind Salze der Chlorsäure HClO3. Sie enthalten als Anion das Chlorat-Ion (ClO3−).[1] Chlor weist dabei die Oxidationszahl +5 auf. Wichtige Chlorate sind Natriumchlorat, Aluminiumchlorat und Kaliumchlorat.
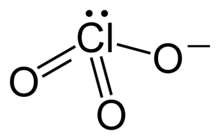
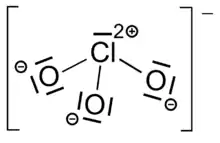
Die meisten Chlorate sind starke und spontan reagierende Oxidationsmittel. Gemische von Chloraten mit Reduktionsmitteln wurden früher auch als Explosivstoffe und Zündmittel (siehe Chloratsprengstoffe) verwendet. Heute werden sie hierzu wegen ihrer Reibungsempfindlichkeit und der Tendenz zur Spontanreaktion nicht mehr eingesetzt.[2]
Natrium- und Kaliumchlorat wurden in der Vergangenheit als Unkrautbekämpfungsmittel eingesetzt[3]. Die Rückstands-Höchstgehalte in Lebensmitteln/Erzeugnissen sind europaweit in der geänderten Verordnung (EG) Nr. 396/2005 geregelt[4].
Bindungsstruktur
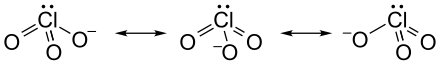
Durch die Lewisschreibweise wird meist nur eine mesomere Grenzstruktur des Chlorat-Ions dargestellt. Tatsächlich sind alle Cl-O Bindungen identisch, was durch die gleiche Länge aller Bindungen zum Ausdruck kommt (für Kaliumchlorat beispielsweise 1,49 Å[5])
Siehe auch
Einzelnachweise
- Brockhaus ABC Chemie. VEB F. A. Brockhaus Verlag Leipzig 1965, S. 242.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 1: A–Cl. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1979, ISBN 3-440-04511-0, S. 714.
- Der Eintrag von Chlorat in die Nahrungskette sollte reduziert werden. Bundesinstitut für Risikobewertung, abgerufen am 23. Juni 2020.
- Verordnung (EU) 2020/749 der Kommission vom 4. Juni 2020 zur Änderung des Anhangs III der Verordnung (EG) Nr. 396/2005 des Europäischen Parlaments und des Rates hinsichtlich der Höchstgehalte an Rückständen von Chlorat in oder auf bestimmten Erzeugnissen
- J. Danielsen, A. Hazell, F. K. Larsen: The structure of potassium chlorate at 77 and 298 K. In: Acta Cryst.. B37, 1981, S. 913–915. doi:10.1107/S0567740881004573.