BINAP
BINAP [2,2′-Bis(diphenylphosphino)-1,1′-binaphthyl] ist ein bidentater Diphosphinligand mit axialer Chiralität, dessen reines (R)- oder (S)-Enantiomer in einer Vielzahl Übergangsmetall-katalysierter Reaktionen, speziell asymmetrische Hydrierungen, außergewöhnliche Eigenschaften bezüglich Enantioselektivität und Aktivität zeigt. Erstmals wurde BINAP 1980 von Noyori et al. vorgestellt.[3] Bis dato ist BINAP einer der wenigen Liganden, die industrielle Bedeutung besitzen, z. B. im Takasago-Menthol-Prozess.[4]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
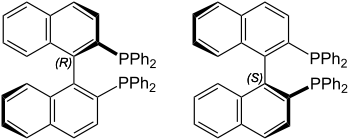 | ||||||||||||||||
| (R)-BINAP (links) und (S)-BINAP (rechts) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | BINAP | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C44H32P2 | |||||||||||||||
| Kurzbeschreibung |
Weißer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 622,67 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Hergestellt wird BINAP aus BINOL durch Umsetzung mit Bromtriphenylphosphoniumbromid zur entsprechenden Dibromverbindung und anschließende Umsetzung mit Magnesium zu einem Di-Grignard-Reagenz, welches schließlich mit ClPPh2 zu BINAP reagiert.[5]
Einzelnachweise
- Datenblatt BINAP bei Acros, abgerufen am 25. Dezember 2019.
- Datenblatt (S)-(-)-2,2'-Bis(diphenylphosphino)-1,1'-binaphthyl, 97% bei AlfaAesar, abgerufen am 7. Dezember 2019 (PDF) (JavaScript erforderlich).
- A. Miyashita, A. Yasuda, H. Takaya, K. Toriumi, T. Ito, T. Souchi, R. Noyori, J. Am. Chem. Soc. 102, 1980, S. 7932–7934.
- Russell E. Malz: Catalysis of organic reactions. Marcel Dekker New York 1996, ISBN 0-8247-9807-4 (eingeschränkte Vorschau in der Google-Buchsuche), S. 147.
- Reinhard Brückner: Reaktionsmechanismen, 1. Auflage, Spektrum Akademischer Verlag, Berlin 1996, S. 194–195, 185–186.
