Natriumperoxid
Natriumperoxid ist das Peroxid des Natriums und Salz des Wasserstoffperoxides. Es besitzt die Summenformel Na2O2.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
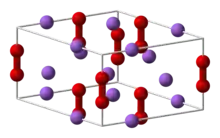 | |||||||||||||||||||
| _ Na+ _ O− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumperoxid | ||||||||||||||||||
| Verhältnisformel | Na2O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 77,98 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Natriumperoxid wurde erstmals im Jahre 1811 von J.L. Gay-Lussac und L.J. Thénard durch Verbrennen von Natrium hergestellt.[5] Der erste industrielle Herstellprozess wurde 1891 von H. Castner als sogenannter Blockprozess entwickelt und ab 1899 bei der Degussa in Rheinfelden durchgeführt.[5] Ab 1928 wurde ein kontinuierliches Verfahren in einem Drehrohrofen eingeführt.[6][5]
Darstellung und Gewinnung
Die technische Herstellung von Natriumperoxid erfolgt durch die Verbrennung von Natrium in einer Luftatmosphäre.
Die Reaktion verläuft mit −511,2 kJ·mol−1 (Na2O2) stark exotherm.[5] Das Verfahren wird zur Vermeidung lokaler Überhitzungen, die den Zerfall des gebildeten Produktes bewirken würde, im Gegenstromprinzip durchgeführt. Frisches Natrium trifft dabei auf eine sauerstoffärmere, verbrauchte Luft, wobei zunächst bei Temperaturen zwischen 150 °C und 200 °C eine Oxidation zum Natriumoxid erfolgt. Bei diesem Schritt wird mit −431,6 kJ·mol−1 (Na2O) der größte Teil der Gesamtreaktionswärme freigesetzt.[5]
Dieses wird dann mit frischer Luft bei 350 °C zum Zielprodukt weiter umgesetzt.[3] Hier werden noch −79,6 kJ·mol−1 (Na2O2) freigesetzt.[5]
Im Labor lässt sich das Peroxid als Octahydrat durch Fällung einer konzentrierten Natriumhydroxidlösung mit Wasserstoffperoxid darstellen[7]:
Eigenschaften
Natriumperoxid ist ein farbloses Pulver, welches durch eine Verunreinigung mit gelbem Natriumoxid auch gelblich gefärbt sein kann. Die Verbindung ist bis 500 °C thermisch stabil und lässt sich bei 675 °C nahezu unzersetzt schmelzen. Es ist stark hygroskopisch. Mit Wasser reagiert es zu Natriumhydroxid und Wasserstoffperoxid.[3]
Diese Reaktion verläuft stark exotherm, so dass es bei unzureichender Kühlung zu einem Temperaturanstieg in einen Temperaturbereich kommen kann, in dem sich das Produkt Wasserstoffperoxid zersetzt. Dabei wird eine lebhafte Sauerstoffentwicklung beobachtet.[3]
Die Verbindung ist ein starkes Oxidationsmittel, welches mit oxidierbaren Stoffen, wie Schwefel, Kohlenstoff oder Aluminiumpulver explosionsartig reagieren kann.[3]
Die Verbindung hat eine hexagonale Kristallstruktur mit der Raumgruppe P62m (Raumgruppen-Nr. 189).[8] Die Standardbildungsenthalpie von Natriumperoxid beträgt ΔHf0 = −513 kJ/mol.[9] Es existieren weiterhin mit dem Dihydrat Na2O2·2H2O und dem Oktahydrat Na2O2·8H2O zwei Hydrate, ein Diperhydrat Na2O2·2H2O2 und ein gemischtes Hydrat-Perhydrat Na2O2·2H2O2·4H2O.[5]
Verwendung
In der Industrie wird Natriumperoxid als Oxidations- und Bleichmittel verwendet. Ausgedehnte Anwendung findet die Verbindung in der Textil- und Papierbleiche.[2] Die in wässriger Lösung vorhandene Natronlauge wird durch den Zusatz von Schwefelsäure neutralisiert bzw. mittels Magnesiumsulfat ausgefällt.[3] Es findet unter anderem zur CO2-Absorption und Sauerstoffproduktion (z. B. in Atemschutzgeräten, U-Booten oder Raumstationen) Verwendung.[2] In der Raumfahrt wird allerdings das leichtere Lithiumperoxid bevorzugt.[3]
In der organischen Synthese dient es als Reagenz zur Epoxidierung von α,β-ungesättigten Carbonylverbindungen[10][2] und bei der direkten Sulfonierung von Methan mittels Schwefeltrioxid bei der Herstellung von Methansulfonsäure.[11][2]
Im Kationentrennungsgang kann Natriumperoxid anstelle der Mischung Natronlauge/Wasserstoffperoxid zum alkalischen Sturz verwendet werden.[12]
Siehe auch
Einzelnachweise
- Eintrag zu Natriumperoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Natriumperoxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Januar 2017.
- E. Wiberg, N. Wiberg, A.F. Holleman: Anorganische Chemie. 103. Auflage. Walter de Gruyter, Berlin/ Boston 2017, ISBN 978-3-11-026932-1, S. 602, (abgerufen über De Gruyter Online).
- Eintrag zu Disodium peroxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- H. Jakob, S. Leininger, T. Lehmann, S. Jacobi, S. Gutewort: Inorganic Peroxo Compounds. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH, Weinheim 2012. doi:10.1002/14356007.a19_177.pub2.
- Patent US 1 685 520 (Roessler & Hasslacher Chemical, 1928); Patent US 7 796 241 (Roessler & Hasslacher Chemical, 1931).
- R. A. Penneman: Sodium proxide 8-hydrate. In: Ludwig F. Audrieth (Hrsg.): Inorganic Syntheses. Band 3. McGraw-Hill, Inc., 1950, S. 1–3 (englisch).
- Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Band III: Elemente, anorganische Verbindungen und Materialien, Minerale. begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 614 (eingeschränkte Vorschau in der Google-Buchsuche).
- E. Wiberg, N. Wiberg, A.F. Holleman: Anorganische Chemie. 103. Auflage. Walter de Gruyter, Berlin/ Boston 2017, ISBN 978-3-11-026932-1, S. 1515, (abgerufen über De Gruyter Online).
- V. K. Reddy, B. Haritha, M. Yamashita: Highly Diastereoselective Epoxidation of α,β-Unsaturated Carbonyl Compounds Using Sodium Peroxide. In: Lett. Org. Chem. 2, 2005, S. 128–131. doi:10.2174/1570178053202964.
- S. Mukhopadhyay, A. T. Bell: Direct Liquid-Phase Sulfonation of Methane to Methanesulfonic Acid by SO3 in the Presence of a Metal Peroxide. In: Angew. Chem. 115, 2005, S. 1049–1051. doi:10.1002/ange.200390235.
- Blasius Jander: Lehrbuch der analytischen und präparativen Anorganischen Chemie. 14. Auflage. S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0612-X, S. 561–567.

