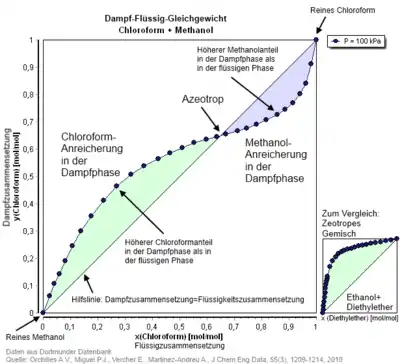
Azeotrop
Ein Azeotrop oder azeotropes Gemisch (griechisch a- „nicht“, zeo- „siedend“, tropos „Wendung“, hier im Sinne von „Änderung“) ist eine aus zwei oder mehr chemischen Verbindungen bestehende Flüssigkeit, deren Dampfphase dieselbe Zusammensetzung hat wie die flüssige Phase. Das Gemisch hat einen konstanten Siedepunkt und lässt sich nicht durch einfache Destillation trennen; es verhält sich also wie ein Reinstoff. Azeotropie ist das Gegenteil von Zeotropie.
Physikalischer Hintergrund
In azeotropen Gemischen berühren sich im p-x-Phasendiagramm die Siede- und die Kondensationskurven der Komponenten im azeotropen Mischungsverhältnis. Im x-y-Diagramm wird die x=y-Linie geschnitten (siehe Abbildung).
Azeotrope bilden sich, wenn die Partialdampfdrücke der Komponenten einer Mischflüssigkeit stark von den sich für eine ideale Mischung aus dem Raoultschen Gesetz ergebenden Dampfdrücken abweichen. Zwei Komponenten (z. B. HCl und H2O), die miteinander stärkere Wechselwirkungen als im Reinstoff aufweisen, bilden ein Azeotrop mit Dampfdruckminimum/Siedepunktsmaximum; der Zusammenhalt zwischen einem HCl- und einem H2O-Molekül ist jeweils größer als zwischen zwei H2O-Molekülen oder zwei HCl-Molekülen. Zwei Komponenten, wie Ethanol und Wasser, die untereinander schwächere Wechselwirkungen aufweisen als in den Reinstoffen, bilden ein Azeotrop mit Dampfdruckmaximum bzw. Siedepunktsminimum. Dies tritt typischerweise auf, wenn sich die Komponenten in ihrer Polarität deutlich unterscheiden.
Substanzen, die sich sehr ähnlich sind, wie die unterschiedlichen Alkane, bilden keine Azeotrope und können destillativ sauber getrennt werden. Auch Gemische von schwerem und leichtem Wasser lassen sich, über eine Kolonne mit entsprechend vielen Böden, trotz des kleinen Abstandes der Siedepunkte destillativ trennen.
Azeotroptypen
Druckminimum oder Druckmaximum
Man unterscheidet zwei unterschiedliche Arten von Azeotropen:
- Das positive Azeotrop entspricht im p,x-Diagramm dem Stoffgemisch am Maximum des Dampfdrucks. Der Siedepunkt dieses Gemisches besitzt im T,x-Diagramm ein Minimum und liegt unter denjenigen der beteiligten Reinstoffe. Beispiele dafür sind die Systeme Ethanol/Wasser und Wasser/1,4-Dioxan.
- Das negative Azeotrop entspricht im p,x-Diagramm dem Stoffgemisch am Minimum des Dampfdrucks. Der Siedepunkt dieses Gemisches besitzt im T,x-Diagramm ein Maximum und liegt über denjenigen der beteiligten Reinstoffe. Ein Beispiel dafür ist das System Wasser/Salpetersäure.
 Druckmaximum-Azeotrop Chloroform/Methanol
Druckmaximum-Azeotrop Chloroform/Methanol
P,x,y-Diagramm, T = 20 °C Druckminimum-Azeotrop
Druckminimum-Azeotrop
2-Butanon/1,2-Dichlorethan
P,x,y-Diagramm, T = 60 °C
Heteroazeotrop oder homogenes Azeotrop
Bei Komponenten, die sich nicht vollständig ineinander lösen, kann ein Azeotrop in der Mischungslücke liegen. In diesem Fall wird von einem Heteroazeotrop gesprochen. Für den Fall, dass die azeotrope Zusammensetzung sich im mischbaren Bereich befindet, oder die Komponenten beliebig mischbar sind, wird von einem homogenen Azeotrop gesprochen.
 Dampf-Flüssig-Gleichgewicht
Dampf-Flüssig-Gleichgewicht
Wasser/1-Pentanol Flüssig-Flüssig-Gleichgewicht
Flüssig-Flüssig-Gleichgewicht
Wasser/1-Pentanol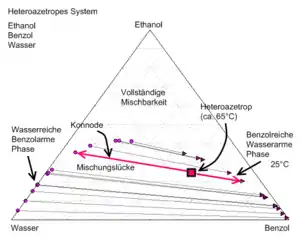 Dampf-Flüssig-Gleichgewicht
Dampf-Flüssig-Gleichgewicht
Wasser-Ethanol-Benzol
Bei einem Heteroazeotrop haben die Flüssigkeit und der Dampf nicht die gleiche Zusammensetzung, da die flüssige Phase bei der azeotropen Zusammensetzung instabil ist und in zwei Phasen zerfällt. Diese Eigenschaft wird bspw. bei der Azeotroprektifikation benutzt, um ein azeotropes Gemisch durch einen Flüssig-Flüssig-Phasenscheider zu trennen.
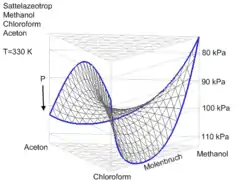
Sattelazeotrop
(berechnet mit mod. UNIFAC)
Ein Sattelazeotrop tritt nur in ternären und höheren Gemischen auf. Es zeichnet sich dadurch aus, dass das ternäre (oder höhere) Azeotrop zwischen den Siedepunkten der reinen Stoffe liegt und damit weder ein Druckmaximum- noch ein Druckminimumazeotrop bildet.
Ein typisches Beispiel ist das ternäre Gemisch aus Chloroform, Methanol und Aceton. Das ternäre Azeotrop liegt dabei bei
| T / K | P / kPa | xAceton | xChloroform | xMethanol | Quelle |
|---|---|---|---|---|---|
| 331,02 | 101,325 | 0,316 | 0,238 | 0,446 | [1] |
In diesem System bilden auch alle binären Subsysteme Azeotrope, Aceton/Chloroform ein Druckminimum-, Aceton/Methanol und Methanol/Chloroform ein Druckmaximumazeotrop.
Die Bezeichnung „Sattelazeotrop“ leitet sich direkt aus der Form des dreidimensional gezeichneten Dampf-Flüssigkeit-Gleichgewichts ab.
Physikalische Trennverfahren für Azeotrope
Da azeotrope Gemische aus Bestandteilen mit recht unterschiedlichen Eigenschaften bestehen (s. o.), lassen sie sich meist leicht durch andere gängige Trennmethoden außer Destillation auftrennen. Beispiele wären Chromatographie, Zugabe geeigneter Molekularsiebe oder Trockenmittel wie Magnesiumsulfat, Auskristallisieren einer Komponente bei niedrigen Temperaturen. Durch Druckänderung kann die Zusammensetzung des Azeotropes in die gewünschte Richtung verändert werden.
Azeotrope Rektifikation
Beim mehrfachen Destillieren eines Ethanol-Wasser-Gemisches erhält man ein Azeotrop aus ca. 96 % Ethanol und 4 % Wasser, das durch Destillation nicht weiter zu trennen ist und bei 78,17 °C siedet.
Durch Zusatz einer dritten Komponente kann dieses Azeotrop jedoch getrennt werden. So bildet das Wasser-Ethanol-Gemisch durch Zugabe von Benzol ein Azeotrop mit drei Komponenten (ein ternäres Azeotrop), das bei 64,9 °C siedet. Nun kann dieses Wasser-Benzol-Ethanol-Gemisch abdestilliert und somit das Wasser nach und nach aus der flüssigen Phase ausgeschleppt werden. Zurück bleibt ein Benzol-Ethanol-Gemisch, von dem sich das Benzol durch normale Destillation abtrennen lässt, sodass man wasserfreies Ethanol erhält.
Dampfpermeation und Pervaporation
Eine weitere Möglichkeit, ein azeotropes Ethanol-Wasser-Gemisch zu trennen, ist die Dampfpermeation. Dabei wird das Gemisch verdampft und durch eine Membraneinheit geführt. Die Membran funktioniert wie ein Filter, d. h., deren Poren lassen nur eine Komponente passieren – hier also das Wasser. Treibende Kraft für die Trennung des Gemisches ist ein Druckunterschied zwischen dem Innenraum und dem Außenraum und die Selektivität der Membran. Somit tritt das Wasser durch die Membran durch (Permeat) und das wasserfreie Ethanol bleibt auf der anderen Seite der Membran (Retentat). So kann man Ethanol mit einer Reinheit von bis zu 99,97 % erhalten.
Im Unterschied zur Dampfpermeation wird bei der Pervaporation das flüssige Gemisch an der Membran vorbeigeführt.
Azeotrope Destillation
Die Bildung von Azeotropen kann genutzt werden, um einen Stoff aus einem Gemisch „herauszuschleppen“. Beispielsweise wird in der chemischen Reaktionstechnik zur Abtrennung von Wasser aus einem Reaktionsgemisch häufig Toluol als Schleppmittel eingesetzt. Toluol bildet mit Wasser ein Minimum-Azeotrop. Im Kondensat entmischen sich die beiden Flüssigkeiten wieder und bilden zwei Phasen. Das Toluol, die obere Phase, wird durch einen Wasserabscheider im Kreislauf der Reaktion wieder zugeführt. Das Wasser wird abgetrennt, und anhand der gebildeten Wassermenge kann der Reaktionsverlauf beobachtet werden.
Siehe auch
- Dortmunder Datenbank – Datenbank für azeotrope und zeotrope Systeme
Weblinks
- Azeotrope, Nichtideale Mischungen. (PDF; 139 kB) Uni Paderborn, auf Server der Uni Heidelberg
- Chemgapedia (Animation)
Einzelnachweise
- H. Lang: Über das Siedegleichgewicht des Systems Methanol-Aceton-Chloroform. In: Z.Phys.Chem.(Leipzig). 196, 1950, S. 278–297.