Nitromethan
Nitromethan, CH3NO2, ist die einfachste organische Nitroverbindung. Die Verbindung ist der einfachsubstituierte Vertreter der Reihe der Nitromethane mit Nitromethan, Dinitromethan, Trinitromethan und Tetranitromethan. Es ist ein Nitroalkan und ein Konstitutionsisomer der Carbamidsäure.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
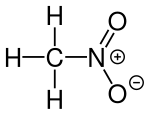 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nitromethan | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | CH3NO2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 61,04 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,14 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
101 °C[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Dipolmoment |
3,1 D[6] | |||||||||||||||
| Brechungsindex |
1,38056[6] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 100 ml·m−3 bzw. 250 mg·m−3[8] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
| Nitromethan | |
|---|---|
| Kurzbeschreibung | Ottokraftstoff für Renn- und Hochleistungsmotoren |
| Eigenschaften | |
| Aggregatzustand | flüssig |
| Heizwert |
11,3 MJ·kg−1[9] |
| Flammpunkt |
36 °C[3] |
| Zündtemperatur | 415 °C[3] |
| Explosionsgrenze | 7,1–63 Vol.-%[3] |
| Temperaturklasse | T2[3] |
| Explosionsklasse | IIA[3] |
| Sicherheitshinweise | |
| UN-Nummer |
1261[3] |
| Gefahrnummer |
33[3] |
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |
Darstellung und Gewinnung
Im Labor liefert die Reaktion von Natriumchloracetat mit Natriumnitrit oder von Brommethan mit Silbernitrit Nitromethan. Die technische Gewinnung erfolgt durch Nitrierung von Methan[10] oder durch Gasphasennitrierung von Propan, wobei es zu etwa 25 % im resultierenden Nitroalkangemisch enthalten ist.[11]
Eigenschaften
Chemische Eigenschaften
Nitromethan besitzt aufgrund der elektronenziehenden Nitrogruppe (–I- und –M-Effekt) eine relativ starke CH-Acidität an der Methylgruppe. Folglich kann es durch starke Basen (hier als B– dargestellt) deprotoniert werden, wobei ein resonanzstabilisiertes Carbanion gebildet wird:

Nitromethan ist eine farblose, schwach riechende, leicht entzündliche Flüssigkeit mit einem Schmelzpunkt von −29 °C und Normaldrucksiedepunkt von 100,8 °C. Nitromethan ist mit Wasser nur begrenzt mischbar. Mit zunehmender Temperatur steigen die Löslichkeiten von Nitromethan in Wasser und von Wasser in Nitromethan.[12]
Löslichkeiten zwischen Nitromethan und Wasser[12] Temperatur °C 0 9,5 19,7 31,0 40,4 50,0 60,5 70,5 80,2 89,8 Nitromethan in Wasser in Ma-% 9,0 9,7 10,4 11,7 12,8 14,8 15,1 17,1 19,6 20,8 Wasser in Nitromethan in Ma-% 1,10 1,44 1,91 2,50 3,65 5,8 6,13 7,92 8,18 10,42
Das 1H-NMR-Spektrum zeigt nur ein einziges Signal bei 4,28 ppm für die C-H-Funktion.[13] Dies ist eine signifikante Verschiebung gegenüber Methan mit 0,23 ppm.[13] Für die Verbindung können zwei tautomere Strukturen formuliert werden. Neben dem Nitrotautomer existiert noch ein Nitronsäuretautomer. Das Gleichgewicht liegt allerdings praktisch auf der Seite des Nitrotautomers. Quantenchemische Berechnungen ergeben eine Differenz der freien Enthalpie von 59,8 kJ·mol−1 zur Nitronsäurestruktur.[14] Die Salzbildung in Gegenwart von Alkalilaugen wie Natronlauge führt zu den entsprechenden Nitronsäuresalzen.[11]

Die Dämpfe wirken auf das Zentralnervensystem, längere Exposition oder Verschlucken führen zu Leber- und Nierenschäden.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion nach Antoine ergibt sich zu log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,11350, B = 1229,574 und C = −76,221 im Temperaturbereich von 404,9 bis 476 K[15] bzw. mit A = 4,40542, B = 1446,196 und C = −45,633 im Temperaturbereich von 328,86 bis 409,5 K.[16]
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−113 kJ·mol−1[17] −81 kJ·mol−1[18] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −709,6 kJ·mol−1[17] | als Flüssigkeit |
| Wärmekapazität | cp | 105,98 J·mol−1·K−1 (25 °C)[19] 1,74 J·g−1·K−1 (25 °C)[19] |
als Flüssigkeit |
| Kritische Temperatur | Tc | 588 K[20] | |
| Kritischer Druck | pc | 63,1 bar[20] | |
| Kritische Dichte | ρc | 5,77 mol·l−1[20] | |
| Schmelzenthalpie | ΔfH0 | 9,703 kJ·mol−1[19] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 | 33,99 kJ·mol−1[21] | beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 53,33 kJ/mol, β = 0,2732 und Tc = 588 K im Temperaturbereich zwischen 318 K und 374 K beschreiben.[21]
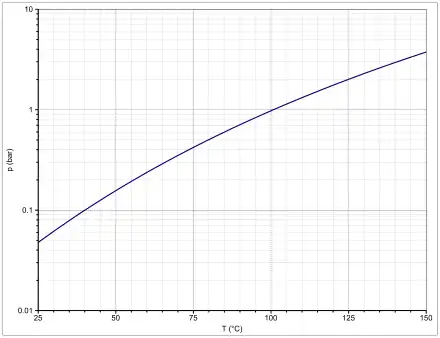
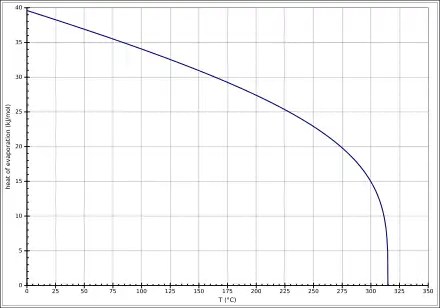
Sicherheitstechnische Kenngrößen
Nitromethan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 36 °C.[22] Der Explosionsbereich liegt zwischen 7,1 Vol.‑% (180 g/m3) als untere Explosionsgrenze (UEG) und 63 Vol.‑% (1600 g/m3) als obere Explosionsgrenze (OEG).[22] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von 33 °C sowie einen oberen Explosionspunkt von 86 °C. Die Grenzspaltweite wurde mit 1,11 mm bestimmt.[22] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[22] Die Zündtemperatur beträgt 415 °C.[22] Der Stoff fällt somit in die Temperaturklasse T2. Die elektrische Leitfähigkeit ist mit 5·10−7 S·m−1 eher gering.[23]
Bei der Handhabung sind Sicherheitsregeln zu beachten, da Nitromethan detonationsfähig ist. Zwar ist die mechanische Empfindlichkeit sehr gering, im unreinen Zustand oder als Mischung mit anderen Stoffen, zum Beispiel Aminen, kann jedoch die Empfindlichkeit erhöht sein. Wichtige Explosionskennzahlen sind:
- Explosionswärme: 1026 kJ·kg−1 (H2O (g)).[24]
- Detonationsgeschwindigkeit: 6210 m·s−1 bei der Dichte von 1,14 g·cm−3[24]
- Normalgasvolumen: 1102 l·kg−1.[24]
- Spezifische Energie: 1245 kJ·kg−1[24]
- Bleiblockausbauchung: 430 ml/10 g[24]
- Stahlhülsentest: negativ, Grenzdurchmesser <1 mm[25][26]
Gemische von Nitromethan mit Methanol sind ebenfalls detonationsfähig. Die Detonationsgeschwindigkeit sinkt mit zunehmenden Methanolanteil linear ab und sinkt bei einem Anteil von 35 % Methanol auf 5,08 km/s.[27]
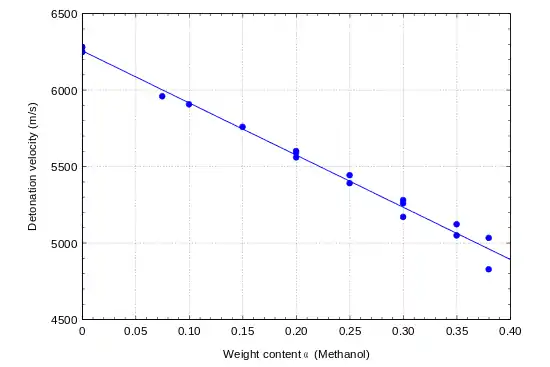
Verwendung
Nitromethan wird als Lösungsmittel für die Spektroskopie und Hochleistungsflüssigkeitschromatographie, zur Herstellung von Raketentreibstoffen, Explosivstoffen (PLX, ANNM), Insektiziden und als Zusatz für Ottokraftstoffe verwendet.
In der organischen Chemie ist es ein nützliches Reagenz, da es sich leicht deprotonieren lässt und in dieser Form Reaktionen wie etwa die Nitro-Aldolreaktion, auch Henry-Reaktion genannt, eingeht, durch die sich leicht aliphatische Nitroverbindungen herstellen lassen.
Die Verwendung als Rennkraftstoff ist sowohl historisch als auch aktuell die wichtigste Verwendung.
Historische Verwendung
Erste belegte Anwendung als leistungssteigerndes Kraftstoffadditiv für Verbrennungsmotoren findet Nitromethan 1950, als Rodger Ward, ein US-amerikanischer Rennfahrer, eine Reihe überraschender Rennsiege erringt. Vic Edelbrock, zuständig für das Motorentuning, hatte in Versuchsreihen mit unterschiedlichen Nitromethananteilen im Benzin eine erhebliche Leistungssteigerung der Motoren erzielt. Allerdings benötigten sie langwierige Anpassungen, um mit diesem Kraftstoff Renndistanz zu überstehen.[28][29]
Heutige Verwendung
Im Modellbau werden für RC-Cars und Flugmodelle meist Glühzündermotoren mit Methanol/Nitromethan-Gemisch eingesetzt. Nitromethan verbessert die Leistung der Motoren und wirkt gleichzeitig kühlend, wobei die Kühlung des Motors schwächer ist als die Erhitzung durch die Leistungssteigerung.
Im Motorsport wird ein Gemisch aus Methanol mit bis zu 85 % Nitromethan für die Top-Fuel-Dragster-Fahrzeugklasse als Treibstoff verwendet. Dabei kommen PKW-Ottomotoren zum Einsatz, für die der Modifikationsaufwand vergleichsweise gering ist. Weitergehende Umstellungen der Kennlinie, wie etwa bei reiner Methanol-Feuerung, sind hier nicht erforderlich. Mit reinem Nitromethan ist etwa die doppelte Leistung eines mit Benzin betriebenen Motors möglich, mit entsprechend höherer thermischer und mechanischer Belastung.[30]
Einschränkungen in der EU
Seit dem 1. Februar 2021 wurden nitromethanhaltige Kraftstoffe, die bei Hochleistungsmodellfahr- und flugzeugen benötigt werden, mit einem Nitromethangehalt von mehr als 16 % verboten. Restbestände müssen bis spätestens 31. Januar 2022 aufgebraucht werden.[31] Ziel des Verbots ist es, Terroristen und Attentäter von der Herstellung von Explosivstoffen abzuhalten; gleichwohl dass die frei verkäuflichen Konzentrationen ohnehin auf Grund ihrer hohen Verdünnung vollkommen ungeeignet dafür wären.
Einzelnachweise
- Eintrag zu NITROMETHANE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- Datenblatt Nitromethan (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Nitromethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- F. A. Carey, R. J. Sundberg: Organische Chemie. VCH, Weinheim 2004, ISBN 3-527-29217-9.
- W. S. Matthews u. a.: Equilibrium Acidities of Carbon Acids. VI. Establishment of an Absolute Scale of Acidities in Dimethyl Sulfoxide Solution. In: J. Am. Chem. Soc. 97, 1975, S. 7006–7014 (siehe auch Bordwell pKa Table (Acidity in DMSO)).
- Eintrag zu Nitromethan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2014.
- Eintrag zu Nitromethane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-52-5 bzw. Nitromethan), abgerufen am 2. November 2015.
- Richard van Basshuysen: Handbuch Verbrennungsmotor. 5. Auflage. Vieweg+Teubner, Stuttgart 2010, ISBN 978-3-8348-0699-4. (eingeschränkte Vorschau in der Google-Buchsuche).
- S. Hauptmann, J. Gräfe, H. Remane: Lehrbuch der Organischen Chemie. Deutscher Verlag für Grundstoffindustrie, Leipzig 1980, S. 480.
- Brockhaus ABC Chemie. Band 2. F.A. Brockhaus Verlag, Leipzig 1971, S. 951.
- R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols. In: J. Chem. Eng. Data. 37, 1992, S. 80–95, doi:10.1021/je00005a024.
- W. Hofmann, L. Stefaniak, T. Urbanski, M. Witanowski: Proton Magnetic Resonance Study of Nitroalkanes. In: Journal of the American Chemical Society. Band 86, Nr. 4, 1964, S. 554–558, doi:10.1021/ja01058a005.
- H. Brand, J. F. Liebman, A. Schulz: Cyano-, Nitro- and Nitrosomethane Derivatives: Structures and Gas-Phase Acidities. In: European Journal of Organic Chemistry. Band 2008, Nr. 27, 2008, S. 4665–4675, doi:10.1002/ejoc.200800583.
- H. A. Berman, E. D. West: Density and Vapor Pressure of Nitromethane 26° to 200 °C. In: Journal of Chemical & Engineering Data. Band 12, Nr. 2, 1967, S. 197–199, doi:10.1021/je60033a011.
- J. P. McCullough, D. W. Scott, R. E. Pennington, I. A. Hossenlopp, G. Waddington: Nitromethane: The Vapor Heat Capacity, Heat of Vaporization, Vapor Pressure and Gas Imperfection; the Chemical Thermodynamic Properties from 0 to 1500 K. In: Journal of the American Chemical Society. Band 76, Nr. 19, 1954, S. 4791–4796, doi:10.1021/ja01648a008.
- N. D. Lebedeva, V. L. R. Ryadenko: Enthalpies of Formation of Nitroalkanes. In: Russian Journal of Physical Chemistry (Engl. Transl.). Band 47, 1973, S. 1382.
- Yu. K. Knobel, E. A. Miroshnichenko, Yu. A. Lebedev: Heats of Combustion of Nitromethane and Dinitromethane; Enthalpies of Formation of Nitromethyl Radicals and Energies of Dissociation of Bonds in Nitro Derivatives of Methane. In: Bulletin of the Academy of Sciences of the USSR, Division Chemical Science. Band 20, Nr. 3, 1971, S. 425–428, doi:10.1007/BF00852023.
- W. M. Jones, W. F. Giauque: The Entropy of Nitromethane. Heat Capacity of Solid and Liquid. Vapor Pressure, Heats of Fusion and Vaporization. In: Journal of the American Chemical Society. Band 69, Nr. 5, 1947, S. 983–987, doi:10.1021/ja01197a001.
- D. N. Griffin: The Critical Point of Nitromethane. In: Journal of the American Chemical Society. Band 71, Nr. 4, 1949, S. 1423–1426, doi:10.1021/ja01172a079.
- V. Majer, V. Svoboda: Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Blackwell Scientific Publications, Oxford 1985, S. 300.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10. Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7.
- Klapötke, T.M.: Energetic Materials Encyclopedia, Vol. E–N, Walter de Gruyter GmbH Berlin/Boston 2021, ISBN 978-3-11-067242-8, S. 707–723.
- Klapötke, T.M.; Wahler, S.: Approximate estimation of the critical diameter in Koenen tests in Z. Naturforsch. B 76 (2021) 1219–1229, doi:10.1515/znb-2021-0063.
- S. A. Koldunov, A. V. Ananin, V. A. Garanin, V. A. Sosikov, S. I. Torunov: Detonation Parameters of Nitromethane/Methanol Mixtures. In: Central European Journal of Energetic Materials. Band 6, Nr. 1, 2009, S. 7–14 (waw.pl [PDF]).
- Nitromethane: Top-Fuel Drag Racing’s Soup of Choice. DragTimes, abgerufen am 29. Mai 2012.
- Jeff Hartmann: High-Performance Automotive Fuels & Fluids. ISBN 0-7603-0054-2.
- Helmut Hütten: Schnelle Motoren seziert und frisiert. 6. Auflage. Schmidt, Braunschweig 1977, ISBN 3-87708-060-X.
- EU verbietet Nitromethan-Treibstoffe. In: Deutscher Modellflieger Verband e.V. 15. Februar 2021, abgerufen am 16. Juni 2021 (deutsch).
Literatur
- A. Makovky, L. Lenji: Nitromethane – Physical properties, thermodynamics, kinetics of decomposition, and utilization as fuel. In: Chem. Rev. 58, 1958, S. 627–643, doi:10.1021/cr50022a002. (Übersichtsartikel)


