Folsäure
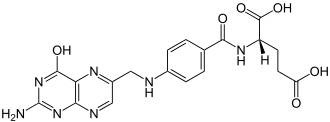
Die Folsäure (von lateinisch folium „Blatt“, wegen des Vorkommens in grünen Pflanzenblättern), auch Vitamin B9, Vitamin M, Vitamin B11 (ungebräuchlich), ist ein 1941 entdecktes, hitze- und lichtempfindliches Vitamin aus dem B-Komplex. Es setzt sich chemisch zusammen aus einem Pteridin-Derivat, para-Aminobenzoesäure und L-Glutaminsäure. Während die Bezeichnung Folsäure die synthetische (industriell hergestellte) Form des B-Vitamins mit einem Glutamatrest (siehe Bild mit n = 1) meint, bezeichnet Folat die Summe der folatwirksamen Verbindungen, also sowohl mit einem Glutamatrest (Monoglutamat) oder mehreren Glutamatresten (Polyglutamate).
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
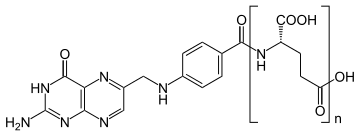 | |||||||||
| Pteroylmonoglutamat (Folsäure, n=1), Pteroylpolyglutamat (n = 2, 3, …), hier die Lactam-Form der zwei möglichen Lactam-Lactim-Tautomere | |||||||||
| Allgemeines | |||||||||
| Trivialname |
| ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C19H19N7O6 | ||||||||
| CAS-Nummer | 59-30-3 | ||||||||
| PubChem | 6037 | ||||||||
| ATC-Code |
B03BB01 | ||||||||
| Kurzbeschreibung | orangegelbes, kristallines Pulver[2] | ||||||||
| Vorkommen | Weizenkeime, Rinderleber, (Soja-) Bohnen, Kichererbsen, Hefe, Vollkornbrot, Spinat, Grünkohl, Rosenkohl, Spargel, Nüsse, Obst, Fisch und Eigelb | ||||||||
| Physiologie | |||||||||
| Funktion | Übertragung von C1-Gruppen bei biochemischen Reaktionen | ||||||||
| Täglicher Bedarf | 60–600 µg[3] | ||||||||
| Folgen bei Mangel | Zellteilungsstörungen (als Folge: Megaloblastäre Anämie), Neuralrohrdefekte bei der Embryogenese | ||||||||
| Überdosis | 15 mg/Tag | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 441,40 g · mol−1 | ||||||||
| Aggregatzustand | fest[2] | ||||||||
| Schmelzpunkt | |||||||||
| Löslichkeit | schlecht in Wasser (1,6 mg·l−1 bei 25 °C)[5] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Vorkommen

Nahrungsmittel mit besonders hohen Gehalten an Folsäure sind Hefen mit bis zu 2500 µg je 100 g[6] und Getreidekeime und -kleie (insbesondere Weizenkeime) mit bis zu 600 µg je 100 g Rohgewicht.[7] Weitere natürliche Folsäurelieferanten, die nennenswerte Mengen enthalten, sind Hülsenfrüchte (insbesondere Linsen mit 204 µg je 100 g roh),[8] Kalbs- und Geflügelleber,[9] dunkelgrüne Blattgemüse,[9] Eigelb,[10] Petersilie,[10] Gartenkresse[10] und Sonnenblumenkerne mit jeweils rund 100 µg je 100 g.[11]
Weiterhin weisen Mohnsamen,[10] frisches grünes Gemüse und Nieren einen Folsäuregehalt von 50 bis 100 µg pro 100 g auf,[9] gefolgt von gekochtem Spargel,[10] gekochtem Blattspinat,[10] Tomaten,[10] Brombeeren,[10] Blumenkohl,[10] Orangen,[10] Rindfleisch,[9] Kalbfleisch[9] und Getreideflocken mit 10 bis 50 µg pro 100 g.[9]
Herstellung
Folsäure wird in der chemischen Industrie im Tonnenmaßstab hergestellt. Zunächst wird dazu aus Guanidin und Cyanessigsäureethylester das 6-Hydroxy-2,4-diaminopyrimidin synthetisiert, welches mit Salpetriger Säure dann zum Nitro-Derivat umgesetzt und anschließend zum 6-Hydroxy-2,4,5-triaminopyrimidin reduziert wird. Als Reduktionsmittel werden hierfür Zinn(II)-chlorid, Natriumdithionit oder Wasserstoff in Verbindung mit einem Hydrierkatalysator (Palladium auf Kohle) eingesetzt.[12]
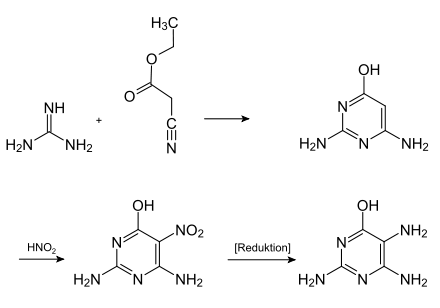
- Synthese von 6-Hydroxy-2,4,5-triaminopyrimidin, einem Ausgangsstoff der industriellen Folsäuresynthese
In einer Dreikomponenten-Reaktion wird das 6-Hydroxy-2,4,5-triaminopyrimidin anschließend mit 1,1,3-Trichloraceton und N-(4-Aminobenzoyl)-L-glutaminsäure unter schwach sauren Bedingungen und mit Hilfe von Natriumhydrogensulfit zur Folsäure umgesetzt. Anstelle des Trichloracetons können auch 2,3-Dibrompropionaldehyd oder Methylglyoxal verwendet werden.[12]
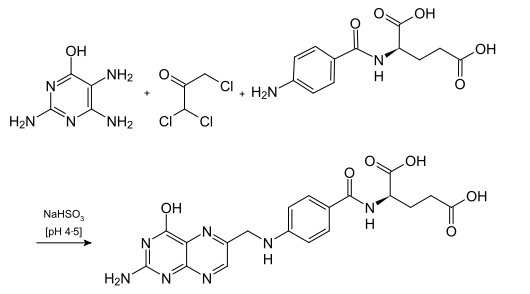
- Industrielle Synthese von Folsäure aus 6-Hydroxy-2,4,5-triaminopyrimidin, 1,1,3-Trichloraceton und N-(4-Aminobenzoyl)-L-glutaminsäure
Chemische und physikalische Eigenschaften
| Tautomere Formen der Folsäure |
|---|
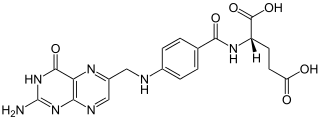 Lactam-Form |
 Lactim-Form |
Acidität
Folsäure ist eine dreiprotonige Säure. Die zugehörigen negativen dekadisch logarithmierten Säurekonstanten (pKS-Werte) in Wasser unter Normalbedingungen betragen 4,65; 6,75; 9,00.[13]
Tautomerie
In der Pterin-Teilstruktur des Moleküls tritt Lactam-Lactim-Tautomerie auf, die beiden als Grenzstrukturen formulierbaren Moleküle werden systematisch als (2S)-2-({4-[(2-Amino-4-oxo-1H-pteridin-6-yl)methylamino]benzoyl}amino)pentandisäure (Lactam-Form) und (2S)-N-{4-[(2-Amino-4-hydroxypteridin-6-yl)methylamino]benzoyl}glutaminsäure (Lactim-Form) bezeichnet.
Stabilität
Das Vitamin ist empfindlich gegenüber Licht (insbesondere UV-Strahlung), Sauerstoff, Schwermetallen, erhöhten Temperaturen sowie (wenn auch sehr gering) gegenüber Wasser.[14] Daher sollten zu intensives Wässern und zu lange Lager- und Kochzeiten von Nahrungsmitteln vermieden werden. Auch auf die menschliche Haut treffende intensive Sonnenstrahlung reduziert die Folsäure im Körper.[15][16] Bei hellhäutigen Menschen ist der Effekt besonders stark.[17]
Biochemie
Folsäure ist die Vorstufe des Coenzyms Tetrahydrofolsäure (THF). Die Reduktion von Folsäure zu Dihydrofolsäure ist Vitamin C-abhängig[18]. Durch weitere Reduktion entsteht die aktive Form, Tetrahydrofolsäure, die unter physiologischen Bedingungen als Anion Tetrahydrofolat vorliegt. Dieses hat eine zentrale Stellung im C1-Stoffwechsel. THF wirkt besonders als Lieferant von Methyl- (CH3-), Methylen- (CH2=) und Formyl-Gruppen (HCO-) und ist mit an der Synthese von Purinbasen und von desoxy-Thymidinmonophosphat (dTMP) beteiligt, welche für die DNS-Replikation notwendig sind. Außerdem ist THF Coenzym der Methylierung von Homocystein zu Methionin. Geliefert werden die C1-Bausteine des THF u. a. von den Aminosäuren Serin, Glycin und Histidin. Im Aminosäurenstoffwechsel wird als Cofaktor Pyridoxalphosphat benötigt[18]. Ein Belastungstest mit Histidin dient zur Diagnose eines Folsäuremangels. Wegen der Beteiligung an der Synthese von DNS-Bausteinen spielt die Folsäure insbesondere in der Schwangerschaft sowie bei sich häufig teilenden Zellen (z. B. Knochenmark) eine entscheidende Rolle.
Aufnahme und Speicherung
Folsäure ist für den menschlichen Organismus essenziell und kann von ihm selbst nicht hergestellt werden. Deshalb muss Folsäure mit der Nahrung aufgenommen werden. Um zunächst in das Zellinnere zu gelangen, angefangen mit den Darm-Mucosa-Zellen, ist das Folsäuremolekül auf die Anwesenheit des Transportproteins protonengekoppelter Folattransporter angewiesen, der ebenfalls für den Export in die Blutbahn zuständig ist. THF und 5-Derivate des THF benutzen den Folattransporter 1 für den Import, auch und besonders im Darm. Folat, Dihydrofolsäure (DHF) und THF können in die Mitochondrien mittels des mitochondrialen Folattransporters wechseln.
Folat und seine Derivate werden durch Bindung an Polyglutamat im Zytosol und den Mitochondrien der Zellen gespeichert. Nur so können viele der kohlenstoffübertragenden Reaktionen stattfinden. Für die Bindung insbesondere von DHF und THF wird das Enzym Folylpolyglutamat-Synthetase benötigt.[19]
Folatüberschuss führte in Zellkulturen zu einem signifikanten Rückgang der Expression aller folattransportierenden Proteine (PCFT, RFC, Folatrezeptor) in Darmzellen.[20] Im menschlichen Organismus können Folsäureüberschüsse einen Vitamin-B12-Mangel verdecken. Durch die starke Abhängigkeit von Vitamin B12- und Folsäurestoffwechsel entwickelt man bei einem Mangel von einem der beiden eine megaloblastäre Anämie[18].
Physiologischer Bedarf
Die empfohlene Tagesdosis nach RDA beträgt 200 µg. Die Referenzwerte für die Nährstoffzufuhr (1. Auflage 2015 der Deutschen Gesellschaft für Ernährung e. V.) empfehlen eine tägliche Aufnahme von 300 µg Folsäure (Frauen mit Kinderwunsch bereits um den Zeitpunkt der möglichen Befruchtung herum 550 µg).[21] Mit Blick auf die zusätzliche Vorbeugung gegen Atherosklerose wurden früher 600 µg für gesunde Erwachsene, 800 µg für Schwangere und für stillende Mütter empfohlen.[22][23] Die Zufuhr von mehr als 1.000 µg Folsäure täglich hat keinen zusätzlichen gesundheitlichen Effekt und führt lediglich zu einem Kreislauf von nicht umsetzbarer Folsäure im Körper.[24] Ursache hierfür ist die außerordentlich begrenzte Aktivität der so genannten Dihydrofolatreduktase (DHFR) und ihrer damit verbundenen raschen Sättigung. Dieses in der Leber vorkommende Enzym hilft, die zugeführte Folsäure in eine für den menschlichen Organismus nutzbare Form (Tetrahydrofolsäure) umzuwandeln. Nach Verabreichung größerer Mengen Folsäure werden diese zum Großteil unverändert als Pteroylmonoglutamat über den Urin ausgeschieden.[4] Die Risiken einer Überversorgung mit Folsäure werden inzwischen allerdings kritisch betrachtet. So kann ein Überschuss von Folsäure einen Vitamin-B12-Mangel verdecken, aus dem eine Schädigung des Nervensystems folgen kann.[25]
Folsäure-Mangel und Fehlbildungen
Ein Folsäuremangel im menschlichen Körper wirkt sich auf das Blutbild aus, indem er zu einer megaloblastären bzw. hyperchromen makrozytären Anämie führen kann. Der Mensch kann maximal 12 bis 15 mg Folsäure speichern; dies entspricht einem Vorrat für drei bis vier Monate. Im Normalfall enthält das Blutserum 5 bis 20 μg/L, die Erythrozyten zwischen 160 und 640 μg/L des Vitamins. Bei einem Mangel fällt der Serumspiegel zuerst ab,[26] weshalb dieser meist über Hochleistungsflüssigkeitschromatografie (HPLC) oder über Chemolumineszenz bestimmt wird.[14] Sehr oft tritt ein Folsäuremangel als Folge von erhöhtem Alkoholkonsum, Erkrankungen des Dünndarms oder Lebererkrankungen auf.[26] Bei Frauen ist der Folsäurebedarf bei Einnahme von empfängnisverhütenden Mitteln sowie innerhalb der Schwangerschaft erhöht.[14]
In der Embryonalentwicklung begünstigt ein Folsäuremangel die Entstehung von Neuralrohrdefekten wie eine Spina bifida oder Anenzephalie.[27] Er soll außerdem Einfluss auf eine Frühgeburtlichkeit haben.[28] Jedes Jahr werden in Deutschland etwa 800 Kinder mit einem Neuralrohrdefekt geboren, mithin ist etwa eines von tausend Neugeborenen betroffen; hinzuzurechnen sind wegen Spina bifida abgebrochene Schwangerschaften. Eine ausreichende Folsäureversorgung während der Schwangerschaft scheint darüber hinaus auch im Hinblick auf die Sprachentwicklung des Kindes eine wichtige Rolle zu spielen.[29] Eine prospektive Beobachtungsstudie aus Norwegen zeigt zudem einen Zusammenhang zwischen Folsäuremangel und Autismus, weswegen Folsäure schon beim Wunsch einer Schwangerschaft eingenommen werden sollte.[30][31]
Folsäuremangel führt zu einer megaloblastären Anämie (hyperchrome makrozytäre Anämie). Die Mitverantwortung der Folsäure an der Zellreifung, -differenzierung und -teilung, insbesondere die der roten und weißen Blutkörperchen und der Schleimhautzellen wird zurzeit in mehreren Universitäten und Forschungslabors untersucht.[32] Bei Erkrankungen des Herz-Kreislauf-Systems, beispielsweise der Arteriosklerose, soll ebenfalls auf ausreichende Folsäureversorgung geachtet werden. Der Wert für die Aminosäure Homocystein im Blut gilt als kardiovaskulärer Risikofaktor. Homocystein wird mit Hilfe der Folsäure und Vitamin B12 in Methionin umgewandelt.[33] Die positiven Auswirkungen erhöhter Folsäuregaben – die unter anderem den Homocystein-Spiegel absenken – auf den Verlauf von Herz-Kreislauf-Erkrankungen sind jedoch nicht gut belegt.
Risiken der Supplementation
Daten aus randomisiert-kontrollierten Studien zu Folsäure-Supplementation weisen auf ein erhöhtes Tumorrisiko hin, wenn Folsäure in Kombination mit Vitamin B12 von Patienten mit koronarer Herzkrankheit (KHK) eingenommen wird. Gehäuft treten dabei vor allem bösartige Lungentumore auf, die auch zur erhöhten Sterblichkeit von Patienten mit Folsäure-Vitamin-B12-Supplementation beitragen.[34]
Rechtliche Aspekte
Seit der Jahrtausendwende wird in einer zunehmenden Anzahl von Ländern Folsäure den Grundnahrungsmitteln beigefügt. Diese Aktion trifft inzwischen auf weltweit 67 Länder zu. Jedoch beteiligt sich kein Land der Europäischen Union an einer solchen Aktion.
Deutschland
Da zwei Drittel der Erwachsenen in Deutschland durchschnittlich weniger als 300 µg täglich aufnehmen, fordern einige Kinderärzte und einige Gesundheitspolitiker, dem Grundnahrungsmittel Mehl (wenn es nicht Vollkornmehl ist) Folsäure beizumengen.[35] Auf diese Weise soll insbesondere Fehlbildungen bei der Neuralrohrbildung vorgebeugt werden, die in den ersten drei Schwangerschaftswochen und damit zu einem Zeitpunkt eintreten, zu dem die Schwangerschaft in der Regel noch nicht bekannt ist.[27] Von ärztlichen Befürwortern einer Folsäure-Anreicherung wird argumentiert, dass die Zahl der Schwangerschaften mit Neuralrohrdefekten in Deutschland im internationalen Vergleich besonders hoch sei (12,36 pro 10.000 Geburten; international 7,88 pro 10.000 Geburten).[36] Jährlich gibt es in Deutschland etwa 800 Schwangerschaften mit Neuralrohrdefekten, die in der Mehrheit nach einem positiven Screening-Test abgebrochen werden. Herrmann/Obeid sind der Meinung, dass durch eine perikonzeptionelle Folsäure-Gabe die Häufigkeit von Neuralrohrdefekten um 20 bis 60 % abgesenkt werden könne.[37]
Aus Sicht des Ernährungsministeriums bedarf es in Deutschland keiner Beimengungspflicht.[38] Auch Ernährungsexperten der Verbraucherzentralen u. a. sprechen sich gegen eine Pflichtanreicherung des Mehls mit Folsäure aus, da der Verbraucher auf natürlichem Wege mit Obst, Gemüse und Vollkornbrot ausreichend Folsäure aufnehmen könne und es ihm überdies freistehe, Nahrungsergänzungsmittel oder auch im Handel angebotene, folsäureangereicherte Müsliriegel, Getränke, Milchprodukte oder Kochsalz zu erwerben.
Österreich
Wie in Deutschland wird in Österreich die Versorgung mit Folsäure als unzureichend angesehen. Aus dem Ernährungsbericht 2000 der Deutschen Gesellschaft für Ernährung wird wegen ähnlicher Ernährungsgewohnheiten geschlossen, dass „die empfohlene Folatzufuhr auch in Österreich mit der heute üblichen Ernährungsweise von einem großen Teil der Bevölkerung nicht erreicht wird.“[39] Nach dem Österreichischen Ernährungsbericht 2017 liegt die mittlere Zufuhr von Folat bei beiden Geschlechtern und allen Altersgruppen unter der empfohlenen Zufuhr von 300 μg pro Tag. Nur 27 % der Frauen und 42 % der Männer liegen im Bereich der empfohlenen Zufuhr.[40] Auf der Webseite des Österreichischen Sozialministeriums wird die Thematik nicht behandelt, gesetzliche Verpflichtungen, Folsäure in Lebensmitteln zuzusetzen, gibt es nicht, werden aber in Fachkreisen diskutiert.
Schweiz
Im Januar 2000 begann die Stiftung Folsäure Offensive Schweiz eine nationale Präventionskampagne mit dem Ziel, die Folsäure-Lücke gemäß dem 4. Schweizer Ernährungsbericht 98 des Bundesamtes für Gesundheit zu schließen. Über dreihundert Produkte wurden seither mit Folsäure angereichert, welche mit dem Logo Folsäure-Lebensvitamin ausgezeichnet werden. Dank dieser Kampagne konnte der Bekanntheitsgrad der Folsäure-Prävention von 2000 bis 2010 von 38 % auf 76 % gesteigert werden.[41]
USA und Kanada
In den USA und in Kanada ist seit 1998 ein Folsäurezusatz zum Weizenmehl gesetzlich vorgeschrieben. Seitdem kommen in Kanada nur noch etwa halb so viele Kinder mit Spina bifida zur Welt, Anenzephalie sank um 38 %, Enzephalozele um 31 %. In den USA wurde je nach Bevölkerungsgruppe ein Rückgang zwischen 1 und 34 Prozent (Durchschnitt etwa 20 %) für Spina bifida beobachtet, ähnliche Ergebnisse liegen bei Anenzephalie vor.[42][43]
Weblinks
- Deutsches Ärzteblatt: Die obligatorische Folsäurefortifikation von Nahrungsmitteln: Ein in Deutschland kontrovers diskutiertes Thema, 15. April 2011.
- Deutsches Ärzteblatt: Gesundheitliche Bedeutung der Folsäurezufuhr (falsche Maßeinheit im Artikel: Milli-/m- statt Mikro-/µ-!)
- Höchstmengen für Folsäure in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 6. Januar 2022.
Einzelnachweise
- Eintrag zu FOLIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Folsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Juni 2017. (JavaScript erforderlich)
- Deutsche Gesellschaft für Ernährung: Referenzwerte für die Nährstoffzufuhr. Folat. 1. Auflage, 3. korrigierter Nachdruck 2008.
- Eintrag zu Folsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Mai 2011.
- Eintrag zu Folic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- NDL/FNIC: Food Composition Database Home Page (Memento vom 3. März 2015 im Internet Archive): Leavening agents, yeast, baker’s, active dry.
- NDL/FNIC: Food Composition Database Home Page (Memento vom 3. März 2015 im Internet Archive): Food groups: cereal grains and pasta; legumes and legume products.
- National Nutrient Database for Standard Reference Release 28. (Nicht mehr online verfügbar.) In: usda.gov. USDA, archiviert vom Original am 17. Mai 2016; abgerufen am 27. Juni 2016.
- Josef Schormüller: Die Bestandteile der Lebensmittel. Springer-Verlag, 1965, ISBN 978-3-642-46011-1, S. 1009.
- Emmo Müller: Folsäure. Georg Thieme Verlag, 2003, ISBN 978-3-8304-3142-8, S. 70 (eingeschränkte Vorschau in der Google-Buchsuche).
- Sven-David Müller, Karin Raschke: Das Kalorien-Nährwert-Lexikon. 2004, S. 28.
- Franz von Bruchhausen (Hrsg.); Hermann Hager, Beate Blümer-Schwinum: Hagers Handbuch der pharmazeutischen Praxis. 5. Aufl. 1993, Springer Berlin Heidelberg New York ISBN 3-540-52688-9 (eingeschränkte Vorschau in der Google-Buchsuche), S. 284.
- R. M. C. Dawson: Data for Biochemical Research, Oxford University Press, Oxford, 1989, 3. Auflage, S. 134, ISBN 0-19-855299-8.
- Walter G. Guder, Jürgen Nolte: Das Laborbuch für Klinik und Praxis. Elsevier, 2005, ISBN 978-3-437-23340-1.
- Nina G. Jablonski und George Chaplin: The evolution of human skin coloration. In: Journal of Human Evolution. Band 39, 2000, S. 57–106, doi:10.1006/jhev.2000.0403, Volltext (PDF).
- Nina G. Jablonski und George Chaplin: Skin cancer was not a potent selective force in the evolution of protective pigmentation in early hominins. In: Proceedings of the Royal Society B. Band 281, Nr. 1789, 2014, doi:10.1098/rspb.2014.0517.
- Inge Kronberg: Geografische Verteilung der Hautfarbe. In: Biologie in unserer Zeit. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim (Autorin: Hohenwestedt), Vol. 6 (2), S. 76–77, 29. März 2006.
- Florian Horn, Silke Berhold, Christian Grillhösl, Gerd Lindenmeier: Biochemie des Menschen. Hrsg.: Florian Horn. 6. Auflage. Thieme, 2015, ISBN 978-3-13-130886-3.
- reactome.org: Metabolism of folate and pterines, reactome.org
- B. Ashokkumar, Z. M. Mohammed, N. D. Vaziri, H. M. Said: Effect of folate oversupplementation on folate uptake by human intestinal and renal epithelial cells. In: Am. J. Clin. Nutr.. 86, Nr. 1, Juli 2007, S. 159–66. PMID 17616776.
- Referenzwerte für die Nährstoffzufuhr: Folat. Abgerufen am 17. April 2016.
- Mariel Croon: Schwanger werden. Den richtigen Zeitpunkt finden. 2005, S. 67
- Tanja Saußele: Folsäuresupplementierung vor und während der Schwangerschaft. Medizinische Monatsschrift für Pharmazeuten, 31. Jahrgang, Heft 12, Dezember 2008, S. 469 f.; PMID 19133595.
- Steven W. Bailey und June E. Ayling: The extremely slow and variable activity of dihydrofolate reductase in human liver and its implications for high folic acid intake. In: Proc Natl Acad Sci USA. 2009, S. Epub. PMID 19706381. (PDF; 297 kB).
- Max Rubner-Institut: Pressemitteilung vom 13. März 2012.
- Hanns-Wolf Baenkler: Innere Medizin: 299 Synopsen, 611 Tabellen. Georg Thieme Verlag, 2001, ISBN 978-3-13-128751-9.
- Medizinfo: Nährstoffe in der Schwangerschaft: Folsäure
- aerzteblatt: Folsäure im Mehl vermeidet Herzfehler. (Memento vom 22. März 2013 im Internet Archive)
- Folsäure auch gut gegen Sprachverzögerung. Meldung der Ärzte Zeitung vom 15. Oktober 2011.
- Surén P, Roth C, Bresnahan M, et al. Association Between Maternal Use of Folic Acid Supplements and Risk of Autism Spectrum Disorders in Children. JAMA. 2013;309(6): 570–577. doi:10.1001/jama.2012.155925.
- Prenatal Folic Acid Supplementation Associated With Lower Risk of Autism.
- Olav Jansen, Ulrich Stephani: Fehlbildungen und frühkindliche Schädigungen der ZNS. 2007, ISBN 978-3-13-137591-9, S. 162 (eingeschränkte Vorschau in der Google-Buchsuche).
- Laura Zimmer: Zusammenhang von Ernährungsfaktoren und Alzheimer-Demenz. 2011, ISBN 978-3-656-03561-9, S. 31 (eingeschränkte Vorschau in der Google-Buchsuche).
- Marta Ebbing, Kaare Harald Bønaa, Ottar Nygård, Egil Arnesen, Per Magne Ueland: Cancer incidence and mortality after treatment with folic acid and vitamin B12. In: JAMA. Band 302, Nr. 19, 18. November 2009, ISSN 1538-3598, S. 2119–2126, doi:10.1001/jama.2009.1622, PMID 19920236.
- Folsaeurevorsorge der deutschen Bevoelkerung (PDF; 1,1 MB).
- Herrmann, Wolfgang; Obeid, Rima: Die obligatorische Folsäurefortifikation von Nahrungsmitteln – Ein in Deutschland kontrovers diskutiertes Thema. In: Dtsch Arztebl Int (2011), Band 108, Ausgabe 15, S. 249–254. doi:10.3238/arztebl.2011.0249.
- Wolfgang Herrmann, Rima Obeid: Die obligatorische Folsäurefortifikation von Nahrungsmitteln – ein in Deutschland kontrovers diskutiertes Thema. Deutsches Ärzteblatt 2011;108(15):249–54.
- Thorsten Denkler: Brot soll per Gesetz Vitamine bekommen. taz vom 16. Oktober 2006.
- Folsäure. Hauptverband der österreichischen Sozialversicherungsträger, abgerufen am 23. März 2019.
- Petra Rust, Verena Hasenegger, Jürgen König: Österreichischer Ernährungsbericht 2017. Department für Ernährungswissenschaften der Universität Wien, ISBN 978-3-903099-32-6, S. 17, abgerufen am 23. März 2019.
- SBH-Informationsheft Nr. 4/10 (Memento vom 7. Juni 2014 im Internet Archive), S. 20 (PDF; 2,6 MB).
- Decline in the Prevalence of Spina Bifida and Anencephaly by Race/Ethnicity: 1995–2002. Pediatrics 2005; 116: 580–586.
- Philippe de Wals, Fassiatou Tairou, Margot I. van Allen, Soo-Hong Uh, R. Brian Lowry, Barbara Sibbald, Jane A. Evans, Michiel C. van den Hof, Pamela Zimmer, Marian Crowley, Bridget Fernandez, Nora S. Lee and Theophile Niyonsenga: Reduction in neural-tube defects after folic acid fortification in Canada. N Engl J Med. 2007 Jul 12;357(2):135-42, PMID 17625125 Volltext.