Asparaginsäure
Asparaginsäure, abgekürzt Asp oder D, ist in ihrer natürlichen L-Form eine der proteinogenen α-Aminosäuren.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
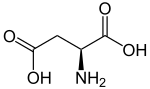 | ||||||||||||||||||||||
| Struktur von L-Asparaginsäure, dem natürlich vorkommenden Enantiomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Asparaginsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H7NO4 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Blättchen oder Stäbchen[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
V06DD | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 133,10 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (4 g·l−1 bei 20 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wie die anderen Aminosäuren liegt Asparaginsäure im Körper normalerweise zwitterionisch vor. Zusätzlich ist jedoch die zweite Carboxygruppe deprotoniert, darum wird in der Biochemie statt L-Asparaginsäure oft die Bezeichnung L-Aspartat verwendet.
Enantiomere
Asparaginsäure besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere. In diesem Artikel betreffen die Angaben zur Physiologie allein die L-Asparaginsäure [Synonym: (S)-Asparaginsäure]. Wenn von „Asparaginsäure“ ohne weiteren Namenszusatz (Deskriptor) gesprochen wird, ist gemeinhin L-Asparaginsäure gemeint. Die racemische DL-Asparaginsäure [Synonym: (RS)-Asparaginsäure] und die enantiomerenreine D-Asparaginsäure [Synonym: (R)-Asparaginsäure] sind synthetisch zugänglich und besitzen nur geringe praktische Bedeutung.
Die partielle Racemisierung von L-Aminosäuren kann zur Aminosäuredatierung – einer Altersbestimmung fossilen Knochenmaterials – herangezogen werden.[4]
| Enantiomere von Asparaginsäure | ||
| Name | L-Asparaginsäure | D-Asparaginsäure |
| Andere Namen | (S)-Asparaginsäure | (R)-Asparaginsäure |
| Strukturformel |  | 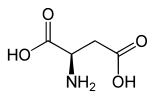 |
| CAS-Nummer | 56-84-8 | 1783-96-6 |
| 617-45-8 (Racemat) | ||
| EG-Nummer | 200-291-6 | 217-234-6 |
| 210-513-3 (Racemat) | ||
| ECHA-Infocard | 100.000.265 | 100.015.668 |
| 100.009.559 (Racemat) | ||
| PubChem | 5960 | 83887 |
| 424 (Racemat) | ||
| DrugBank | DB00128 | DB02655 |
| − (Racemat) | ||
| CAS-Nummer | 17.005 | - |
| Wikidata | Q178450 | Q27076990 |
| Q27109481 (Racemat) | ||
Geschichte
Der französische Pharmazeut Auguste-Arthur Plisson isolierte 1827 Asparagin aus der Eibe und wies nach, dass das zuvor von Pierre-Jean Robiquet ebenfalls aus der Eibe gewonnene „Althein“ mit dem von Louis-Nicolas Vauquelin und Robiquet erhaltenen Asparagin identisch ist. Die Synthese von Asparaginsäure gelang Plisson durch Umsetzung von Asparagin mit Bleioxid-Hydrat und der nachfolgenden Trennung durch Schwefelwasserstoff („Hydrothionsäure“).[5] Er nannte die gewonnene Säure „acide aspartique“ (zu deutsch ‚Asparaginsäure‘). Hermann Kolbe klärte 1862 die Struktur von Asparagin und Asparaginsäure auf.[6]
Vorkommen

L-Asparaginsäure wurde erstmals synthetisch aus Asparagin gewonnen, das in den Keimlingen von Leguminosen vorkommt.
Gemüsespargel (Asparagus officinalis) enthält ebenfalls recht hohe Anteile an dieser Aminosäure. Sie kommt in fast allen Proteinen gebunden vor, in unterschiedlichen Anteilen.
Bei den folgenden L-asparaginsäurereichen Lebensmitteln sind die Angaben jeweils auf 100 g des Nahrungsmittels bezogen, zusätzlich ist der prozentuale Anteil von Asparaginsäure am Gesamtprotein angegeben.[7]
| Lebensmittel | Protein | Asparaginsäure | Anteil |
|---|---|---|---|
| Sojaprotein, Isolat | 80,69 g | 10,20 g | 12,6 % |
| Eiklar, getrocknet | 81,10 g | 8,25 g | 10,2 % |
| Kabeljau, atlantisch, getrocknet und gesalzen | 62,82 g | 6,43 g | 10,2 % |
| Erdnussmehl, entfettet | 52,20 g | 6,37 g | 12,2 % |
| Spirulina, getrocknet | 57,47 g | 5,79 g | 10,1 % |
| Tofu, gefriergetrocknet (Kōya-dōfu) | 47,94 g | 5,30 g | 11,1 % |
| Sonnenblumenkernmehl, teilweise entfettet | 48,06 g | 5,16 g | 10,7 % |
Eigenschaften
Asparaginsäure reagiert aufgrund ihrer zwei Carboxygruppen sauer. Daher liegt diese Aminosäure physiologisch – je nach pH-Wert – meist als inneres Salz in Form eines Aspartats vor. Isoelektrischer Punkt 2,77.
Biosynthese und industrielle Herstellung
Die Biosynthese von L-Asparaginsäure erfolgt zum Beispiel aus der homologen Ketosäure Oxalacetat durch Transaminierung. Industriell wird die L-Asparaginsäure nach einem biotechnologischen Verfahren enantioselektiv durch Anlagerung von Ammoniak an die C=C-Doppelbindung von Fumarsäure gewonnen.[8] Dabei wird ein Mikroorganismus mit dem Enzym L-Aspartase eingesetzt.
Funktionen
L-Aspartat, die konjugierte Base der Asparaginsäure, soll bei Wirbeltieren zusammen mit Glutaminsäure in mehr als 50 Prozent aller Synapsen des zentralen Nervensystems als Transmitter fungieren, unter anderem in den Kletterfasern des Kleinhirns und den Moosfasern der Ammonshornformation. Es wirkt über die Stimulation der NMDA-Rezeptoren. Die Wirkung ist jedoch nicht so stark wie mit Glutamat.[9]
Außerdem wird L-Asparaginsäure im Harnstoffzyklus durch das Enzym Argininosuccinat-Synthetase mit Citrullin unter Spaltung von ATP zu AMP und PPi zu Argininosuccinat zusammengefügt. Dieses wird dann durch die Argininosuccinat-Lyase in L-Arginin und Fumarat aufgespalten. L-Arginin gibt dann Harnstoff ab, während Fumarat wieder im Citratzyklus zum Oxalacetat konvertiert wird, das wieder zum L-Aspartat transaminiert werden kann (Aminogruppenübertragung von α-Aminosäuren auf Harnstoff via Transaminierung von Oxalacetat).
Verwendung
Erhebliche Mengen L-Asparaginsäure werden für die Herstellung des Süßstoffs Aspartam eingesetzt. Weiterhin wird L-Asparaginsäure als Edukt für die stereoselektive Synthese einer Vielzahl weiterer chiraler organisch-chemischer Verbindungen benutzt.[10] N-substituierte Polyasparaginsäureester werden als Reaktivkomponenten in modernen Lacksystemen eingesetzt.
Weiterhin findet L-Asparaginsäure Anwendung als Bestandteil von Infusionslösungen zur parenteralen Ernährung und als Salzbildner.[11]
Weblinks
Einzelnachweise
- Eintrag zu ASPARTIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu l-Asparaginsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- Eintrag zu L-Asparaginsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 62, 1982, ISBN 3-527-25892-2.
- A. Plisson: Sur l`ldentité du Malate acide d`altheine avec lÀsparagine, Ann Chim Phys, Band 36, S. 175ff (1827).
- H. Kolbe: Ueber die chemische Constitution des Asparagins und der Asparaginsäure, Liebigs Ann Chem, Band 121, S. 232ff (1862).
- Nährstoffdatenbank des US-Landwirtschaftsministeriums, 26. Auflage.
- Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren, Angewandte Chemie 90 (1978) 187–194, doi:10.1002/ange.19780900307; Angewandte Chemie International Edition in English 17, 176–183, doi:10.1002/anie.197801761.
- Philip E. Chen, Matthew T. Geballe, Phillip J. Stansfeld, Alexander R. Johnston, Hongjie Yuan, Amanda L. Jacob, James P. Snyder, Stephen F. Traynelis, and David J. A. Wyllie. 2005. Structural Features of the Glutamate Binding Site in Recombinant NR1/NR2A N-Methyl-D-aspartate Receptors Determined by Site-Directed Mutagenesis and Molecular Modeling. Molecular Pharmacology. Ausgabe 67, S. 1470–1484.
- Gary M. Coppola und Herbert F. Schuster: Asymmetric Synthesis – Construction of Chiral Molecules Using Amino Acids, Wiley, 1987, S. 204–213, ISBN 0-471-82874-2.
- S. Ebel und H. J. Roth (Herausgeber): Lexikon der Pharmazie, Georg Thieme Verlag, 1987, S. 66, ISBN 3-13-672201-9.