1,4-Butandiol
1,4-Butandiol (nach IUPAC-Nomenklatur: Butan-1,4-diol, abgekürzt oft auch nur BDO) ist eine organisch-chemische Verbindung aus der Stoffgruppe der zweiwertigen Alkohole, genauer gesagt der gesättigten Diole. Es ist ein Zwischenprodukt der chemischen Industrie, welches vielfältige Anwendung findet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||||||||
| Name | 1,4-Butandiol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C4H10O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose Flüssigkeit[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 90,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,02 g·cm−3[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
230 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,4462 (25 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Gewinnung und Darstellung
Im Rahmen der großtechnischen Synthese von 1,4-Butandiol werden in der chemischen Industrie mehrere Verfahren und Verfahrensvarianten eingesetzt. Das älteste und zugleich auch am häufigsten verwendete ist das zweistufige Reppe-Verfahren (Ethinylierung), das auf den BASF-Chemiker Walter Reppe zurückzuführen ist und bereits in den 1930er Jahren entwickelt und seitdem kontinuierlich verbessert wurde. Zur industriellen Synthese von 1,4-Butandiol setzt man Acetylen mit 10–30%iger Formaldehyd-Lösung an mit Bismut-modifizierten, auf Siliciumdioxid geträgerten, Kupfer(I)-acetylid-Katalysatoren bei Temperaturen von 65–90 °C und Drücken von 0,9–10 bar zu 2-Butin-1,4-diol um. Als Nebenprodukt entsteht dabei Propargylalkohol, welcher destillativ abgetrennt und erneut zur Reaktionsstufe zurückgeführt wird. Die Selektivität zu 2-Butin-1,4-diol beträgt >90 % bezogen auf Formaldehyd und ca. 80 % bezogen auf Acetylen. Die komplette Reaktion verläuft in einer Kaskade aus zwei oder mehr Festbettreaktoren, die in der Sumpf- oder Rieselfahrweise betrieben werden.[5][6]
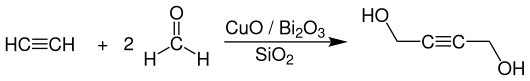
Im zweiten Reaktionsschritt wird das entstandene 2-Butin-1,4-diol stufenweise zu 1,4-Butandiol hydriert. Die Haupthydrierung erfolgt bei Temperaturen von 70–220 °C und Drücken von 150–300 bar (Festbett- bzw. Rieselphasenhydrierung) oder 10–65 bar (Suspension- bzw. Flüssigphasenhydrierung) an Raney-Nickel-Katalysatoren, die zusätzliche Promotoren wie Kupfer oder Chrom enthalten. Die Selektivität zu 1,4-Butandiol beträgt 95 % bezogen auf 2-Butin-1,4-diol. Die Hydrierung wird in Strahldüsen-, Rührkessel- oder Blasensäulenreaktoren durchgeführt. Die Reinigung und Aufarbeitung des Produkts erfolgt durch mehrstufige Destillation in Rektifikationskolonnen.[5][6]
.svg.png.webp)
Weltweit größter Hersteller von 1,4-Butandiol ist die BASF SE mit Produktionsanlagen in Ludwigshafen (Deutschland), Geismar (Louisiana), Kuantan (Malaysia), Caojing (China) und Chiba (Japan). Damit erreicht das Unternehmen eine Produktionskapazität von 670.000 Jahrestonnen.[7] BASF produziert 1,4-Butandiol neben dem Reppe-Verfahren auch durch biotechnologische Fermentation mit Hilfe von Hochleistungsmikroorganismen auf Basis nachwachsender Rohstoffe.[8] Weitere bedeutende Hersteller sind LyondellBasell und INEOS Solvents[9] (früher Ashland/ISP)[10].
Eine Weiterentwicklung des Reppe-Verfahrens ist der Linde/Yukong-Prozess, bei dem man mit vergleichsweise niedrigen Drücken von ca. 1,4 bar arbeitet.
Ein jüngeres Verfahren basiert auf Propen. Dieses wird zu Propylenoxid oxidiert, welches zu Allylalkohol isomerisiert wird. Dieser wird anschließend zu 4-Hydroxybutyraldehyd hydroformyliert. Das Aldehyd wird schließlich zu 1,4-Butandiol hydriert.[11]
1,4-Butandiol kann auch über Maleinsäureanhydrid gewonnen werden (Davy-Prozess).[12]
Im Jahr 2010 wurden weltweit etwa 1,8 Millionen Tonnen 1,4-Butandiol hergestellt.[13]
Eigenschaften
Physikalische Eigenschaften
1,4-Butandiol hat eine relative Gasdichte von 3,11 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,00 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck). Außerdem weist 1,4-Butandiol einen Dampfdruck von weniger als 1 hPa bei 20 °C auf. Die dynamische Viskosität beträgt 71,5 mPa·s bei 25 °C[2]
Chemische Eigenschaften
Butan-1,4-diol ist eine schwer entzündbare, brennbare Flüssigkeit aus der Stoffgruppe der Alkohole. Genauer gesagt handelt es sich um ein terminales Diol. 1,4-Butandiol ist schwer bzw. sehr schwer flüchtig. Mit Wasser ist es vollständig mischbar sowie gut löslich in Ethanol und Dimethylsulfoxid. Gefährliche chemische Reaktionen können bei Kontakt mit starken Oxidationsmitteln, Reduktionsmitteln, Säurechloride und Säureanhydride auftreten. Eine wässrige Lösung von 1,4-Butandiol bei 20 °C und einer Konzentration von 500 g·l−1 weist einen pH-Wert von 7–8 auf.[2][3]
Verwendung
1,4-Butandiol ist ein wichtiges Zwischenprodukt der chemischen Industrie. Es dient als Ausgangsstoff für zahlreiche Folgeprodukte wie Polyester, Polyamide und Polyurethane. Des Weiteren ist es ein Vorprodukt bei der Herstellung von Tetrahydrofuran, einem bedeutenden Lösungsmittel und Ausgangsstoff für den Kunststoff PolyTHF®. Außerdem findet Butan-1,4-diol Anwendung bei der Synthese von Lösungsmittel wie N-Methyl-2-pyrrolidon und γ-Butyrolacton. Ferner entstehen durch Reaktion mit Phosgen Polycarbonate. Darüber hinaus ist es ein Synthesebaustein für Polyester- und Polyetherpolyole. Im medizinischen Bereich findet 1,4-Butandiol Anwendung bei der Synthese von Busulfan.[14][15]
Droge
BDO wird auch als Droge konsumiert. Es wird im Magen des menschlichen Körpers innerhalb von Sekunden über zwei Stufen durch die Alkohol-Dehydrogenase und die Aldehyd-Dehydrogenase zu 4-Hydroxybutansäure (GHB) metabolisiert[16][17] und zeigt daher dieselben Wirkungen, die nach circa 5–20 Minuten einsetzen und ca. 2–3 Stunden anhalten. Im Vergleich zu GHB muss BDO jedoch deutlich niedriger dosiert werden.
Sicherheitshinweise
Hauptsächlich wird 1,4-Butandiol über den Atemtrakt und die Haut aufgenommen. Dabei kommt es nur zu geringen Reizungen auf die Schleimhäute. Des Weiteren kann eine Störung des Zentralnervensystems auftreten. Eine Reproduktionstoxizität, Mutagenität oder Kanzerogenität konnten durch einige Tests und Tierversuche ausgeschlossen werden. 1,4-Butandiol weist eine untere Explosionsgrenze (UEG) von 1,8 Vol.-% (67 g/m3) und eine obere Explosionsgrenze (OEG) von 15,7 Vol.-% (585 g/m3) auf. Die Zündtemperatur beträgt ca. 370 °C. Der Stoff fällt somit in die Temperaturklasse T2. Mit einem Flammpunkt von ca. 130 °C gilt 1,4-Butandiol als schwer entflammbar.[2]
Weblinks
Einzelnachweise
- Eintrag zu 1,4-BUTANDIOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- Eintrag zu 1,4-Butandiol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 24. April 2019. (JavaScript erforderlich)
- Eintrag zu 1,4-Butanediol in der Hazardous Substances Data Bank, abgerufen am 24. April 2019 (online auf PubChem).
- C. T. Handy, H. S. Rothrock: Polymeric Peroxide of 1,3-Butadiene. In: Journal of the American Chemical Society. Band 80, Nr. 19, Oktober 1958, ISSN 0002-7863, S. 5306–5308, doi:10.1021/ja01552a075.
- Patent EP2121549A1: Verfahren zur Herstellung von 1,4-Butandiol. Angemeldet am 14. März 2007, veröffentlicht am 25. November 2009, Anmelder: BASF SE, Erfinder: Rolf Pinkos, Rudolf Erich Lorenz, York Alexander Beste.
- Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 108.
- BASF erhöht Produktionskapazität von Butandiol am Standort Geismar. In: www.basf.com. BASF SE, 21. Januar 2015, abgerufen am 24. April 2019.
- Erneuerbares 1,4-Butandiol. In: www.basf.com. BASF SE, abgerufen am 24. April 2019.
- BDO & Derivatives. Abgerufen am 10. Januar 2022.
- chemiste.de: ISP Marl GmbH (Memento vom 12. April 2016 im Internet Archive)
- Nexant’s ChemSystems Process Evaluation/Research Planning: 1,4-Butanediol/Tetrahydrofuran (BDO/THF) (PDF).
- J. M. Davy: Licensed Processes: Butanediol & Co-Products
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2013, ISBN 978-3-527-33072-0, S. 581.
- Eintrag zu Butandiole. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. April 2019.
- 1,4-Butandiol. In: BASF Produktsuche. BASF SE, 2014, abgerufen am 24. April 2019.
- D. Thai, J. E. Dyer, P. Jacob, C. A. Haller: Clinical pharmacology of 1,4-butanediol and gamma-hydroxybutyrate after oral 1,4-butanediol administration to healthy volunteers. In: Clinical Pharmacology and Therapeutics. Band 81, Nummer 2, Februar 2007, S. 178–184, doi:10.1038/sj.clpt.6100037, PMID 17192771.
- Schweizer Parlament: Motion – 09.3945, Legal highs: Verbot von gefährlichen, aber legalen Betäubungsmitteln. 25. September 2009, abgerufen am 4. Juli 2012.
