Protonierung
Als Protonierung bezeichnet man in der Chemie die Anlagerung von Protonen (Wasserstoff-Kernen/ -Kationen) an eine chemische Verbindung im Rahmen einer Säure-Base-Reaktion. Dabei werden dem Zielmolekül je nach Anzahl der übertragenen Protonen eine oder mehrere positive Ladungen hinzugefügt. Die Verbindung, die die Protonen aufgenommen hat, wird als protonierte Verbindung bezeichnet. Den entgegengesetzten Vorgang, den der Abspaltung von Protonen von einer Verbindung, nennt man Deprotonierung.[1]
- Protonierung der Verbindung B durch die Säure HA, die dabei deprotoniert wird.
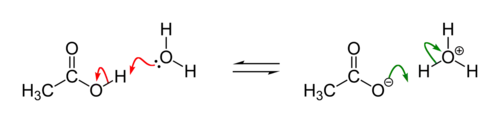
Voraussetzung für den Vorgang der Protonierung ist das Vorliegen einer Säure und einer Base nach der Definition von Brønsted und Lowry.[2] Die Säurestärke – repräsentiert durch den pKS-Wert – und die Basenstärke (pKB) bestimmen, ob das Gleichgewicht auf der Seite der protonierten oder unprotonierten Verbindung liegt.
Die Protonierung einer Verbindung kann durch sterische Faktoren beeinflusst werden.[3]
Mit dem Proton wird eine positive Ladung übertragen, wie im folgenden Beispiel, das die Protonierung von Ammoniak (NH3) durch Chlorwasserstoff (HCl) zeigt:
- Chlorwasserstoff gibt ein Proton an das Ammoniak-Molekül ab. Dadurch werden ein negativ geladenes Chlorid-Anion sowie ein positiv geladenes Ammonium-Kation gebildet.
Die Protonierung ist ein vielfach beobachteter und genutzter Reaktionsschritt. Sie dient häufig zur Aktivierung einer chemischen Verbindung für nachfolgende Reaktionen.[4] Man setzt sie aber auch dazu ein, Verbindungen zu ionisieren, zum Beispiel im Rahmen einer massenspektrometrischen Analyse.[5]
Siehe auch
Einzelnachweise
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle eine Einführung in die organische Chemie. John Wiley & Sons, 2006, ISBN 3-906390-29-2, S. 572,578 (eingeschränkte Vorschau in der Google-Buchsuche).
- Hartmut Follmann, Walter Grahn: Chemie für Biologen Praktikum und Theorie. Springer-Verlag, 2013, ISBN 978-3-322-80146-3, S. 43 (eingeschränkte Vorschau in der Google-Buchsuche).
- James Huheey, Ellen Keiter, Richard Keiter: Anorganische Chemie Prinzipien von Struktur und Reaktivität. Walter de Gruyter GmbH & Co KG, 2014, ISBN 978-3-11-030795-5, S. 374 (eingeschränkte Vorschau in der Google-Buchsuche).
- Michael Quednau: Anwendungen Von Urban Mining bis NanoGeoScience. Walter de Gruyter GmbH & Co KG, 2017, ISBN 978-3-11-042287-0, S. 167 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jürgen H. Gross: Massenspektrometrie Ein Lehrbuch. Springer-Verlag, 2012, ISBN 978-3-8274-2981-0, S. 387 (eingeschränkte Vorschau in der Google-Buchsuche).