Acetonitril
Acetonitril ist ein organisches Lösungsmittel und das einfachste organische Nitril.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | Acetonitril | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H3N | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit leicht etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 41,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,78 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
82 °C [1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert | |||||||||||||||||||
| Löslichkeit |
mit Wasser mischbar[1] | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,3442 (30 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
40,6 kJ/mol[8] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen
Die Emissionslinien von Acetonitril konnten am 1. Dezember 1973 radioteleskopisch im Kern des Kometen C/1973 E1 (Kohoutek) nachgewiesen werden.[9] Astronomen der ESO haben mithilfe des Teleskops ALMA im April 2015 erstmals größere Mengen von Acetonitril um den jungen Stern MWC 480 nachgewiesen.[10]
Herstellung
Möglichkeiten zur Herstellung sind nucleophile Substitutionsreaktionen von z. B. Brommethan mit Natriumcyanid (NaCN).
Industriell fällt Acetonitril bei der Herstellung von Acrylnitril in relativ geringen Mengen als Nebenprodukt an. Preis und Verfügbarkeit sind daher an die Produktion des Polyacrylnitrils gekoppelt.
Eigenschaften
Chemische Eigenschaften
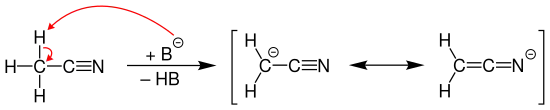
Die Methyl-Gruppe des Acetonitril-Moleküls besitzt CH-Acidität und kann durch diverse Basen (hier als B– dargestellt) deprotoniert werden, wobei ein resonanzstabilisiertes Carbanion gebildet wird:
Bei starkem Erhitzen und im Brandfall entstehen aus Acetonitril giftige Gase wie Cyanwasserstoff und Stickoxide. Mit Luft entstehen explosionsfähige Gemische.
Acetonitril greift Gummi an und löst viele Polymere. Bei Kontakt mit Schwefelsäure unter Wärmezufuhr kann eine explosionsartige Polymerisation eintreten.[1]
Es bildet mit Wasser ein azeotropes Gemisch aus 83,7 Gew.-% Acetonitril zu 16,3 Gew.-% Wasser und einem Siedepunkt von 76,5 °C, 5,5 K unter dem Siedepunkt von reinem Acetonitril.[11]
Sicherheitstechnische Kenngrößen
Acetonitril bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 2 °C.[1] Der Explosionsbereich liegt zwischen 3,0 Vol.‑% (50 g/m3) als untere Explosionsgrenze (UEG) und 17 Vol.‑% als obere Explosionsgrenze (OEG).[1] Die Sauerstoffgrenzkonzentration liegt bei 25 °C bei 12,7 Vol%.[12] Die Grenzspaltweite wurde mit 1,5 mm bestimmt.[1] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[1] Die Zündtemperatur beträgt 525 °C.[13] Der Stoff fällt somit in die Temperaturklasse T1. Die elektrische Leitfähigkeit ist mit 6·10−8 S·m−1 eher gering.[14]
Verwendung
Acetonitril ist ein gebräuchliches Lösungsmittel im Labor, in der chemischen Analytik (beispielsweise HPLC) und in der technischen Chemie, dort hauptsächlich zur Extraktion von 1,3-Butadien. Acetonitril dient als Lösemittel für Leitsalze in Doppelschichtkondensatoren.[15]
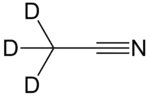
Acetonitril-d3
Vollständig deuteriertes Acetonitril (Acetonitril-d3) – in dem alle drei Wasserstoffatome durch Deuterium ausgetauscht sind – wird als Lösungsmittel in der NMR-Spektroskopie benutzt.
Sicherheitshinweise
Acetonitril wirkt reizend. Es ist gesundheitsschädlich beim Einatmen, Verschlucken und Hautkontakt. Acetonitril wird durch die Haut (perkutan) resorbiert und wirkt im Körper als Blutgift.
Acetonitril weist bei geringer Dosierung nur eine geringe Toxizität auf.[16][17] Es wird zu Cyanwasserstoff metabolisiert, welches die Ursache für die beobachteten Symptome darstellt.[18][19][20] Die Symptome treten gewöhnlich zeitverzögert auf (zwischen 2 und 12 Stunden), da es einiger Zeit bedarf, bis der Körper das Acetonitril zum Cyanid metabolisiert hat.[17]
Fälle von Vergiftungserscheinungen durch Inhalation, orale Einnahme oder Hautresorption beim Menschen sind selten, aber nicht unbekannt.[19] Zu den Symptomen, die erst einige Stunden nach Exposition auftreten, zählen Atmungsschwierigkeiten, niedriger Puls, Übelkeit und Brechreiz. In ernsten Fällen können Krämpfe und Koma auftreten, gefolgt vom Tod durch respiratorisches Versagen. Die Gegenmaßnahmen sind wie bei einer Cyanidvergiftung.[19]
Einzelnachweise
- Eintrag zu Acetonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Oktober 2020. (JavaScript erforderlich)
- Bordwell, F. G., "Equilibrium Acidities in Dimethyl Sulfoxide Solution", Acc. Chem. Res., (1988) 21, 456–463. doi:10.1021/ar00156a004
- P. Alston Steiner, W. Gordy: Precision measurement of dipole moments and other spectral constants of normal and deuterated methyl fluoride and methyl cyanide. In: Journal of Molecular Spectroscopy. Band 21, Nr. 1-4, Januar 1966, S. 291–301, doi:10.1016/0022-2852(66)90152-4.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-6.
- Eintrag zu Acetonitrile im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-05-8 bzw. Acetonitril), abgerufen am 2. November 2015.
- Datenblatt Acetonitril (PDF) bei Merck, abgerufen am 22. Februar 2010.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- B. L. Ulrich, E. K. Conklin: Detection of Methyl Cyanide in Comet Kohoutek (1973f). In: Bulletin of the American Astronomical Society. Vol. 6, 1974, S. 389 (bibcode:1974BAAS....6..389S).
- Martin Holland: Bausteine des Lebens: Komplexe organische Moleküle um fremden Stern. In: heise online. 9. April 2015, abgerufen am 13. Januar 2016.
- Jack Ponton: Azeotrope Databank. (Queriable database) The Edinburgh Collection of Open Software for Simulation and Education, Edinburgh University, September 2001, abgerufen am 20. Februar 2008.
- P. M. Osterberg, J. K. Niemeier, C. J. Welch, J. M. Hawkins, J. R. Martinelli, T. E. Johnson, T. W. Root, S. S. Stahl: Experimental Limiting Oxygen Concentrations for Nine Organic Solvents at Temperatures and Pressures Relevant to Aerobic Oxidations in the Pharmaceutical Industry. In: Org. Process Res. Dev. 19, 2015, S. 1537–1542, doi:10.1021/op500328f
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Technische Regel für Gefahrstoffe TRGS 727, BG RCI Merkblatt T033 Vermeidung von Zündgefahren infolge elektrostatischer Aufladungen, Stand August 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6.
- Henning Wallentowitz, Konrad Reif (Hrsg.): Handbuch Kraftfahrzeugelektronik: Grundlagen − Komponenten – Systeme – Anwendungen. 2. Auflage. Vieweg+Teubner, 2010, ISBN 978-3-8348-0700-7, S. 270.
- Institut National de Recherche et de Sécurité (INRS), Fiche toxicologique nº 104 : Acétonitrile, Paris, 2004.
- Philip Wexler: Encyclopedia of Toxicology. 2005, Vol. 1, Elsevier, S. 28–30.
- Spanish Ministry of Health: Acetonitrile. Risk Assessment Report (PDF; 3,1 MB), European Chemicals Bureau.
- Environmental Health Criteria (EHC) für Acetonitrile, abgerufen am 29. November 2014.
- M. Greenberg: Toxicological Review of Acetonitrile (PDF; 336 kB), United States Environmental Protection Agency, Washington, D.C., 1999.

