Formaldehyd
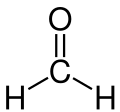
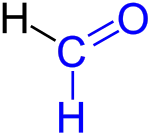
Formaldehyd (IPA: [ˈfɔɐ̯m.aldehyːt], , auch [fɔʁm.aldeˈhyːt], , systematischer Name Methanal) ist eine organisch-chemische Verbindung mit der Summenformel CH2O und der einfachste Vertreter aus der Stoffgruppe der Aldehyde. Unter Standardbedingungen ist Formaldehyd ein Gas mit einem stechenden Geruch.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Formaldehyd | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | CH2O | |||||||||||||||||||||
| Kurzbeschreibung |
farbloses, stechend durchdringend riechendes Gas[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 30,03 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
gasförmig[2] | |||||||||||||||||||||
| Dichte |
0,815 g·cm−3 (−20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
−19 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−108,6 kJ/mol[7] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Mit etwa 21 Millionen Tonnen Jahresproduktion (Stand: 2019, bezogen auf 100 % Formaldehyd) ist Formaldehyd eine der meisthergestellten organischen Chemikalien.[8] Die technische Formaldehydherstellung erfolgt katalytisch durch die Oxidation oder die Dehydrierung von Methanol, etwa im Silberkatalysator-Verfahren oder im Formox-Verfahren. In der chemischen Industrie dient es insbesondere als Ausgangsstoff bei der Produktion von Phenol- und Harnstoffharzen. Ein weiteres Polymer ist Paraformaldehyd, das unter anderem in der Zellbiologie genutzt wird. Er ist ein starkes Antiseptikum und Desinfektionsmittel, das als 40-prozentige Lösung des Aldehyds in Wasser erhältlich ist und als Fungizid und Konservierungsmittel eingesetzt wird.
In der Natur kommt Formaldehyd als Oxidationsprodukt von Terpenen sowie als Stoffwechselprodukt von Bakterien vor, die Substrate mit einem Kohlenstoffatom wie Methanol, Methan oder Methylamin zu Kohlenstoffdioxid aerob verstoffwechseln. Formaldehyd ist Teil des menschlichen Stoffwechsels. Er ist als karzinogen eingestuft.
Nomenklatur
Der systematische IUPAC-Name Methanal für molekulares Formaldehyd leitet sich vom Methan durch Anhängen des Suffix -al für Aldehyde ab. Der bevorzugte IUPAC-Name Formaldehyd stammt von „formica“ ab, dem lateinischen Wort für die Ameise, da Formaldehyd durch Oxidation in Ameisensäure überführt werden kann.
Die wässrige Lösung von Formaldehyd wird als Formalin oder seltener als Formol bezeichnet. Sie kam ab 1893 als „Formalin“ bei Schering und als „Formol“ bei Hoechst in den Handel.[9][10] Eine gesättigte wässrige Lösung enthält etwa 40 Volumen-% Formaldehyd oder 37 % Massenanteil und wird als „100 % Formalin“ bezeichnet. Dieser wird oft ein Stabilisator wie Methanol zugesetzt, um die Polymerisation zu unterdrücken. Ein typisches handelsübliches Formalin kann bis zu 12 % Methanol enthalten. Produktionszahlen für Formaldehyd werden meist auf der Basis der 37-%-Massenanteil-Formalinlösung angegeben.
In wässriger Lösung liegt Formaldehyd in seiner hydratisierten Form als Methandiol mit der Formel CH2(OH)2 vor. Diese Verbindung steht je nach Konzentration und Temperatur im Gleichgewicht mit verschiedenen, Paraformaldehyd genannten Oligomeren mit einem typischen Polymerisationsgrad von 8 bis 100 Einheiten. Durch Erhitzen kehrt sich die Reaktion um und setzt aus Paraformaldehyd wieder Formaldehyd frei. Unter dem Handelsnamen Formcel der Celanese sind Lösungen von Formaldehyd in Methanol (Methyl Formcel) mit 55,0 % Massenanteil Formaldehyd, 34,5 % Massenanteil Methanol und 10,5 % Massenanteil Wasser sowie Lösungen in Butanol und Isobutanol (Butyl Formcel) mit 40 % Massenanteil Formaldehyd, 53 % Massenanteil Butanol und 7 % Massenanteil Wasser erhältlich.[11] Trioxan ist ein Trimer von molekularem Formaldehyd.
Geschichte

Alexander Michailowitsch Butlerow synthetisierte Formaldehyd beziehungsweise Paraformaldehyd 1855 durch die Umsetzung von Diiodmethan mit Silberacetat. Das zunächst entstehende Acetat verseifte er durch Kochen mit Wasser und engte die erhaltene Lösung im Vakuum ein.[13] Butlerow, der den erhaltenen Stoff „Dioxymethylen“ nannte, erkannte jedoch nicht, dass er Paraformaldehyd hergestellt hatte. Er untersuchte die Chemie des Formaldehyds weiter und entdeckte 1861 die Formosereaktion, bei der ein Gemisch von Zuckern aus Formaldehyd entsteht.
Entwicklung der technischen Synthese
Auf der Suche nach dem ersten Glied der Aldehydreihe führte August Wilhelm von Hofmann im Jahr 1867 die erste gezielte Darstellung durch die Dehydrierung von Methanol an einem glühenden Platindraht durch.[13] Dieses Laborverfahren erlaubte die Herstellung einiger Liter Formaldehydlösung aus Methanol und damit weitere Studien zur Chemie dieses Aldehyds. So entdeckte Adolf von Baeyer 1872 dessen Kondensation mit Phenol zu Phenol-Formaldehyd-Harzen, jedoch ohne die Entdeckung weiterzuverfolgen.[14]
Bernhard Tollens optimierte die Ausbeute durch die Regelung des Verhältnisses von Methanol zu Luft; zur Vermeidung von Explosionen entwickelte er eine Flammenrückschlagsicherung in Form eines Asbestbauschs, die er zwischen der Methanolvorlage und der Platinspirale einsetzte. Oskar Loew verbesserte die Formaldehyd-Synthese durch den Einsatz von zunächst Eisen(III)-oxid und später Kupfer als Katalysator.[15]
Im Jahr 1888 begann die Firma Mercklin & Lösekann in Seelze mit der kommerziellen Produktion von Formaldehyd.[16] Ab dem Jahr 1889 wuchs der Bedarf an Formaldehyd für die Farbstoffherstellung. So konnte Acridin durch die Umsetzung von Diphenylamin mit Formaldehyd unter Katalyse mit Zinkchlorid hergestellt werden. Acridin ist der Grundkörper für Acridinfarbstoffe wie Acridinorange und Acridingelb, der bis dahin nur aus Steinkohleteer gewonnen wurde.
Die Firma Meister, Lucius und Brüning, die 1890 ein Patent zur Herstellung Formaldehyd von Jean Joseph Auguste Trillat übernahm, hatte erhebliches Interesse an der Entwicklung von medizinischen Anwendungen für wässrige Formaldehydlösungen.[17] Sie beauftragten 1892 den Frankfurter Arzt Ferdinand Blum, die antiseptischen Eigenschaften von Formaldehyd zu untersuchen. Blum zeigte die bakterioziden Eigenschaften einer 4-prozentigen Formaldehyd-Lösung auf Bakterien wie Bacillus anthracis und Staphylococcus aureus. Zufällig entdeckte er bei seinen Experimenten die Möglichkeit, Gewebeproben mit Formaldehyd zu fixieren.[9]
Kunststoffe aus Formaldehyd

Die erste größere technische Verwendung fand Formaldehyd durch die 1897 von Adolf Spitteler und Wilhelm Krische patentierte Erfindung des Galalith, eines duroplastischen Kunststoffs auf Basis von Casein und Formaldehyd. Der Kunststoff ließ sich erfolgreich vermarkten und wurde für Haarkämme und Accessoires, Stricknadeln, Stifte, Schirmgriffe, weiße Klaviertasten, Elektrogeräte und vieles mehr verwendet. Im deutschen Reich wurden 1913 etwa 6 % der gesamten Milchproduktion zur Herstellung von Galalith genutzt.[18]
Von Baeyers Arbeiten über die Kondensation von Phenol und Formaldehyd wurde von verschiedenen Chemikern aufgegriffen, so 1899 von Arthur Smith, 1902 von A. Luft, 1903 von F. Hensche, der eine alkalisch katalysierte Kondensation untersuchte und 1905 von H. Story. Doch erst Leo Baekeland erkannte 1907 mit der Herstellung des Bakelits, des ersten vollsynthetischen Kunststoffs, das Potential dieser Synthese. Seine Firma, die General Bakelit, begann 1910 mit der technischen Produktion des Bakelits.[19]
Die Bakelitprodukte neigten jedoch zum Nachdunkeln und auf der Suche nach klareren Kunststoffen entdeckte der Chemiker Hans John 1918 die Harnstoffharze.[20] Durch die Nachfrage nach den Harnstoff- und Phenolharzen stieg der Bedarf an Formaldehyd stark an.
Großtechnische Herstellung
Erst die Entwicklung der Methanolherstellung aus Synthesegas im Hochdruckverfahren an Zinkoxid-Chromoxid-Katalysatoren durch Matthias Pier und Alwin Mittasch in den 1920er Jahren gab den Anstoß zur Entwicklung einer großtechnischen Herstellung.[21] Bis zu diesem Zeitpunkt verlief die kommerzielle Gewinnung von Methanol nur als Nebenprodukt der Holzkohleherstellung, die in Deutschland 1857 durch die Firma Dietze, Morano & Cie. in Lorch begann, wobei neben Holzkohle und Methanol als weitere Produkte Essigsäure und Essigsäuremethylester anfielen.[22]
Homer Burton Adkins entwickelte in den 1930er Jahren zusammen mit Wesley R. Peterson die Adkins-Peterson-Reaktion zur direkten Oxidation von Methanol zu Formaldehyd.[23] Adkins, der zu dieser Zeit bei der Bakelite Corporation arbeitete, nutzte dazu einen Eisen-Molybdän-Oxid-Katalysator.[24] Die Jahresproduktionsmenge betrug 1931 etwa 25.000 Tonnen und hatte sich bis 1943 auf etwa 100.000 Tonnen vervierfacht.[13][16]
Verwendung in der Holzindustrie
In den 1940er Jahren stellte ein Werk in Bremen die erste Spanplatte unter Verwendung von Harnstoff-Formaldehyd-Harzen her und löste damit eine hohe Nachfrage in der Bau- und Möbelindustrie aus.[25] Durch die dadurch mögliche Verarbeitung von Holzspänen stieg der Verwertungsgrad von Bäumen von 40 % auf 80 %.
Vorkommen
Biologische Vorkommen
In der Natur kommt Formaldehyd zum Beispiel in Säugetierzellen beim normalen Stoffwechsel als Zwischenprodukt vor. Im Menschen werden auf diese Weise pro Tag etwa 878 bis 1310 Milligramm pro Kilogramm Körpergewicht gebildet. Für einen Menschen mit einem Körpergewicht von 70 Kilogramm entspricht dies 61 bis 92 Gramm Formaldehyd pro Tag.[26] Die Halbwertszeit beträgt 1 bis 1,5 Minuten.[27][28] Menschen atmen etwa 0,001 bis 0,01 mg/m3 Formaldehyd aus, dabei besteht kein signifikanter Unterschied bei Rauchern oder Nichtrauchern.[29][30] Der Formaldehydspiegel im Blut variiert zwischen 0,4 und 0,6 μg·cm−3 und im Urin zwischen 2,5 und 4,0 μg·cm−3.[31] Die tägliche Aufnahme beträgt bis zu etwa 14 mg.[28] Ebenso kommt Formaldehyd in Holz vor und diffundiert in geringen Mengen nach außen.
Methylotrophe Bakterien wie Methylophilaceae oder methanotrophe Bakterien wie Methylococcaceae verstoffwechseln eine Reihe von Verbindungen mit nur einem Kohlenstoffatom wie Methanol, Methan, Methylamin und Dichlormethan als Energiequelle. Diese Verbindungen werden über das Cytotoxin Formaldehyd metabolisiert. Die Oxidation von Formaldehyd zu Kohlenstoffdioxid ist ein wichtiger Teil des Stoffwechsels dieser aeroben Bakterien.[32]
Lebens- und Genussmittel
In Früchten wie Äpfeln oder Weintrauben kommt Formaldehyd natürlicherweise vor. Die niedrigste Formaldehyd-Konzentration in Lebensmitteln konnte in Frischmilch gemessen werden, mit einem Gehalt von 0,013 bis fast 1 mg/kg. Der höchste Gehalt wurde in gefrorenem Seehecht mit 232–293 mg/kg gemessen.[26]
Beim Konsum von einer Packung Zigaretten werden etwa 3 mg Formaldehyd pro Tag vom Raucher aufgenommen. Zum Teil enthalten E-Zigaretten Stoffe wie Propylenglykol, die beim Verdampfen Formaldehyd abgeben können. Dabei werden pro Tag vom Raucher von E-Zigaretten bei gleichem Konsum etwa 14 mg Formaldehyd aufgenommen.[33]
Bei Konservierungsverfahren wie dem Räuchern wird durch die Pyrolyse von Harthölzern Formaldehyd freigesetzt.[34] Es wirkt mikrobiozid gegen Hefen und Schimmelpilze und quervernetzend auf Proteine.
| Nahrungsmittel | Formaldehyd in [mg/kg] |
|---|---|
| Fleisch und Geflügel | 5,7–20 |
| Fisch | 6,4–293 |
| Milch und Milchprodukte | 0,01–0,80 |
| Zucker und Süßstoffe | 0,75 |
| Obst und Gemüse | 6–35 |
| Kaffee | 3,4–16 |
| Alkoholische Getränke | 0,27–3,0 |
Atmosphärische Vorkommen
Formaldehyd ist eine allgegenwärtige Spurenchemikalie und die am häufigsten vorkommende Carbonylverbindung in der Atmosphäre. Er entsteht bei der photochemischen Reaktion von Kohlenwasserstoffen oder der unvollständigen Verbrennung fossiler Brennstoffe und Biomasse.[35] Die Verbrennung von Kraftstoff und Holz sind die vorherrschenden Quellen für anthropogenes atmosphärisches Formaldehyd, wobei die größeren Emissionen von biogenen Quellen ausgehen, etwa durch Oxidation von Methan und Isopren.[36]
Die Photolyse von Formaldehyd spielt möglicherweise eine Rolle bei der Luftverschmutzung in städtischen Umgebungen. Für den photolytischen Zerfall werden zwei Reaktionswege vermutet, von denen einer über die Bildung von Wasserstoff und Kohlenstoffmonoxid verläuft.
Der zweite Reaktionsweg führt zur Bildung von Wasserstoff- und Formylradikalen.
Die Bedeutung dieses Reaktionswegs ergibt sich aus der Tatsache, dass diese Radikale eine wichtige Rolle bei der Oxidation von Stickstoffmonoxid zu Stickstoffdioxid und der Bildung von Ozon spielen.[37] Atmosphärische Senken für Formaldehyd sind Reaktionen mit Hydroxyl-Radikalen und die Photolyse. Eine wichtige natürliche Emissionsquelle für Formaldehyd ist die atmosphärische Oxidation von Methan.[38] In der tropischen Erdatmosphäre beträgt die Konzentration circa 1 ppb. Hier ist eine der Hauptquellen die Oxidation von Methan.[39] Es wird vermutet, dass photochemische Prozesse in der Ur-Atmosphäre zur Bildung von etwa 3 Millionen Tonnen Formaldehyd pro Jahr geführt haben. Der Niederschlag von Formaldehyd und anschließende Reaktionen von Formaldehyd in urzeitlichen Gewässern führten möglicherweise zu einer abiotischen Synthese komplexer organischer Moleküle und ermöglichte damit eventuell den Ursprung des Lebens.[40]
Extraterrestrische Vorkommen

Radioastronomen wiesen Formaldehyd als erstes mehratomiges organisches Molekül im interstellaren Medium in vielen Regionen unserer Galaxie mittels des Grundzustandsrotationsübergangs bei 4830 MHz vorwiegend in der Nähe junger, massereicher Sternobjekte nach.[41] Das Studium der Emissionen von Formaldehyd eignet sich zur Ableitung der räumlichen Dichte und der kinetischen Temperatur des dichten Gases in der Milchstraße und anderen Galaxien, wie NGC 660.[42]
Nach radioastronomischen Messungen des Grundzustandsrotationsübergangs von Formaldehyd beträgt das Verhältnis von 12C zu 13C in der galaktischen Scheibe zwischen 5 und 8 Kiloparsec etwa 50. Dies ist um den Faktor 2 geringer im Vergleich zum lokalen interstellaren Medium und stimmt qualitativ mit Vorhersagen aus galaktischen Evolutionsmodellen überein, die eine höhere Metallizität des Gases in der inneren galaktischen Scheibe vorhersagen.[43]
Es wird angenommen, dass Formaldehyd ein wichtiger Vorläufer für einen großen Teil komplexerer organischer Moleküle wie etwa Aminosäuren im interstellaren Medium ist. Mittels eines Massenspektrometers an Bord der Sonde Rosetta wurde im Schweif des Kometen Tschurjumow-Gerassimenko Formaldehyd nachgewiesen.[44] Mittels des Atacama Large Millimeter/submillimeter Array wurde die Verteilung von Formaldehyd in der Koma der Kometen C/2012 F6 (Lemmon) und C/2012 S1 (ISON) vermessen und detailliert beschrieben.[45][46] Durch mehrdimensionale Festkörper-NMR-Spektroskopie wurden funktionellen Gruppen in unlöslicher organischer Substanz in kohlenstoffhaltigen Chondriten identifiziert, die möglicherweise Polymerisationsprodukte des Formaldehyds sind.[47] Extraterrestrisches Formaldehyd wird als mögliche Quelle für organische Verbindungen diskutiert, die zum Leben auf der Erde führten.[48]
Herstellung
Die großtechnische Herstellung von Formaldehyd erfolgt heute praktisch ausschließlich durch zwei etablierte Verfahrensprinzipien, die beide auf den Ausgangsstoff Methanol zurückgreifen und je nach Hersteller unterschiedlich abgeändert wurden: die oxidative Dehydrierung und die Oxidation von Methanol.
In den 1970er und 1980er Jahren wurde Formaldehyd in den USA zwischenzeitlich durch radikalische Oxidation von Propan und Butan hergestellt (C3/C4-Schnitt). Ebenso wurde vor allem in Japan Formaldehyd einige Zeit lang durch Oxidation von Dimethylether produziert. Diese beiden Verfahren konnten sich aufgrund der unbefriedigenden Selektivität und hoher Produktionskosten nicht nachhaltig bewähren und werden heute nicht mehr durchgeführt.[49] Die Weltjahresproduktion von Formaldehyd betrug im Jahr 2019 etwa 21 Millionen Tonnen (bezogen auf 100 % Formaldehyd). Die größten Produktionsregionen waren der asiatisch-pazifische Raum, gefolgt von der Europäischen Union und den Vereinigten Staaten.[50] Die Herstellung von Formaldehyd findet gewöhnlich in der Nähe des industriellen Verbrauchers statt, da während des Transports über lange Strecken stabilitätsbedingte Probleme auftreten können. Das Produkt gelangt dabei meist über ein Rohrleitungsnetz zu den Verbrauchern. Der Welthandel mit Formaldehyd ist verglichen mit dem Produktionsvolumen gering. Zu den größeren Herstellern gehörten 2017 die Firmen Dynea Chemicals, Perstorp, Georgia-Pacific, Celanese, Ercros, BASF und viele andere.[50]
Oxidation von Methanol (Formox-Verfahren)
Dem ersten Verfahrensprinzip liegt eine einfache Oxidationsreaktion zugrunde. Methanol wird dabei mit Luftsauerstoff bei Temperaturen von 350–450 °C drucklos an Eisen(III)-oxid- und Molybdän(VI)-oxid-Katalysatoren in Rohrbündelreaktoren zu Formaldehyd umgesetzt.
.svg.png.webp)
Die Umsetzung erfolgt in der Gasphase und mit einem großen Überschuss an Luftsauerstoff. Die beträchtliche Reaktionswärme (ΔHR = −159 kJ·mol−1) wird mithilfe von Kühlmitteln wie Salzschmelzen, Druckwasser oder Ölen, welche die Rohre umströmen, abgeführt und zur Erzeugung von überhitztem Hochdruckdampf genutzt. Der Katalysator ist als Festbett im Reaktor angeordnet. Die katalytisch aktive Verbindung ist das Eisen(III)-molybdat [Fe2(MoO4)3], das während der Umsetzung aus der Katalysatorvorstufe gebildet wird. Dieses fungiert als Sauerstoffüberträger und oxidiert den entstehenden Wasserstoff zu Wasser. Der reduzierte Katalysator wird dabei simultan mit Luftsauerstoff regeneriert. Somit wird eine Katalysatorlebensdauer von etwa zwei Jahren erreicht. Als wesentliche Nebenreaktion tritt praktisch nur die vollständige Oxidation (Verbrennung) von Formaldehyd zu Kohlenstoffdioxid und Wasser auf. Der Methanolumsatz beträgt etwa 95–99 % und die Selektivität zu Formaldehyd erreicht 91–94 %. Das heutzutage dominierende Verfahren der Methanol-Oxidation wurde von Perstorp und Reichhold entwickelt und wird als Formox-Verfahren (von Formaldehyde by oxidation) bezeichnet.[49]
Beim Formox-Verfahren ist die Herstellung von Harnstoff-Formaldehyd-Konzentraten einfach möglich, die wässrige Formaldehyd-Lösung ist jedoch beim Silberverfahren durch einen niedrigeren Gehalt an Ameisensäure von höherer Qualität.
Oxidative Dehydrierung von Methanol
Das zweite Verfahren betrifft eine oxidative Dehydrierung von Methanol, auch Silber- oder Silberkatalysator-Verfahren genannt. Im ersten Schritt wird Methanol an metallischen Silberkatalysatoren bei Temperaturen von 600–720 °C zu Formaldehyd dehydriert.[49]
.svg.png.webp)
Der Silberkatalysator wird im Reaktor als Festbett angeordnet, meistens als Kristalle, Netze oder auf Siliciumcarbid imprägniert. Die Dehydrierungsreaktion ist eine endotherme Reaktion (ΔHR = +84 kJ·mol−1) und wird durch erhöhte Temperatur begünstigt.[49]
In einem sekundären Schritt wird der entstandene Wasserstoff mit Luftsauerstoff in einer exothermen Reaktion (ΔHR = –243 kJ·mol−1) zu Wasser verbrannt.[49]
Die Oxidation wird über die zudosierte Sauerstoffmenge gesteuert, um eine adiabatische Fahrweise zu erreichen. Die Lebensdauer des Katalysators erreicht 2–4 Monate. Folglich ist hier ein Wechsel des Katalysators deutlich öfter notwendig als beim Formox-Verfahren. Andererseits kann der Silberkatalysator sehr einfach und ohne Materialverlust elektrolytisch regeneriert werden.[49]
Aufgrund des schnellen thermischen Zerfalls und der Weiteroxidation des Formaldehyds zur Ameisensäure müssen extrem kurze Verweilzeiten (geringer als 0,01 s) eingehalten werden.[51] Aus diesem Grund sind Netzgewebekatalysatoren bevorzugt, die eine kurze Kontaktzeit an der dünnen Katalysatorschicht sowie eine schnelle Abkühlung in 0,1–0,3 s auf etwa 150 °C ermöglichen. Des Weiteren können durch den geringen Druckverlust beim Einsatz derartiger Katalysatoren sehr hohe Strömungsgeschwindigkeiten erreicht werden, womit eine effiziente Wärmeabfuhr gewährleistet ist.[49]
Es existieren Verfahrensvarianten nach BASF, Bayer, Borden, Celanese, Degussa, DuPont, ICI und Mitsubishi, die sich in der Art des Katalysators, der Reaktionstemperatur und der Aufarbeitung des Formaldehyds unterscheiden.[49]
Die drei gängigen Typen des dabei verwendeten Silberkatalysatorverfahrens sind das BASF-Verfahren mit Wassereinspritzung und fast vollständiger Umsetzung, die unvollständige Umsetzung mit anschließender Destillation nach dem Verfahren der ICI sowie das vor allem in China eingesetzte Gasrecyclingverfahren.[52]
Nach der Verfahrensvariante der BASF werden Methanol und Wasser mit Luft gemischt und über den Verdampfer (1) in den Reaktor (2) geleitet. In diesem ist der Silberkatalysator als Festbett (z. B. Netze, Kristalle) angeordnet und die Temperatur wird bei etwa 680–720 °C gehalten. Nach der Reaktion werden die heißen Reaktionsgase im Gaskühler (3) schnell auf 150 °C abgekühlt. Dies erfolgt indirekt über ein Wärmetauschersystem, das sowohl mit dem Verdampfer als auch mit dem Reaktor verbunden ist. Die Kühlung erfolgt mit Wasser. Durch eine optimale Reaktionsführung ist es möglich, pro Tonne Formaldehyd auch etwa 70 kg Wasserdampf zu erzeugen, der intern in der Anlage oder auch im Werksverbund genutzt werden kann. Die abgekühlten Reaktionsgase werden anschließend in zwei Absorptionskolonnen (4) und (5) geleitet, in denen Formaldehyd im Gegenstrom mit Wasser beziehungsweise mit der zirkulierenden Formaldehyd-Lösung ausgewaschen wird. Dabei wird eine 44%ige wässrige Formaldehyd-Lösung erhalten. Die Abgase aus der zweiten Absorptionskolonne werden entweder direkt verbrannt (Energiegewinnung) oder teilweise in den Verdampfer zurückgeführt.[53]
.svg.png.webp)
Die Ausbeute bei diesem Prozess beträgt zwischen 86,5 und 90,5 mol-%. Die wässrige Formaldehyd-Lösung weist noch einen Gehalt von 1–2 Gew.-% an Methanol und 0,01 Gew.-% Ameisensäure auf, was jedoch kein Qualitätsproblem darstellt und allgemein als verkaufsfähiges Produkt gehandhabt wird.[54]
Oxidation von Steamcrackerprodukten
Formaldehyd kann durch Oxidation von Steamcrackerprodukten erhalten werden. Dabei werden der C3-Schnitt, der Moleküle mit drei Kohlenstoff-Atomen wie Propan und Propen enthält, und der C4-Schnitt, der Moleküle mit vier Kohlenstoff-Atomen enthält wie Butan, Butene sowie Butadien, oxidiert. Die Oxidation des C3/C4-Schnitts kann mit oder ohne Katalysator durchgeführt werden. Formaldehyd fällt neben anderen sauerstoffhaltigen Komponenten wie Methanol, Acetaldehyd, Essigsäure oder Aceton an. Zur Vermeidung von Explosionen muss bei diesem Verfahren entweder im großen Luftüberschuss oder im Überschuss der Kohlenwasserstoffe gefahren werden. Als weiteres Verdünnungsmittel eignet sich Dampf. Zur Vermeidung von Folgereaktionen muss das Reaktionsgemisch schnell unter eine Temperatur von etwa 150 °C abgekühlt werden. Dies geschieht durch das Quenchen mit eingespritztem Wasser.[55]
Die Reaktionen sind in Summe exotherm – das entsprechend heiße Gasgemisch muss zur Vermeidung von Nebenreaktionen rasch abgekühlt werden. Das entstandene Formaldehydgas wird dann in Gaswäschern mittels Wasser oder einer Harnstoff-Lösung extrahiert, wobei eine wässrige Formaldehydlösung beziehungsweise ein Harnstoff-Formaldehyd-Konzentrat entsteht.[56] Die entstandenen Lösungen enthalten neben nicht umgesetztem Methanol noch geringe Mengen (etwa 100–300 ppm) Ameisensäure (HCOOH).
Eigenschaften
Physikalische Eigenschaften
Formaldehyd ist ein farbloser, stechend riechender Stoff, der bei Zimmertemperatur gasförmig vorliegt. Als Gas ist sein Geruch noch in Konzentrationen von 0,05–1 ml/m3 wahrnehmbar. Es siedet bei −19 °C. Die Dichte von flüssigem Formaldehyd beträgt 0,815 Gramm pro Kubikcentimeter (g·cm−3) bei −20 °C. Der Schmelzpunkt liegt bei −118 °C.[15]
Flüssiges und gasförmiges Formaldehyd polymerisiert leicht bis zu einer Temperatur von 80 °C, bei höheren Temperaturen liegt es monomer vor.[15] Die Geschwindigkeit der Polymerisation ist abhängig von vielen Faktoren wie Druck oder Feuchtigkeit und wird durch Spuren von Säure katalysiert.[15] Formaldehyd ist brennbar und entzündet sich ab einer Temperatur von 430 °C.[15] Es bildet mit Luft in einem weiten Konzentrationsbereich explosionsfähige Gemische. Der Explosionsbereich liegt zwischen 7 Vol.‑% (87 g/m3) als unterer Explosionsgrenze (UEG) und 73 Vol.‑% (910 g/m3) als oberer Explosionsgrenze (OEG).[57]
Das Dipolmoment von Formaldehyd beträgt 2,330 Debye (D), die Bildungsenergie −104,7 Kilojoule pro Mol (kJ·mol−1). Die kritische Temperatur beträgt 134,85 °C, der kritische Druck 65,9 bar.[58]
Die Kristallstruktur von Formaldehyd wurde bei einer Temperatur von 15 Kelvin durch Neutronendiffraktometrie bestimmt. Formaldehyd kristallisiert im tetragonalen Kristallsystem mit der Raumgruppe P421c mit acht Molekülen pro Einheitszelle. Die Moleküle sind in viergliedrigen Quadraten mit starken CO-Bindungen angeordnet, die die Mitglieder eines Quadrats verbinden.[59]
Molekulare Eigenschaften
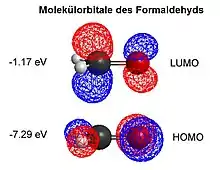
Die Elektronendichte am Sauerstoff des Formaldehyds ist im besetzten π-Orbital, dem HOMO, gegenüber dem Kohlenstoff stark vergrößert. Andererseits sind die Orbitale im unbesetzten π*-Orbital, dem LUMO, am Kohlenstoff größer, Formaldehyd ist daher ein gutes Elektrophil. In Reaktionen von Formaldehyd mit starken Nukleophilen wie Thiolen, Aminen oder Amiden ist oft keine Säurekatalyse erforderlich. Die entstehenden Hydroxymethylderivate reagieren typischerweise weiter. In Gegenwart von Säuren reagiert es in elektrophilen aromatischen Substitutionsreaktionen mit aromatischen Verbindungen, die zu hydroxymethylierten Derivaten führen.
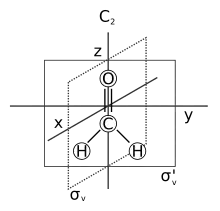
Formaldehyd ist ein planares Molekül mit einer Drehachse und zwei senkrecht zueinander stehenden Spiegelebenen und wird nach Arthur Moritz Schoenflies als C2v-symmetrisch bezeichnet. Die C=O-Bindungslänge beträgt 120 Picometer, die C-H-Bindungslänge 110 Picometer. Der HCH-Winkel beträgt 116,16 °, der HCO-Winkel dementsprechend 121,92 °.
Die Wellenzahl der C-H-Streckschwingung beträgt 2782, die der C=O-Streckschwingung 1746 cm−1. Die Wellenzahl der CH2-Biegeschwingung beträgt 1500 cm−1.[60]
Chemische Eigenschaften
Formaldehyd reagiert mit sich selbst und anderen Reaktanden in einer Reihe von Synthesen zu einer Vielzahl von Produkten. Unter diesen Reaktionen sind Oxidations-Reduktion-Reaktionen, Additions- oder Kondensationsreaktionen mit organischen und anorganischen Stoffen und Selbstpolymerisationsreaktionen.
Oxidations-Reduktions-Reaktionen
In Gegenwart von Basen disproportioniert Formaldehyd in der Cannizzaro-Reaktion zu Formiat und Methanol.[61]

Mit Aldehyden ohne Wasserstoff in der α-Position zur Carbonylgruppe reagiert Formaldehyd in einer gekreuzten Cannizzaro-Reaktion zum Alkohol und Formiat.[61]

Mit dem löslichen Diamminsilber(I)-komplex ([Ag(NH3)2]+) in alkalischer Lösung reagiert Formaldehyd in der Tollensprobe zu Ameisensäure, Silber und Ammoniak. Die Reaktion ist eine generelle Nachweisreaktion auf Aldehyde.[62]
Additions- und Kondensationsreaktionen
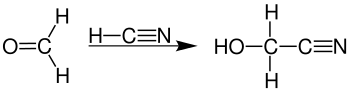
Als einfachster Aldehyd nimmt Formaldehyd in seinem chemischen Verhalten eine Sonderstellung ein, da die Aldehydgruppe nur an Wasserstoff gebunden ist. Einige der typischen Aldehydreaktionen verlaufen normal, wie etwa die Cyanhydrinsynthese zu Glycolnitril.[63]
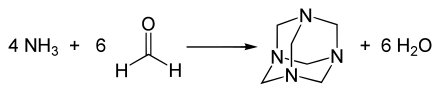
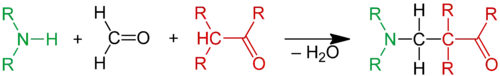
Mit Ammoniak dagegen entsteht kein Imin, sondern Hexamethylentetramin.[64]
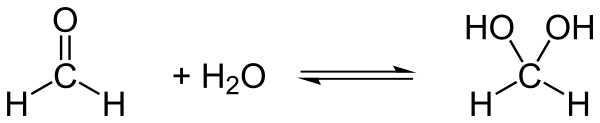
Formaldehyd ist sehr gut in Ethanol, Diethylether und Wasser löslich. In wässriger Lösung bildet sich ein Aldehydhydrat (Methandiol), wobei das Gleichgewicht dieser Reaktion – anders als z. B. bei Ethanal – zu fast 100 % auf der Seite des Hydrats liegt. Das Hydrat reagiert schwach sauer (pKs 13,3).
Formaldehyd geht eine Reihe weiterer Kondensationsreaktionen mit einem breiten Spektrum von Reaktanden ein, wie etwa in der Sulfomethylierung oder der Mannich-Reaktion. Die Mannich-Reaktion ist eine Aminoalkylierung einer CH-aciden Verbindung mit Formaldehyd und einem primären oder sekundären Amin oder Ammoniak. Das Produkt ist eine β-Amino-Carbonyl-Verbindung, die als Mannich-Base bekannt ist.[65]
Nitromethan reagiert in einer Henry-Reaktion im Formaldehydüberschuss zum 2-Nitro-1,3-dihydroxy-2-hydroxymethyl-propan. Basische Verbindungen wie Amine katalysieren die Reaktion.[66]
Mit Benzol und Chlorwasserstoff reagiert Formaldehyd in der durch Zinkchlorid oder andere Lewis-Säuren katalysierten Blanc-Reaktion unter Bildung von Chlormethylarenen.[67]
Mit Cobaltcarbonylhydrid reagiert Formaldehyd in einer der Hydroformylierung ähnlichen Reaktion.
Durch Insertion von Kohlenstoffmonoxid in die Cobalt-Kohlenstoffbindung bildet sich ein Acylkomplex, der mit einem weiteren Äquivalent Cobaltcarbonylhydrid zum Glykolaldehyd und Dicobaltoctacarbonyl reagiert.[68]
In den 1960er Jahren wurde durch die Reaktion von Formaldehyd, Kohlenstoffmonoxid, Wasser und Schwefelsäure Glykolsäure hergestellt. Veresterung mit Methanol und anschließende Hydrierung lieferte Ethylenglykol.[68] Die Jahresproduktion nach diesem Verfahren betrug Mitte der 1960er Jahre noch etwa 60.000 Jahrestonnen, es wurde jedoch aus Kostengründen 1968 eingestellt.[69]
In gekreuzten Aldolreaktionen reagiert Formaldehyd als Enolat-Anion-Akzeptor. Mit Aceton reagiert Formaldehyd etwa zu 4-Hydroxy-2-butanon. Mit Grignard-Verbindungen reagiert Formaldehyd nach Hydrolyse zu Alkoholen.
Formaldehyd reagiert mit einem oder zwei Äquivalenten Alkohol unter Bildung von Halb- oder Vollacetalen.
Selbstpolymerisationsreaktionen
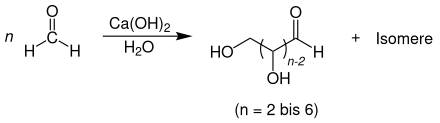
In der Formosereaktion bilden sich Zucker durch die Selbstkondensation von Formaldehyd. Basen zweiwertiger Metalle wie Calciumhydroxid oder Bariumhydroxid katalysieren diese Reaktion. Ronald Breslow schlug 1959 einen katalytischen Zyklus vor.[70] Die Reaktionsfolge beinhaltet Aldolreaktionen, Retro-Aldolreaktionen und Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerungen unter Bildung von Zwischenprodukten wie Glykolaldehyd, Glycerinaldehyd, Dihydroxyaceton und Tetrosen. Der Begriff Formose ist ein Kofferwort aus Formaldehyd und Aldose.
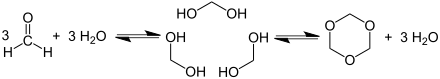
Formaldehyd polymerisiert in Gegenwart von Säurespuren leicht zu Polyoxymethylenen oder er trimerisiert zum Trioxan.[71] Die Reaktion ist reversibel, bei höheren Temperaturen zerfallen die Polymere und Oligomere wieder in Formaldehyd.
Verwendung
Formaldehyd ist einer der wichtigsten organischen Grundstoffe in der chemischen Industrie und dient als Ausgangsstoff für viele andere chemische Verbindungen. Der bei weitem größte Markt liegt im Bereich der Harnstoff-Formaldehyd-Harze, der Phenoplaste, der Polyoxymethylene sowie einer Reihe von weiteren chemischen Zwischenprodukten wie Pentaerythrit. Formaldehyd findet unter anderem Anwendung bei der Herstellung von Farbstoffen, Arzneistoffen und bei der Textilveredelung. Da Formaldehyd wie alle Aldehyde ein starkes Reduktionsmittel ist, wird er zur Keimabtötung verwendet. Im Labor wird Formaldehyd unter anderem im Rahmen der Mannich-Reaktion und der Blanc-Reaktion eingesetzt.
Aminoplaste

Mit Harnstoff reagiert Formaldehyd zu Harnstoff-Formaldehyd-Harzen (UF-Harzen; von Urea-Formaldehyden), mit Melamin zu den Melamin-Formaldehyd-Harzen (MF-Harzen), die beide zu den Aminoplasten gehören. Im ersten Schritt entstehen Monomethylolharnstoff und Dimethylolharnstoff:
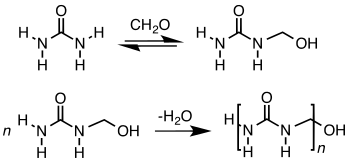
Durch weitere Kondensation entstehen kettenförmige Polymere, die gegebenenfalls vernetzt werden können. Harze auf Basis von Harnstoff-Formaldehyd sind die bedeutendsten Arten von Klebharzen für die Herstellung von Holzwerkstoffen wie Spanplatten, Faserplatten und Hartholzsperrholz. Die fehlende Wasserbeständigkeit des gehärteten Harzes aufgrund der Reversibilität der Aminomethylenbindung kann durch Zugabe von Stoffen wie Melamin behoben werden.
Das bei weitem größte Anwendungsgebiet von Formaldehyd ist die Herstellung von Harnstoff-Formaldehyd-Harzen, die als Bindemittel für nicht-strukturelle Holzwerkstoffe, etwa Spanplatten und mitteldichte Faserplatten (MDF), dienen.[72]
Melamin-Formaldehyd-Harze werden als imprägnierende Harze bei erhöhten Anforderungen an die Feuchtebeständigkeit, etwa zum Aufbringen von Dekopapieren auf Laminatböden oder als ein Bestandteil in Bambusgeschirr[73] verwendet. In Form von Klarlacken werden MF-Harze in der Automobilindustrie eingesetzt.[74]
N-Methylolverbindungen aus Formaldehyd und Harnstoff, wie Methylolharnstoff, die durch weitere Kondensation Aminoplaste in der Faser bilden, werden bei Zellulosefasern wie Baumwollfasern oder Viskosefasern als Textilhilfsmittel eingesetzt. Diese dienen der Verbesserung des Knitter- und Krumpfverhaltens und erhöhen damit die Formbeständigkeit von Textilien. Die Polykondensation der N-Methylolverbindungen erfolgt meist im sauren Milieu bei erhöhter Temperatur. Bei der Kondensation entsteht im gewissen Umfang Formaldehyd. Die eingelagerte Menge an Aminoplasten beträgt etwa 8 % bezogen auf das Textiliengewicht.[75] Unter gesundheitlichen Aspekten ist bei der Textilveredelung auf eine geringe Menge an freiem und freisetzbarem Formaldehyd zu achten. Textilien, die beim bestimmungsgemäßen Gebrauch mit der Haut in Berührung kommen und mehr als 0,15 Prozent freies Formaldehyd enthalten, müssen entsprechend gekennzeichnet werden.
Phenoplaste
Phenolformaldehydharze (PF) oder Phenoplaste sind synthetische Polymere, die durch die Kondensationsreaktion von Phenol oder substituiertem Phenol mit Formaldehyd hergestellt werden. Je nachdem, ob die Kondensation sauer oder basisch abläuft, entstehen Novolake oder Resole.[76] Novolake sind niedermolekulare Polymere, die durch die säurekatalysierte Kondensation von Formaldehyd mit einem Gemisch von Kresolen hergestellt werden. Novolake werden in der Mikroelektronik als Fotolackmaterialien verwendet.
Resole sind Produkte der basenkatalysierten Phenol-Formaldehyd-Kondensation. Sie werden mit einem Überschuss von Formaldehyd zu Phenol hergestellt. Die reaktive Spezies sind Phenolate, die durch Deprotonierung von Phenol gebildet werden. Als Duroplaste vernetzen die gebildeten Hydroxymethylphenole beim Erhitzen auf etwa 120 °C unter Bildung von Methylen- und Methylätherbrücken unter Eliminierung von Wasser. Eine hohe Vernetzung über die Stufen des Resitol und Resit verleiht den Resolen eine Härte, thermische Stabilität und chemische Beständigkeit.
Phenolformaldehydharzen wird Hexamethylentetramin als Härtungskomponente zugesetzt. Es wird industriell durch die Reaktion von sechs Äquivalenten Formaldehyd mit vier Äquivalenten Ammoniak hergestellt.
Durch Co-Kondensation von Phenol, Phenolsulfonsäure und Formaldehyd entstehen Kationenaustauscher. Diese Netzpolymere besitzen fest gebundene, anionische Sulfatgruppen sowie frei bewegliche Kationen.[77]
Polyoxymethylen
Polyoxymethylen ist ein Thermoplast, der in Präzisionsteilen verwendet wird, die eine geringe Reibung und hohe Dimensionsstabilität erfordern. Polyoxymethylen zeichnet sich durch hohe Festigkeit, Härte und Steifigkeit aus. Aufgrund seiner hohen Kristallinität ist es ungefärbt opak weiß. Die Automobil- und Elektronikindustrie verwendet spritzgegossenes POM für technische Komponenten wie Zahnräder, Kugellager oder Befestigungselemente.[78]
Pentaerythritherstellung
Pentaerythrit wird über eine basenkatalysierte Polyadditionsreaktion zwischen Acetaldehyd und drei Äquivalenten Formaldehyd hergestellt. Das Intermediat reagiert in einer gekreuzten Cannizzaro-Reaktion mit einem vierten Äquivalent Formaldehyd zum Pentaerythrit.
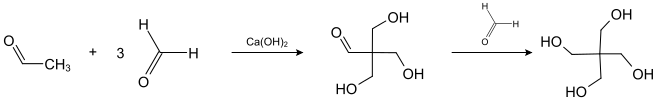
Es wird überwiegend zur Herstellung von polyfunktionalisierten Verbindungen verwendet und findet sich in Kunststoffen, Farben, Kosmetika und vielen anderen Anwendungen. Weiterhin dient er zur Herstellung von Sprengstoffen wie Nitropenta und Pentaerythrittrinitrat.[79]
Methylendiphenylisocyanate
Der erste Schritt bei der Herstellung von Methylendiphenylisocyanaten (MDI) ist die Reaktion von Anilin und Formaldehyd unter Verwendung von Salzsäure als Katalysator.
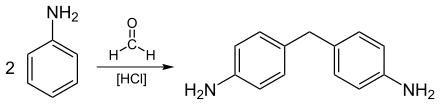
Dabei wird eine Mischung von Diaminvorläufern und den entsprechenden Polyaminen hergestellt. Die weltweite Produktion von Methylendiphenylisocyanaten betrug 2018 circa 9,8 Millionen Tonnen, wofür etwa 1,2 Millionen Tonnen Formaldehyd benötigt wurden.[80] Die Herstellung von Methylendiphenylisocyanaten ist ein schnell wachsender Markt für Formaldehyd. Hauptanwendungen sind Polyurethanschäume, Anstrichmittel, Klebstoffe, Elastomere und Dichtungsmittel, die im Bauwesen, für Haushaltsgeräte, Schuhe und andere Konsumgüter sowie in der Automobilindustrie eingesetzt werden.
1,4-Butandiol
Die industriellen Synthese von 1,4-Butandiol erfolgt über die Reaktion von Acetylen mit zwei Äquivalenten Formaldehyd.
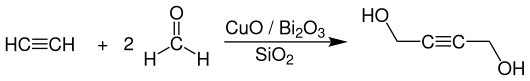
Das im ersten Schritt entstehende 2-Butin-1,4-diol ergibt durch Hydrierung 1,4-Butandiol.
.svg.png.webp)
1,4-Butandiol wird als Lösungsmittel und bei der Herstellung von Kunststoffen, elastischen Fasern und Polyurethanen verwendet. Bei höherer Temperatur in Gegenwart von Phosphorsäure cyclisiert es unter Wasserabspaltung zu Tetrahydrofuran, einem wichtigen Folgeprodukt.[79]
Formaldehydabspalter
Der Einsatz von Formaldehyd als biozider Wirkstoff vor allem in kosmetischen Produkten erfolgt meist in Form eines Formaldehydabspalters. Dies sind Kondensationsprodukte von Formaldehyd wie Diazolidinylharnstoff oder Diole wie Bronopol, die das Formaldehyd langsam freisetzen. Auf diesem Weg ist die Konzentration von freiem Formaldehyd sehr genau einstellbar und über die gesamte Lebensdauer des Produktes nahezu konstant. Da das Wirkstoffdepot auch ohne Mikrobenbefall aufgebraucht wird, haben die so konservierten Produkte in jedem Fall nur eine begrenzte Haltbarkeit. Direkt zugesetztes Formaldehyd würde sich durch Diffusion und Zerfallsprozesse immer weiter abreichern, so dass relativ hohe Dosierungen eingesetzt werden müssten, um eine vergleichbare Haltbarkeit zu erreichen.
Seit 2019 ist die direkte Verwendung von Formaldehyd in kosmetischen Mitteln nicht mehr zulässig.[81] Somit bleibt nur der Einsatz von Formaldehydabspaltern, sofern es auf diesen Wirkstoff ankommt. Der Anhang V der EU-Kosmetikverordnung enthält Vorschriften für den Einsatz von Bioziden in kosmetischen Mitteln in der Europäischen Union. Wird eine Konzentration an freiem Formaldehyd, auch wenn dies durch Formaldehydabspalter freigesetzt wurde, im kosmetischen Produkt von 0,05 % überschritten, muss dies in Form der Angabe „Enthält Formaldehyd“ deklariert werden.[82]
Totimpfstoffe
Anfang der 1920er Jahre wurde durch die Arbeiten von Alexander Glenny und Barbara Hopkins zufällig entdeckt, dass Formaldehyd verschiedene bakterielle Toxine aber auch Viren unschädlich machen kann.[83] Daher wird es in der Impfstoffherstellung zur Inaktivierung von Impfviren (z. B. Poliovirus) oder Bakterientoxinen (z. B. Diphtherietoxin, Tetanustoxin oder Pertussis-Toxin) verwendet.[84] Übermäßiges Anwenden von Formaldehyd während der Inaktivierung kann zu einer Konformationsänderung der betroffenen Antigene führen, was sich auf deren Immunogenität nachteilig auswirkt.[83] Nach Aufreinigung darf die fertige Impfstoffzubereitung maximal 200 mg (Humanimpfstoffe)[85] beziehungsweise 500 mg (Tierimpfstoffe)[86] Formaldehyd pro Liter enthalten. Bei Humanimpfstoffen entspricht das damit einer maximalen Konzentration von max. 0,2 mg/ml beziehungsweise 0,02 %.[87] Nach der Inaktivierung mittels Formaldehyd wird es größtenteils wieder entfernt, so dass in der Regel 1–200 µg pro Impfstoff injiziert werden.[83][28]
Die Menge einer einzelnen Impfung beim Menschen ist etwa mindestens 600-mal geringer als die Menge, die bei Tierversuchen eine Toxizität verursachen kann. Da die Menge an Formaldehyd häufig ohnehin unter der maximal erlaubten liegt und für einen Epikutantest auf Formaldehyd zur Allergietestung in der Regel eine Konzentration von 1 % genutzt wird, kann infolgedessen die Menge an Formaldehyd eines beliebigen Impfstoffes keine Hautreaktionen auslösen – selbst wenn sie direkt in oder auf die Haut appliziert würde.[87] Im Blut zirkuliert etwa 10-mal so viel Formaldehyd wie in einer Impfung enthalten ist. Die enthaltene Menge an Formaldehyd ist so gering, dass der physiologische Formaldehydgehalt des Muskels durch eine Impfung sogar verdünnt wird.[88] Daher besteht keine Gefahr durch Formaldehyd nach einer Impfung.[28]
Haltbarmachung von anatomischen und biologischen Präparaten

4- bis 8-prozentige Formaldehydlösung wird als gängiges Fixierungsmittel in der Histotechnik eingesetzt. Formaldehyd ist ein Protein vernetzendes additives Fixans, stoppt die Autolyse und Fäulnis von Gewebeproben und macht diese dauerhaft haltbar. Als Faustregel gilt eine Eindringgeschwindigkeit von 1 mm/h. Die Geschwindigkeit der Vernetzung ist erheblich langsamer als das primäre Anlagern von Formaldehyd, mindestens 2–3 Tage werden für eine ausreichende Fixierung benötigt. Es werden dabei Methylenbrücken und Brücken über Schiff’sche Basen ausgebildet. Die Anbindung kann durch Auswaschen in Wasser oder durch Einwirkung von heißen Pufferlösungen unterschiedlicher pH-Werte wieder rückgängig gemacht werden (Antigen-Retrieval). Methylenbrücken sollen stabil sein. Die Vernetzung und Modifikation von Biomolekülen mit Formaldehyd kann durch Erhitzen und/oder durch Zugabe von Basen wieder rückgängig gemacht werden.[89][90][91]
Weiterhin wird eine solche Formaldehyd-Lösung zur Leichenkonservierung benutzt sowie zur Konservierung von anatomischen und biologischen Präparaten wie Insekten, erstmals 1893 vorgeschlagen von Isaak Blum. Da derart eingelegtes Material jahrelang haltbar ist, kann es problemlos als Anschauungs- oder Vergleichsmaterial in der Medizin und Biologie für Forschungs- und Lehrzwecke herangezogen werden. Zu künstlerischen Zwecken konservierte der britische Künstler Damien Hirst einen Hai als Kunstwerk in Formaldehyd.[92]
Trotz der Gesundheitsgefahren ist Formaldehyd insbesondere aufgrund seiner generellen antiseptischen Eigenschaften weiterhin weitgehend unverzichtbar in der Haltbarmachung und Konservierung von Geweben, jedoch ist die technische Umstellung der Arbeitsbereiche zur Einhaltung des Arbeitsplatzgrenzwertes wie beispielsweise durch Absaugung direkt am Arbeitsbereich und die Verringerung der Konzentration von Formaldehyd in Konservierungslösungen ein zentrales Thema in der modernen Anatomie und Pathologie.[93][94][95][96][97]
Desinfektion und Sterilisation
Formaldehyd wird in vielfältiger Weise zu Desinfektion und Sterilisation verwendet. Zur Raumdesinfektion wird Formaldehyd gasförmig oder in wässriger Lösung auf alle Flächen in einem Raum aufgebracht. Neben dem Verdampfen kann Formaldehyd vernebelt werden oder es können Stoffe verwendet werden, die Formaldehyd freisetzen. Weiterhin kann die Desinfektion durch das Wischen mit Formaldehyd-haltigen Mitteln erfolgen. Dabei wird Formaldehyd von Oberflächen adsorbiert und muss nach der Behandlung gründlich durch Spülvorgänge entfernt werden. Für medizinisch verwendete Kleinteile kann die Begasung mit Formaldehyd in Formaldehydsterilisatoren erfolgen.[98]
In der Intensivtierhaltung wird Formaldehyd als Begasungsmittel zur Prävention von Infektionserkrankungen durch Viren oder Bakterien eingesetzt. So erfolgt beispielsweise in der Hühneraufzucht und -mast eine Begasung in der Regel vor jedem Neubesatz der Ställe.[99]
In der Technischen Regel für Gefahrstoffe (TRGS) 512 "Begasungen" und einer Veröffentlichung der Europäischen Agentur für Sicherheit und Gesundheitsschutz am Arbeitsplatz wird Formaldehyd als Begasungsmittel für Frachtcontainer aufgeführt. Darüber hinaus kann Formaldehyd in Containern vorkommen, wenn es als Industriechemikalie aus transportierten Produkten ausgast. Bei höheren Konzentrationen von Formaldehyd sind dabei für Beschäftigte beim Umgang mit Containern in Häfen Lungenödeme, Entzündungen der Bronchien und Lungenentzündungen möglich.[100]
Umweltaspekte
Formaldehyd reichert sich nicht in der Umwelt an, da es durch Sonnenlicht oder durch im Boden oder Wasser vorhandene Bakterien abgebaut wird. Die meisten Organismen metabolisieren Formaldehyd schnell und wandeln es in Ameisensäure um, sodass es nicht zu einer Bioakkumulation kommt.
Innenräume
Bestimmte formaldehydhaltige Materialien, unter anderen Holzwerkstoffe, Bodenbeläge, Möbel und Textilien, können durch Ausgasung eine Kontamination der Atemluft in geschlossenen Räumen bewirken. In den achtziger Jahren sind in diesem Zusammenhang insbesondere Spanplatten und Sperrholz, zu deren Herstellung Aminoplaste als Bindemittel eingesetzt wurden, unter Verdacht gekommen. Es sind jedoch zum einen heute viele formaldehydfrei verklebte Holzwerkstoffe und Möbel im Handel erhältlich. Zum anderen wurden die Emissionen in den auf Formaldehyd basierenden Holzwerkstoffen deutlich reduziert. Die Schadstoffsanierung formaldehydbelasteter Gebäude ist vor allem bei älteren Holzfertighäusern nach wie vor ein großes Thema.
Holz selbst emittiert Formaldehyd durch den thermischen Abbau von Polysacchariden. Die Emissionswerte hängen von der Holzart, dem Feuchtigkeitsgehalt, der Temperatur und der Lagerzeit des Holzes ab. Frisches Eichenholz emittiert etwa 430 μg, trockenes Eichenholz etwa 50 μg Formaldehyd pro Quadratmeter und Stunde.[101]
Beim Rauchen entsteht durch unvollständige Verbrennung Formaldehyd, das nicht unerheblich zur Belastung der Raumluft beiträgt. Im Gesamtrauch einer einzigen Zigarette finden sich etwa 0,02–0,1 mg Formaldehyd.
Umwelt
Eine wichtige Quelle für die Emission von Formaldehyd sind unvollständig ablaufende Verbrennungsprozesse. Diese finden sich beispielsweise in Verbrennungsmotoren von Kraftfahrzeugen, in Gießereien und bei der Herstellung von Kunststoffartikeln. Bei der Verbrennung von Bio-, Klär- und Deponiegasen in Gasmotoren werden im Abgas häufig hohe Formaldehydkonzentrationen gemessen. Damit die Emissionswerte die gesetzlich festgelegten Grenzwerte nicht überschreiten, ist meist eine Nachbehandlung des Abgases erforderlich.[102]
Problematisch ist die Verbrennung von Holz in Kleinfeuerungsanlagen, da hier durch unregelmäßige Beschickung oder feuchtes Holz die Verbrennung häufig unvollständig abläuft. Dabei entstehen in diesen im Hausbetrieb eingesetzten Anlagen Formaldehydkonzentrationen von 50–100 mg·m−3, was sich für die alten Bundesländer auf eine Gesamtemission von etwa 1000 Tonnen pro Jahr addiert (Schätzung für 1980). Die wesentlich ergiebiger und sauberer arbeitenden industriellen Großfeuerungsanlagen für die Brennstoffe Gas, Öl und Kohle hatten im Jahr 1980 eine Gesamtemission von nur 50 Tonnen pro Jahr. Um der Luftverschmutzung durch Kaminöfen und andere Kleinfeuerungsanlagen entgegenzuwirken, hat die Bundesregierung in der Verordnung über kleine und mittlere Feuerungsanlagen vom 26. Januar 2010 festgeschrieben, dass für eine Verbrennung nur naturbelassene Hölzer zugelassen sind, die genügend lange abgelagert wurden.[103][104]
Emissionsmessung
Zur Emissionsmessung können verschiedene Verfahren zum Einsatz kommen. Beim MBTH-Verfahren werden kurzkettige aliphatische Aldehyde, darunter Formaldehyd, in Summe bestimmt. Für die Bestimmung wird ein Teilstrom des beladenen Abgases in Reaktion mit 3-Methyl-2-benzothiazolinonhydrazon (MBTH) gebracht. Dabei entsteht ein blau gefärbtes Tetraazapentamethincyanin-Kation, das photometrisch vermessen werden kann.[105]
Zur Anwendung des DNPH-Verfahrens wird ein Abgas, das Aldehyde und Ketone enthält, mit 2,4-Dinitrophenylhydrazin (DNPH) zur Reaktion gebracht. Dies kann entweder in einer Absorptionslösung[106] oder auf einem Adsorbens[107] erfolgen. Die entstehenden 2,4-Dinitrophenylhydrazone können im Anschluss mit Hochleistungsflüssigkeitschromatographie und UV-Detektion einzeln bestimmt werden.[108] Sofern Methenamin (Urotropin) im zu beprobenden Abgas enthalten ist, führen sowohl das DNPH-Verfahren[106] als auch das MBTH-Verfahren[109] aufgrund von Querempfindlichkeiten zu erhöhten Ergebnissen. In diesem Fall empfiehlt sich das AHMT-Verfahren.[109][110] Werden neben Formaldehyd Acrolein und Acetaldehyd im Abgas vermutet, so kann das 2-HMP-Verfahren zum Einsatz kommen, bei dem die im Abgas enthaltenen Aldehyde mit 2-(Hydroximethyl)-Piperidin (2-HMP) reagieren und die Reaktionsprodukte anschließend gaschromatographisch analysiert werden.[111] Bei Abgasen mit hohem Wassergehalt kann das Acetylaceton-Verfahren zum Einsatz kommen.[112]
Im Abgas von Verbrennungsmotoren wird der Formaldehydgehalt mittels automatisiertem FTIR-Verfahren ermittelt. Das zu beprobende Abgas durchströmt eine Messzelle, die von Infrarotstrahlung durchleuchtet wird. Die Abschwächung bestimmter Wellenlängen gibt Auskunft über die Zusammensetzung des Abgases.[113]
Toxikologie

Formaldehyd wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit und die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Formaldehyd waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, der Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung. Die Neubewertung fand ab 2013 statt und wurde von Frankreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[114][115]
Akute Toxizität
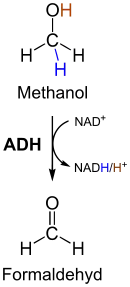
Formaldehyd kann bei unsachgemäßer Anwendung Allergien, Haut-, Atemwegs- oder Augenreizungen verursachen. Akute Lebensgefahr (toxisches Lungenödem, Pneumonie) besteht ab einer Konzentration von 30 ml/m³. Bei chronischer Exposition ist er karzinogen und beeinträchtigt zudem das Gedächtnis, die Konzentrationsfähigkeit und den Schlaf.[116]
Die meisten Vergiftungen treten nicht durch direkten Kontakt mit Formaldehyd auf, sondern durch das Trinken von Methanol in minderwertigen Alkoholgetränken. Dabei wandelt sich das Methanol im Körper zunächst durch Alkoholdehydrogenase in Formaldehyd und danach schnell durch Aldehyddehydrogenasen in Ameisensäure um. Diese wird nur langsam metabolisiert und kann zur Azidose führen. Formaldehyd selbst denaturiert besonders leicht Netzhautproteine, was zur Erblindung führen kann.[117] Durch die Zugabe von Formaldehyd wurden verschiedene Lebensmittelskandale verursacht. Zu den verunreinigten Lebensmitteln gehörten Nudeln, gesalzener Fisch, Tofu, Hühnchen, Obst und Gemüse wie Kohl.[118]
Die therapeutischen Maßnahmen bei einer Formaldehydintoxikation sind vielfältig. Bei oraler Aufnahme ist die Gabe von Aktivkohle zweckmäßig (nicht jedoch Milch, welche die Resorptionsgeschwindigkeit erhöht). Die Behandlung der Azidose erfolgt durch eine Natriumhydrogencarbonat-Infusion. Eine weiterführende Therapie kann durch Gabe von Hustensedativa, inhalativen β-Sympathomimetika oder inhalativen Glucocorticoiden durchgeführt werden. Durch Ammoniakdämpfe wird die Wirkung von Formalindämpfen unter Bildung von Hexamethylentetraamin aufgehoben.
Karzinogenes Risiko
Rechtsverbindlich ist Formaldehyd seit dem 1. April 2015 im Anhang VI der Verordnung 2008/1272/EG über die Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen in der Kategorie 1B eingestuft: „wahrscheinlich karzinogen beim Menschen“.[4] Formaldehyd hat im Tierversuch mit Ratten nachweislich karzinogene Wirkung gezeigt, allerdings erst bei hohen Konzentrationen ab 6 ml/m3. Im Jahr 2004 änderte die Internationale Agentur für Krebsforschung (IARC) der Weltgesundheitsorganisation WHO die seit 1995 bestehende Einstufung von Formaldehyd von „Verdacht auf krebserregende Wirkung“ auf „krebserregend für den Menschen“. Karzinogen, mutagen oder reproduktionstoxisch eingestufte Stoffe („CMR-Stoffe“) gelten als besonders gefährlich und müssen durch weniger gefährliche Stoffe ersetzt werden. Hintergrund der WHO-Einstufung ist eine epidemiologische Studie, die bei Arbeitern, die mehrere Jahre in der Industrie Formaldehyd ausgesetzt waren, eine erhöhte Sterblichkeit durch Tumoren des Nasen-Rachenraumes aufgezeigt hat.[119]
Durch die WHO-Studie sah sich das Bundesinstitut für Risikobewertung (BfR) veranlasst, die krebsauslösenden Risiken von Formaldehyd neu zu bewerten.[120] Seit 2006 sieht das BfR aufgrund der Ergebnisse der eigenen Studie die krebserzeugende Wirkung von Formaldehyd bei Aufnahme über die Atemluft als hinreichend belegt an. Der Effekt ist konzentrationsabhängig:
Eine rechtsverbindliche Einstufung in die Kategorie Carc 1B trat zum 1. April 2015 in Kraft.
In den USA wurde Formaldehyd 1981 im zweiten Bericht über Krebserreger zunächst mit dem Verdacht der krebserzeugenden Wirkung beim Menschen klassifiziert. Seit Juni 2011 stuft das US-Gesundheitsministerium Formaldehyd als krebserzeugend für den Menschen ein, da die vorliegenden Studien dies hinreichend belegen.[123]
Allergen
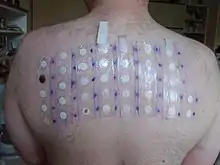
Für die meisten Menschen ist eine Reizung durch Formaldehyd vorübergehend und reversibel, er kann jedoch Allergien auslösen. Formaldehyd ist ein Kontaktallergen. Bei sensibilisierten Menschen kann Formaldehyd bereits in einer Konzentration von 0,05 % allergische Symptome hervorrufen. Bei einer Epikutantestreihe der North American Contact Dermatitis Group (NACDG) mit etwa 4.500 Patienten erwies sich Formaldehyd als das siebthäufigste Allergen, wobei 9,0 % der Getesteten eine allergische Reaktion zeigten.[124] Die allergische Reaktion zeigt sich oft in Hautläsionen wie Hautbläschen in den Bereichen, die direkten Kontakt mit der Substanz aus Textilien oder Kosmetika hatten.
Grenzwerte
Gemäß der CLP-Verordnung müssen formaldehydhaltige Desinfektionsmittel mit Gefahrensymbolen und Warnhinweisen wie „Kann allergische Hautreaktionen verursachen“, „Verursacht schwere Verätzungen der Haut und schwere Augenschäden“ oder „Kann Krebs erzeugen“ gekennzeichnet werden.[4] Aufgrund der Einstufung von Formaldehyd gemäß der CLP-Verordnung erließen die Gesetzgeber auf nationaler und europäischer Ebene verschiedene Verordnungen zu Obergrenzen der Formaldehydkonzentration und zur Kennzeichnung von Produkten mit Formaldehyd. So regelt die Bedarfsgegenständeverordnung die Kennzeichnung von Wasch- und Reinigungsmitteln mit einer Konzentration von mehr als 0,1 % bis 0,2 % freiem Formaldehyd.[125]
Die Chemikalien-Verbotsverordnung untersagt das Inverkehrbringen von Wasch- und Reinigungsmitteln mit einer höheren Konzentration als 0,2 % Formaldehyd.[126] Laut der REACH-Verordnung gilt in Kleidung, Schuhwaren und Textilien, die nicht mit der menschlichen Haut in Kontakt kommen, ein Grenzwert von 300 mg Formaldehyd pro Kilogramm, ab 1. November 2023 wird der Grenzwert auf 75 mg/kg gesenkt.[127] Die Europäische Norm „Sicherheit von Spielzeug“ Teil 9 (DIN EN 71-9) regelt den Gehalt von Formaldehyd in Spielzeugen.
Im Bereich von Textilien (Bekleidung) gilt bei freiwilligen Schadstoffprüfungen im Rahmen eines Prüfsiegels (etwa Toxproof oder Öko-Tex 100) eine Bestimmungsgrenze von 16 mg/kg (16 ppm). Dies ist zugleich der Grenzwert für Baby-Bekleidung. Für hautnah getragene Kleidung gelten 75 mg/kg, für andere Textilien 300 mg/kg. Der zulässige „Grenzwert“ in Deutschland liegt bei 1500 mg/kg (1500 ppm). Dies ist kein echter Grenzwert, da nur ein Hinweis angebracht werden muss, dass empfohlen wird, das Kleidungsstück zur besseren Hautverträglichkeit vor dem ersten Tragen zu waschen.
Der Ausschuss für Innenraumrichtwerte legte 2016 einen Richtwert für die Innenraumluft von 0,1 mg/m³ fest.[128] Im Bauwesen ist für Gebäude bei einer Zertifizierung nach der Deutschen Gesellschaft nachhaltiges Bauen (DGNB) ein Formaldehyd-Grenzwert von 120 μg/m³ definiert, bei dessen Überschreitung keine Zertifizierung möglich ist. Ferner ist ein Zielwert von 60 μg/m³ definiert.[129] Die Arbeitsgemeinschaft ökologischer Forschungsinstitute e. V. (AGÖF) hat darüber hinaus einen Orientierungswert für Planungen von 30 μg/m³ herausgegeben.[130]
Im März 2015 wurden Ergänzungen der rechtsverbindlichen Arbeitsplatzgrenzwerte der TRGS 900 bekannt gegeben. Dabei wurde der Wert für die Maximale Arbeitsplatz-Konzentration von 0,3 ml/m3 entsprechend 0,37 mg/m3 festgelegt, der von der Deutschen Forschungsgemeinschaft (DFG) empfohlen wurde.[131]
Nachweis
Ein Nachweis von freiem oder abspaltbarem Formaldehyd ist mit Chromotropsäure durch die Chromotropsäure-Reaktion möglich. Ein Nachweis ist mit Methylbenzothiazolonhydrazon oder fuchsinschwefliger Säure (Schiffsches Reagenz) möglich. Gasförmiges Formaldehyd ist zudem über seine Absorption im nahen UV[132] und im infraroten Spektralbereich spektroskopisch nachweisbar. Dies erlaubt die Messungen von Formaldehydkonzentrationen in der Erdatmosphäre über Fernerkundungsmethoden von Satelliten[133] und vom Boden.[134]
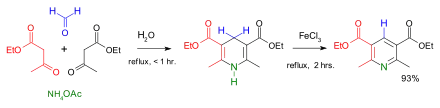
Das Europäische Arzneibuch lässt bei der Grenzprüfung auf Formaldehyd Acetylaceton zugeben. Beim Acetylaceton-Verfahren reagiert der Formaldehyd mit Acetylaceton in Gegenwart von Ammoniumacetat in einer Hantzschschen Dihydropyridinsynthese unter Bildung eines 3,5-Diacetyl-1,4-dihydropyridin-Derivats, dessen Konzentration photometrisch bestimmt werden kann.[135]
Für Holzwerkstoffe existieren unterschiedliche Methoden und Normen zur quantitativen Bestimmung von Kenngrößen, die letztlich auf das Emissionspotenzial oder das „reale“ Emissionsverhalten rückschließen lassen:
- „Perforator-Methode“: Angabe in mg Formaldehyd pro 100 g Probe, siehe Perforator (Chemie)
- Desiccator-Methode: „Kleine“ Probenstücke geben Formaldehyd an Wasser ab, Angabe in mg/l
- „Kammer-Methoden“: Große Plattenproben werden über einen längeren Zeitraum auf ihre Formaldehyd-Emission in einer Prüfkammer untersucht, Angabe beim Pararosanilinverfahren: ppm mit 0,01 ppm = 0,0124 mg Formaldehyd pro m³ Raumluft = 12,4 µg Formaldehyd pro m³ Raumluft, Bestimmungsgrenze 0,01 ppm
Die Bestimmung erfolgt nach DIN EN ISO 14184-1:2011-12 (Ersatz für DIN 54260:1988-029), § 64 LFGB (ehem. § 35 LMBG) B 82.02-1 (freies und freisetzbares Formaldehyd) und DIN EN 717-1 (Holzwerkstoffe, Formaldehydabgabe nach der Prüfkammer-Methode) oder nach DIN EN 120 (Holzwerkstoffe – Bestimmung des Formaldehydgehaltes nach der Perforatormethode).
Literatur
- Luoping Zhang: Formaldehyde. Exposure, Toxicity and Health Effects. Royal Society of Chemistry, London 2018, ISBN 978-1-78262-973-3.
- Wilhelm Keim: Kunststoffe. Synthese, Herstellungsverfahren, Apparaturen. Wiley-VCH, Weinheim 2006, ISBN 3-527-31582-9.
Weblinks
![]() Wikisource: Formalin – Wikisource enthält den Text des Artikels Formalin der Encyclopædia Britannica aus dem Jahr 1911.
Wikisource: Formalin – Wikisource enthält den Text des Artikels Formalin der Encyclopædia Britannica aus dem Jahr 1911.
Einzelnachweise
- Roche Lexikon Medizin. 4. Auflage, Urban & Schwarzenberg 1998, ISBN 3-541-17114-6.
- Eintrag zu Formaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- CRC Handbook of Chemistry and Physics. 85th Edition, CRC Press, Boca Raton 2004.
- Eintrag zu Formaldehyde im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 50-00-0 bzw. Formaldehyd), abgerufen am 13. September 2019.
- Eintrag zu Formaldehyde in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. Oktober 2016.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- Lars Axelsen: Outlook for Formaldehyde and Impact on Methanol Demand. Präsentation auf dem 33. Annual IHS Chemical World Methanol Conference; 11–12. November 2015, München.
- C. H. Fox, F. B. Johnson, J. Whiting und P. P. Roller: Formaldehyde Fixation. In: Journal of Histochemistry and Cytochemistry. 1985, Band 33, Nr. 8, S. 845–853.
- Reinhard Hildebrand: Formalin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. de Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 410.
- Patent US3816539A: Method for making a stabilized solution of concentrated aqueous formaldehyde. Veröffentlicht am 18. Dezember 1968, Erfinder: J. Sanborn, W. Lemmons, J. Ramey.
- Patent US656061A: Process of producing formaldehyde vapors. Veröffentlicht am 24. November 1896, Erfinder: Jean Joseph Auguste Trillat.
- Günther Brugge: Aus der frühen Geschichte der Formaldehyd-Herstellung. In: Chemische Apparatur. 1931, S. 157–160.
- Adolf Baeyer: Ueber die Verbindungen der Aldehyde mit den Phenolen und aromatischen Kohlenwasserstoffen. In: Berichte der deutschen chemischen Gesellschaft. 1872, Band 5, Nr. 2, S. 1094–1100.
- Günther Reuss, Walter Disteldorf, Armin Otto Gamer, Albrecht Hilt: Formaldehyde. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012, ISBN 978-3-527-32943-4. S. 735–768.
- Günther Brugge: Aus der frühen Geschichte des Formaldehyds und seiner Anwendungen. In: Chemische Technik. 1943, Band 16, S. 228–230.
- G. Greco, U. Soldano: Neue Anlagen zur Erzeugung von Formaldehyd aus Methanol. In: Chemie Ingenieur Technik. 1959, Band 31.12, S. 761–765.
- Oliver Türk: Stoffliche Nutzung nachwachsender Rohstoffe. Springer-Verlag/ Vieweg, Wiesbaden 2014, ISBN 978-3-8348-1763-1, S. 130–133.
- Fred Aftalion: A History of the International Chemical Industry. Chemical Heritage Foundation, Philadelphia, ISBN 0-941901-29-7, S. 118.
- Fred Aftalion: A History of the International Chemical Industry. Chemical Heritage Foundation, Philadelphia, ISBN 0-941901-29-7, S. 149.
- Friedrich Asinger: Methanol, Chemie- und Energierohstoff. Akademie-Verlag, Berlin 1987, ISBN 3-05-500341-1, S. 5.
- M. Klar: Chemische Erzeugnisse aus Holz durch trockene Destillation. In: Umschau in Wissenschaft und Technik. 1938, S. 741–742.
- Boy Cornils, Wolfgang A. Herrmann, M. Muhler, C. Wong: Catalysis from A to Z: A Concise Encyclopedia. Wiley-VCH, 2007, ISBN 978-3-527-31438-6, S. 27.
- Homer Adkins, Wesley R. Peterson: The Oxidation of Methanol with Air over Iron, Molybdenum, and Iron-Molybdenum Oxides. In: Journal of the American Chemical Society. Band 53, 1931, S. 1512–1520, doi:10.1021/ja01355a050.
- Jorge Prieto, Jürgen Keine: Holzbeschichtung. Vincentz Network, 2019, ISBN 978-3-748-60171-5, S. 41.
- European Food Safety Authority: Endogenous formaldehyde turnover in humans compared with exogenous contribution from food sources. In: EFSA Journal. Band 12, 2014, S. 3550–3561, doi:10.2903/j.efsa.2014.3550.
- Toxic Exposures. Second edition. Lippincott Williams and Wilkins, Philadelphia, Pennsylvania 1999, S. 1008.
- Ursula Wiedermann-Schmidt und Wolfgang Maurer: Hilfs- und Zusatzstoffe von Impfstoffen – Medizinische Relevanz. In: Wiener klinische Wochenschrift. Band 117, Nr. 15, 1. August 2005, ISSN 1613-7671, S. 510–519, doi:10.1007/s00508-005-0405-0.
- Peder Wolkoff, Gunnar D. Nielsen: Non-cancer effects of formaldehyde and relevance for setting an indoor air guideline. In: Environment International. Band 36, 2010, S. 788–799.
- I. Kushch u. a.: Compounds enhanced in a mass spectrometric profile of smokers’ exhaled breath versus non-smokers as determined in a pilot study using PTR-MS. In: Journal of breath research. 2008, PMID 21383443.
- T. Szarvas u. a.: Determination of endogenous formaldehyde level in human blood and urine by dimedone-14C radiometric method. In: Journal of Radioanalytical and Nuclear Chemistry. Band 106, Nr. 6, 1986, S. 357–367.
- Richard S. Hanson, Thomas E. Hanson: Methanotrophic Bacteria. In: Microbiological Reviews. 1996, Band 60, Nr. 2, S. 439–471.
- R. Paul Jensen, Wentai Luo, James F. Pankow, Robert M. Strongin, David H. Peyton: Hidden Formaldehyde in E-Cigarette Aerosols. In: New England Journal of Medicine. Band 372, 2015, S. 392–394, doi:10.1056/NEJMc1413069.
- B. J. Vorath, D. Steffens: Sicherheit und Gesundheitsschutz beim Räuchern. Arbeitswissenschaftliche Erkenntnisse Nr. 113. Bundesanstalt für Arbeitsschutz und Arbeitsmedizin, Dortmund, 1999, ISSN 0720-1699.
- Chuan Wang, Xiao-Feng Huang, Y. u. Han, B. o. Zhu, Ling-Yan He: Sources and Potential Photochemical Roles of Formaldehyde in an Urban Atmosphere in South China. In: Journal of Geophysical Research. Atmospheres. Band 122, 2017, S. 11934–11947, doi:10.1002/2017JD027266.
- D. J. Luecken, S. L. Napelenok, M. Strum, R. Scheffe, S. Phillips: Sensitivity of Ambient Atmospheric Formaldehyde and Ozone to Precursor Species and Source Types Across the United States. In: Environmental Science & Technology. Band 52, 2018, S. 4668–4675, doi:10.1021/acs.est.7b05509.
- Samuel G. Thomas, William A. Guillory: Condensed-phase photochemistry of formaldehyde. In: Journal of Physical Chemistry. Band 77, 1973, S. 2469–2472, doi:10.1021/j100639a021.
- Donald J. Wuebbles, Katharine Hayhoe: Atmospheric methane and global change. In: Earth-Science Reviews. Band 57, Nr. 3, 2002, S. 177–210.
- E. Peters, F. Wittrock, K. Großmann, U. Frieß, A. Richter, J. P. Burrows: Formaldehyde and nitrogen dioxide over the remote Western Pacific Ocean: SCIAMACHY and GOME-2 validation. In: Atmospheric Chemistry and Physics Discussions. Band 12, 2012, S. 15977, doi:10.5194/acpd-12-15977-2012.
- Joseph P. Pinto, G. Randall Gladstone, Yuk Ling Yung: Photochemical Production of Formaldehyde in Earth’s Primitive Atmosphere. In: Science. 1980, S. 183–185, doi:10.1126/science.210.4466.183.
- Benjamin Zuckerman, D. Buhl, P. Palmer, L. E. Snyder: Observations of Interstellar Formaldehyde. In: Astrophysical Journal. 1970, Band 160, S. 485–506.
- J. G. Mangum, J. Darling, K. M. Menten, C. Henkel: Formaldehyde densitometry of starburst galaxies. In: Astrophysical Journal. 2008, Band 673, S. 832–846.
- C. Henkel, R. Guensten, F. F. Gardner: [12C]/[13C] ratios from formaldehyde in the inner galactic disc. In: Astronomy and Astrophysics. 1985, Band 143, S. 148–152.
- Markus Schuhmann u. a.: CHO-Bearing Molecules in Comet 67P/Churyumov-Gerasimenko. In: ACS Earth and Space Chemistry. Band 3, 2019, S. 1854–1861, doi:10.1021/acsearthspacechem.9b00094.
- E. Zubritsky, N. Neal-Jones: RELEASE 14-038 – NASA’s 3-D Study of Comets Reveals Chemical Factory at Work.
- M. A. Cordiner u. a.: Mapping the release of volatiles in the inner coma of comets C/2012 F6 (Lemmon) AND C/2012 S1 (Ison) using the Atacama large Millimeter/Submillimeter Array. In: The Astrophysical Journal. Band 792, 2014, S. L2, doi:10.1088/2041-8205/792/1/L2.
- G. D. Cody, E. Heying, C. M. Alexander, L. R. Nittler, A. L. Kilcoyne, S. A. Sandford, R. M. Stroud: Establishing a molecular relationship between chondritic and cometary organic solids. In: Proceedings of the National Academy of Sciences. Band 108, Nummer 48, November 2011, S. 19171–19176, doi:10.1073/pnas.1015913108, PMID 21464292, PMC 3228457 (freier Volltext).
- Luoping Zhang: Introduction to Formaldehyde. In: Formaldehyde: Exposure, Toxicity and Health Effects. Royal Society of Chemistry, 2018, ISBN 978-1-78262-973-3, S. 1–19.
- Hans-Jürgen Arpe: Industrielle Organische Chemie. Bedeutende Vor- und Zwischenprodukte. 6. Auflage. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31540-6, S. 41–43.
- Formaldehyde exceed 52 Million Tonnes.
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VC, Weinheim 2013, ISBN 978-3-527-33072-0, S. 594.
- Graeme J. Millar, Mary Collins: Industrial Production of Formaldehyde Using Polycrystalline Silver Catalyst. In: Industrial & Engineering Chemistry Research. Band 56, 2017, S. 9247–9265, doi:10.1021/acs.iecr.7b02388.
- Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Alfred Oberholz (Hrsg.): Winnacker • Küchler: Chemische Technik – Prozesse und Produkte – Organische Zwischenverbindungen, Polymere. 5. Auflage. Band 5. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-30770-8.
- Adam W. Franz, Helmut Kronemayer, Daniel Pfeiffer, Roman D. Pilz, Gänther Reuss, Walter Disteldorf, Armin Otto Gamer, Albrecht Hilt: Formaldehyde. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH, 22. November 2016, doi:10.1002/14356007.a11_619.pub2.
- Friedrich Asinger: Chemie und Technologie der Paraffinkohlenwasserstoffe. Akademie-Verlag, Berlin 1956, S. 477–484.
- Patent US2977386: Absorption of formaldehyde in alkaline urea solution.. Veröffentlicht am 28. März 1961, Erfinder: Mearl A. Kise.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- VDI-Wärmeatlas. 9. Auflage, Springer-Verlag, Berlin 2002, ISBN 978-3-662-10744-7, DA 7.
- S.-X. Weng, B.H. Torrie, B.M. Powell: The crystal structure of formaldehyde. In: Molecular Physics. Band 68, 1989, S. 25–31, doi:10.1080/00268978900101941.
- D. J. Clouthier, D. A. Ramsay: The Spectroscopy of Formaldehyde and Thioformaldehyde. In: Ann. Rev. Phys. Chem. 1983, Band 34, S. 31–58.
- K. S. Tewari,N. K. Vishnoi: A Textbook of Organic Chemistry. Vikas, 2017, ISBN 978-81259-1605-5, S. 165.
- B. Tollens: Ueber ammon‐alkalische Silberlösung als Reagens auf Aldehyd. In: Berichte der deutschen chemischen Gesellschaft. 1882, Band 15, Nr. 2, S. 1635–1639.
- L. Henry: Sur le nitrile glycolique et la synthèse directe de l’acide glycolique. In: Comp. Rend. 1890, Band 110, S. 759–760.
- Alexander Butlerow: Ueber einige Derivate des Jodmethylens. In: Annalen der Chemie und Pharmacie. Band 111, 1859, S. 242–252, doi:10.1002/jlac.18591110219.
- C. Mannich, W. Krösche: Ueber ein Kondensationsprodukt aus Formaldehyd, Ammoniak und Antipyrin. In: Archiv der Pharmazie. 1912, Band 250, S. 647–667, doi:10.1002/ardp.19122500151.
- E. Müller. O. Bayer. H. Meerwein, K. Ziegler: Houben-Weyl Methods of Organic Chemistry Vo. X/1, 4th Edition. Nitro, Nitroso and Hydroxylamine Compounds. Thieme, Stuttgart, 1971, ISBN 978-3-13-209104-7, S. 254.
- F. C. Whitmore u. a.: Production of Benzyl Chloride by Chloromethylation of Benzene. Laboratory and Pilot Plant Studies. In: Industrial & Engineering Chemistry. Band 38, 1946, S. 478–485, doi:10.1021/ie50437a013.
- Friedrich Asinger: Methanol, Chemie- und Energierohstoff. Akademie-Verlag, Berlin 1987, ISBN 3-05-500341-1, S. 437–438.
- Friedrich Asinger: Methanol, Chemie- und Energierohstoff. Akademie-Verlag, Berlin 1987, ISBN 3-05-500341-1, S. 348.
- Ronald Breslow: On the mechanism of the formose reaction. In: Tetrahedron Letters. Band 1, 1959, S. 22–26, doi:10.1016/S0040-4039(01)99487-0.
- Eintrag zu Formaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Februar 2014.
- Manfred Dunky, Peter Niemz: Holzwerkstoffe und Leime: Technologie und Einflussfaktoren. Springer-Verlag, Berlin/Heidelberg/ New York 2002, ISBN 3-540-42980-8, S. 249–302.
- Nicole Westenfelder, Evelyne Schlauri: Ökologisches Einweggeschirr – Wie ungesund sind Bambusteller und Kartonröhrli? In: srf.ch. 16. Mai 2021, abgerufen am 16. Mai 2021.
- Manfred Dunky, Peter Niemz: Holzwerkstoffe und Leime: Technologie und Einflussfaktoren. Springer-Verlag, Berlin/Heidelberg/ New York 2002, ISBN 3-540-42980-8, S. 303–320.
- Hermann Rath: Lehrbuch der Textilchemie, einschl. der textil-chemischen Technologie. Springer-Verlag, Berlin/Heidelberg 1963, ISBN 978-3-662-00065-6, S. 112–121.
- Hans-Jürgen Bargel, Hermann Hilbrans, Günter Schulze, Karl-Heinz Hübner, Oswald Krüger: Werkstoffkunde. Springer-Verlag, Berlin/Heidelberg 2005, ISBN 978-3-540-26107-0, S. 386.
- W. C. Bauman, J. Eichhorn: Fundamental Properties of a Synthetic Cation Exchange Resin. In: Journal of the American Chemical Society. Band 69, 1947, S. 2830–2836, doi:10.1021/ja01203a065.
- Wilhelm Keim: Kunststoffe. Synthese, Herstellungsverfahren, Apparaturen. Kapitel 4, Wiley-VCH, Weinheim 2006, ISBN 3-527-31582-9.
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. Wiley-VCH, Weinheim 2013, ISBN 978-3-527-33072-0, S. 590.
- Isocyanates production: Global and Russian Isocyanate Market Overview.
- Verordnung (EU) 2019/831.
- Verordnung (EG) Nr. 1223/2009.
- Paul Löffler: Review: Vaccine Myth-Buster - Cleaning Up With Prejudices and Dangerous Misinformation. In: Frontiers in Immunology. Band 12, 2021, S. 663280, doi:10.3389/fimmu.2021.663280, PMID 34177902, PMC 8222972 (freier Volltext).
- Frank Destefano, Paul A. Offit, and Allison Fisher: Vaccine Safety. In: Stanley A. Plotkin et al. (Hrsg.): Plotkin’s Vaccines. 7. Auflage. Elsevier, Philadelphia 2017, ISBN 978-0-323-35761-6, S. 1594, doi:10.1016/B978-0-323-35761-6.00082-1.
- Vaccines for human use. In: European Pharmacopeia. Band 8.0, S. 767.
- Vaccines for veterinary use. In: European Pharmacopeia. Band 8.0, S. 770.
- K. Weißer, I. Barth, B. Keller-Stanislawski: Sicherheit von Impfstoffen. In: Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz. Band 52, Nr. 11, 1. November 2009, ISSN 1437-1588, S. 1053–1064, doi:10.1007/s00103-009-0961-y.
- Wolfgang Maurer: Impfskeptiker – Impfgegner. Von einer anderen Realität im Internet. In: Pharmazie in unserer Zeit. Band 37, Nr. 1, 2008, S. 64–70, doi:10.1002/pauz.200700252.
- Heinz Fraenkel-Conrat, B. A. Brandon, H. S. Olcott: The reaction of formaldehyde with proteins; participation of indole groups; gramicidin. In: Journal of biological chemistry. Band 168, Nummer 1, April 1947, S. 99–118, PMID 20291066.
- Heinz Fraenkel-Conrat, H. S. Olcott: The reaction of formaldehyde with proteins. Cross-linking between amino and primary amide or guanidyl groups. In: Journal of the American Chemical Society. Band 70, Nummer 8, August 1948, S. 2673–2684, PMID 18876976.
- Heinz Fraenkel-Conrat, H. S. Olcott: Reaction of formaldehyde with proteins. Cross-linking of amino groups with phenol, imidazole, or indole groups. In: Journal of biological chemistry. Band 174, Nummer 3, Juli 1948, S. 827–843, PMID 18871242.
- Rose-Maria Gropp: Unfrischer Fisch. In: FAZ.net. 29. Juni 2006.
- Landesinstitut für Arbeitsgestaltung des Landes Nordrhein-Westfalen. Abgerufen am 19. Mai 2018.
- Medizinproduktehersteller MEDIS. Abgerufen am 19. Mai 2018.
- R. Coleman, I. Kogan: An improved low-formaldehyde embalming fluid to preserve cadavers for anatomy teaching. In: J. Anat. 192, 1998, S. 443–446.
- J. Weigner: Nitritpökelsalz-Ethanol-Polyethylenglycol-400-Lösung zur Fixierung und Konservierung von Organen und Tierkörpern für Lehre und Forschung. In: Der Präparator. Jg. 57, 2011, S. 34–53, ISSN 0032-6542.
- W. Thiel: Die Konservierung ganzer Leichen in natürlichen Farben. In: Ann. Anat. 174, 1992, S. 185–195.
- Rüdiger Kramme: Medizintechnik: Verfahren – Systeme – Informationsverarbeitung. Springer Medizin Verlag, Heidelberg 2007, ISBN 978-3-540-34102-4, S. 27–28.
- Michael Berger, Lutz Nitschke: Messung von Formaldehyd bei Hühnerstallbegasungen. In: Gefahrstoffe – Reinhalt. Luft. Band 75, Nr. 4, 2015, S. 127–132.
- Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA): Formaldehyd. Abgerufen am 12. Januar 2022.
- M. Z. M. Salem, M. Böhm: Understanding of formaldehyde emissions from solid wood: An overview. In: BioRes. 2013, S. 4775–4790.
- Formaldehydproblematik bei Gasmotoren. SGS-RUK GmbH, abgerufen am 5. Februar 2014.
- BGBl. I S. 804, 828
- Bundesministerium für Umwelt, Naturschutz und nukleare Sicherheit: Heizen mit Holz. Der passende Brennstoff.
- VDI 3862 Blatt 1:1990-12 Messen gasförmiger Emissionen; Messen aliphatischer Aldehyde (C1 bis C3) nach dem MBTH-Verfahren (Gaseous emission measurement; measurement of aliphatic aldehydes (C1 to C3) MBTH method). Beuth Verlag, Berlin, S. 2–3.
- VDI 3862 Blatt 2:2000-12 Messen gasförmiger Emissionen; Messen aliphatischer und aromatischer Aldehyde und Ketone nach dem DNPH-Verfahren; Gaswaschflaschen-Methode (Gaseous emission measurement; Measurement of aliphatic and aromatic aldeydes and ketones by DNPH method; Impinger method). Beuth Verlag, Berlin, S. 4–5.
- VDI 3862 Blatt 3:2000-12 Messen gasförmiger Emissionen; Messen aliphatischer und aromatischer Aldehyde und Ketone nach dem DNPH-Verfahren; Kartuschen-Methode (Gaseous emission measurement; Measurement of aliphatic and aromatic aldeydes and ketones by DNPH method; Cartridges method). Beuth Verlag, Berlin, S. 5.
- Franz Joseph Dreyhaupt (Hrsg.): VDI-Lexikon Umwelttechnik. VDI-Verlag Düsseldorf 1994, ISBN 3-18-400891-6, S. 515.
- Hans-Günter Haub, Sigrid Mühlhauser, Franz-Josef Müller, Arno Gardziella: Messung von Emissionen bei der Aushärtung von Phenolharzen. In: Staub – Reinhalt. Luft. Band 48, Nr. 4, 1988, S. 145–149.
- VDI 3862 Blatt 4:2001-05 Messen gasförmiger Emissionen; Messen Messen von Formaldehyd nach dem AHMT-Verfahren (Gaseous emission measurement; Mesurement of formaldehyde by the AHMT method). Beuth Verlag, Berlin, S. 5.
- VDI 3862 Blatt 5:2008-06 Messen gasförmiger Emissionen; Messen niederer Aldehyde insbesondere Acrolein nach dem 2-HMP-Verfahren - GC-Methode (Gaseous emission measurement; Measurement of lower aldehydes especially acrolein with the 2-HMP-method - GC-method). Beuth Verlag, Berlin, S. 4.
- VDI 3862 Blatt 6:2004-02 Messen gasförmiger Emissionen; Messen von Formaldehyd nach dem Acetylaceton-Verfahren (Gaseous emission measurement; Measurement of formaldehyde by the acetylacetone method). Beuth Verlag, Berlin, S. 5.
- VDI 3862 Blatt 8:2015-06 Messen gasförmiger Emissionen; Messen von Formaldehyd im Abgas von Verbrennungsmotoren; FTIR-Verfahren (Measurement of gaseous emissions; Measurement of formaldehyde in the exhaust gas of combustion engines; FTIR method). Beuth Verlag, Berlin, S. 3–4.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Formaldehyde, abgerufen am 1. Mai 2020.
- Infoseite Formaldehyd des Instituts für Angewandte Umweltforschung e.V.
- Lutz Edler, DKFZ – Deutsches Krebsforschungszentrum, Heidelberg: Formaldehyd – Die Geschichte einer Chemikalie in Tierexperimenten, Studien beim Menschen und Risikobewertungen. (PDF; 353 kB) bfr.bund.de, abgerufen am 6. Juni 2009.
- Made aus China. In: Der Spiegel. Nr. 42, 2012 (online).
- Weltgesundheitsorganisation WHO: IARC classifies formaldehyde as carcinogenic to humans. (Memento vom 10. September 2018 im Internet Archive). Presseerklärung 153 (englisch), 15. Juni 2004.
- BfR: Formaldehyd – Gefährlicher als bisher angenommen? (PDF; 59 kB), Stellungnahme vom 29. November 2004.
- BfR: Toxikologische Bewertung von Formaldehyd. (PDF; 111 kB), Stellungnahme 023/2006, 30. März 2006.
- BfR: Krebserregende Wirkung von eingeatmetem Formaldehyd hinreichend belegt. Presseinformation 14/2006, 29. Mai 2006.
- National Institute of Environmental Health Sciences. 13th Report on Carcinogens (RoC): Formaldehyde. Abgerufen am 18. November 2014.
- Kathryn A. Zug u. a.: Patch-Test Results of the North American Contact Dermatitis Group 2005-2006. In: Dermatitis. Band 20, 2009, S. 149–160, doi:10.2310/6620.2009.08097.
- Bedarfsgegenständeverordnung.
- ChemVerbotsV, Anlage 1 Inverkehrbringensverbote.
- Verordnung (EU) 2018/1513 der Kommission vom 10. Oktober 2018 zur Änderung des Anhangs XVII der Verordnung (EG) Nr. 1907/2006 des Europäischen Parlaments und des Rates zur Registrierung, Bewertung, Zulassung und Beschränkung chemischer Stoffe (REACH) hinsichtlich bestimmter als karzinogen, keimzellmutagen oder reproduktionstoxisch (CMR) eingestufter Stoffe der Kategorie 1A oder 1B.
- Bekanntmachung des Umweltbundesamtes. Richtwert für Formaldehyd in der Innenraumluft. August 2016 (PDF; 127 kB).
- Formaldehyd in der Raumluft. Hintergrundinformationen. In: ee-concept.de. Abgerufen am 11. April 2014
- AGÖF-Orientierungswerte für flüchtige organische Verbindungen in der Raumluft 2013. Arbeitsgemeinschaft ökologischer Forschungsinstitute e. V. (AGÖF), abgerufen am 11. April 2014.
- Änderungen und Neuaufnahmen als Ergänzung der TRGS 900 „Arbeitsplatzgrenzwerte“.
- Johannes Orphal, Kelly Chance: Ultraviolet and visible absorption cross-sections for HITRAN. In: Journal of Quantitative Spectroscopy and Radiative Transfer. Band 82, Nr. 1, 2003, S. 491–504.
- I. De Smedt, u. a.: Twelve years of global observations of formaldehyde in the troposphere using GOME and SCIAMACHY sensors. In: Atmospheric Chemistry and Physics. Band 8, 2008, S. 4947–4963.
- E. Peters u. a.: Formaldehyde and nitrogen dioxide over the remote western Pacific Ocean: SCIAMACHY and GOME-2 validation using ship-based MAX-DOAS observations. In: Atmospheric Chemistry and Physics. Band 12, Nr. 22, 2012, S. 11179–11197.
- VDI 3484 Blatt 2:2001-11: Messen von gasförmigen Immissionen; Messen von Innenraumluftverunreinigungen; Bestimmung der Formaldehydkonzentration nach der Acetylaceton-Methode (Gaseous ambient air measurements; Indoor-air pollution measurements; Measurement of the formaldehyde concentration with the acatylacetone method). Beuth Verlag, Berlin, S. 4.


