Phenylalanin
Phenylalanin, abgekürzt Phe oder F, ist eine aromatische α-Aminosäure mit hydrophober Seitenkette, die für den Menschen eine essentielle proteinogene (am Eiweißaufbau beteiligte) Aminosäure ist. Phenylalanin leitet sich strukturell vom Alanin ab und ist amphiphil.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
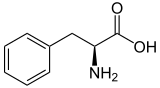 | ||||||||||||||||||||||
| Struktur von L-Phenylalanin, dem natürlich vorkommenden Enantiomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Phenylalanin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C9H11NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose Blättchen oder Nadeln[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 165,19 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,34 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (27 g·l−1 bei 20 °C),[3] Methanol und Ethanol[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Isomere
Phenylalanin besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere. Die L-Form [Synonym: (S)-Phenylalanin] kommt in der Natur als Proteinbestandteil vor. Die D-Form [Synonym: (R)-Phenylalanin] ist für den Stoffwechsel nicht verwertbar und auch nur synthetisch herstellbar.
Wenn im folgenden Text und in der wissenschaftlichen Literatur „Phenylalanin“ ohne weiteren Namenszusatz (Präfix) aufgeführt wird, ist stets L-Phenylalanin gemeint.
| Enantiomere von Phenylalanin | ||
| Name | L-(−)-Phenylalanin | D-(+)-Phenylalanin |
| Andere Namen | (S)-Phenylalanin | (R)-Phenylalanin |
| Strukturformel |  | 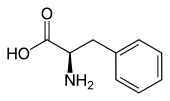 |
| CAS-Nummer | 63-91-2 | 673-06-3 |
| 150-30-1 (Racemat) | ||
| EG-Nummer | 200-568-1 | 211-603-5 |
| 205-756-7 (Racemat) | ||
| ECHA-Infocard | 100.000.517 | 100.010.549 |
| 100.005.234 (Racemat) | ||
| PubChem | 6140 | 71567 |
| 994 (Racemat) | ||
| DrugBank | DB00120 | DB02556 |
| − (Racemat) | ||
| FL-Nummer | 17.018 | - |
| 17.017 (Racemat) | ||
| Wikidata | Q170545 | Q26841253 |
| Q27103475 (Racemat) | ||
Historische Informationen
L-(−)-Phenylalanin konnte zuerst im Jahr 1879 aus Leguminosen isoliert werden und wurde 1882 erstmals synthetisch dargestellt. Im Jahr 1961 konnten Heinrich Matthaei und Marshall Warren Nirenberg mithilfe des Poly-U-Experiments als erste genetische Codierungseinheit diejenige der Aminosäure Phenylalanin identifizieren; das zugeordnete Basentriplett ist UUU.[4]
Biosynthese
L-(−)-Phenylalanin wird in Pflanzen über den Shikimisäureweg synthetisiert. Über den Zimtsäureweg lassen sich die Flavonoide aus L-(−)-Phenylalanin biosynthetisieren.
Durch 4-Hydroxylierung entsteht im menschlichen Körper aus L-(−)-Phenylalanin die proteinogene Aminosäure L-Tyrosin [Synonym: (S)-Tyrosin].
Vorkommen
Phenylalanin ist Bestandteil von Proteinen und Peptiden. Da es sich um eine für den menschlichen Organismus essentielle Aminosäure handelt, muss sie in ausreichender Menge mit der Nahrung aufgenommen werden. Die folgenden Beispiele für den Gehalt an proteinogen gebundenem Phenylalanin beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil am Gesamtprotein angegeben:[5]
| Lebensmittel | Gesamtprotein | Phenylalanin | Anteil |
|---|---|---|---|
| Erbsen, getrocknet | 24,55 g | 1132 mg | 4,6 % |
| Hähnchenbrustfilet, roh | 21,23 g | 857 mg | 4,0 % |
| Hühnerei | 12,57 g | 680 mg | 5,4 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 158 mg | 4,8 % |
| Kürbiskerne | 30,23 g | 1733 mg | 5,7 % |
| Lachs, roh | 20,42 g | 845 mg | 4,1 % |
| Mais-Vollkornmehl | 6,93 g | 340 mg | 4,9 % |
| Reis, ungeschält | 7,94 g | 410 mg | 5,2 % |
| Schweinefleisch, roh | 20,95 g | 881 mg | 4,2 % |
| Sojabohnen, getrocknet | 36,49 g | 2122 mg | 5,8 % |
| Walnüsse | 15,23 g | 711 mg | 4,7 % |
| Weizen-Vollkornmehl | 13,70 g | 646 mg | 4,7 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Phenylalanin als Proteinbestandteil, jedoch kein freies L-Phenylalanin.
Der auf manchen Lebensmittelverpackungen aufgedruckte Hinweis „enthält eine Phenylalaninquelle“ bezieht sich auf das Vorhandensein des Süßstoffes Aspartam, aus dem während des Verdauungsvorganges Phenylalanin freigesetzt wird.[6] Bedeutsam ist das für Menschen, die aufgrund der Stoffwechselstörung Phenylketonurie (PKU) eine phenylalaninarme Diät einhalten müssen.
Bedarf
Phenylalanin ist für den Menschen eine essentielle Aminosäure, wird also nicht vom Körper synthetisiert, sondern muss mit der Nahrung in ausreichender Menge aufgenommen werden. Da Phenylalanin dem Organismus zur Produktion der ebenfalls proteinogenen Aminosäure Tyrosin dient, ist der Bedarf an Phenylalanin vom Tyrosingehalt der Nahrung abhängig. In normaler proteinhaltiger Nahrung sind beide Aminosäuren in gewissen Anteilen enthalten. Zumindest für gesunde Erwachsene ist es aber möglich, den gesamten Tyrosinbedarf auch über die Synthese aus Phenylalanin zu decken. Je nach Messmethode schwanken die in der Literatur angegebenen Werte für den durchschnittlichen Phenylalaninbedarf von gesunden Erwachsenen bei völliger Abwesenheit von Tyrosin in der Nahrung zwischen 38 und 52 mg pro Kilogramm Körpergewicht und Tag. Ist dagegen Tyrosin im Überschuss vorhanden, werden im Durchschnitt nur rund 9 mg Phenylalanin pro Kilogramm Körpergewicht und Tag benötigt. Bei einem Verhältnis von Phenylalanin zu Tyrosin von 60:40 erfolgt die Verwertung der beiden Aminosäuren optimal. Mitunter wird darauf basierend ein zusammengefasster Bedarf angegeben. In dieser Weise ist auch die 1985 von der FAO/WHO/UNU herausgegebene Empfehlung von 14 mg pro Kilogramm Körpergewicht und Tag zu verstehen.[7]
Eigenschaften
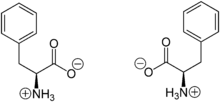
Phenylalanin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe zum einsamen Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Phenylalanin auch seine geringste Löslichkeit in Wasser besitzt. Der isoelektrische Punkt von Phenylalanin liegt bei 5,48.[8]
Freies L-Phenylalanin hat einen bitteren Geschmack, wobei der Erkennungsschwellenwert bei 5 bis 7 mmol/L liegt. Dagegen schmeckt freies D-Phenylalanin süß, der Erkennungsschwellenwert liegt bei 1 bis 3 mmol/L.[9]
Synthese
L-(−)-Phenylalanin wird, wie andere Aminosäuren auch, im industriellen Maßstab und in beträchtlichen Mengen hergestellt. Dies geschieht meist über Totalsynthese, das heißt ohne biotechnologische Hilfsmittel.
Auf biologischem Weg wird das L-Phenylalanin in Pflanzen über die Zwischenstufe der Shikimisäure gebildet.
Industrielle Verwendung
Der künstliche Süßstoff Aspartam ist ein L-Aspartyl-L-phenylalanylmethylester, also der Methylester eines Dipeptides aus L-Asparaginsäure und L-Phenylalanin. Der Arzneistoff Nateglinid wird aus D-Phenylalanin hergestellt.[10] Zur Synthese des Arzneistoffes Alacepril wird L-Phenylalanin als Edukt eingesetzt.[11] In der stereoselektiven Synthese sind (S)- oder (R)-Phenylalanin und deren Derivate als Edukte und enantioselektive Katalysatoren von Bedeutung.
Medizin
Für Menschen ist L-Phenylalanin eine essentielle Aminosäure, die im Stickstoffstoffwechsel eine wichtige Rolle spielt. In der Leber kann L-Phenylalanin – wenn ausreichend vorhanden – zu L-Tyrosin umgewandelt werden. Dies wird durch die Phenylalaninhydroxylase, einer Monooxygenase, katalysiert. Das Reduktionsmittel hierbei ist Sapropterin.
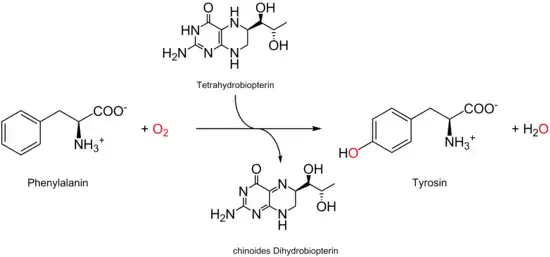
Reicht die Menge L-Phenylalanin jedoch nicht aus, muss Tyrosin auch mit der Nahrung aufgenommen werden. Da bei starkem Stress dieser Mechanismus nicht mehr funktioniert, muss L-Tyrosin in solchen Fällen verstärkt aufgenommen werden. Die normale tägliche Dosis sollte 14 mg/kg Körpergewicht (eines Erwachsenen) betragen. Sie wird grundsätzlich ausreichend durch die Nahrung gedeckt (siehe auch oben). Bei übermäßigem Verzehr kann Phenylalanin abführend wirken.
L-Phenylalanin ist beteiligt an der Synthese von Adrenalin, Noradrenalin, L-Dopa, PEA und Melanin. Die Aminosäure L-Phenylalanin dient als Ausgangsstoff für viele weitere Stoffe, z. B. für den Botenstoff Dopamin.
Racemische Gemische aus D- und L-Phenylalanin (DLPA) werden als Schmerzmittel oder auch bei Depressionen verabreicht. Sie wirken stimmungsaufhellend. Die vermutete schmerzstillende Wirkung von DL-Phenylalanin lässt sich durch die mögliche Blockade des Enkephalin-Abbaus von D-Phenylalanin durch das Enzym Carboxypeptidase A erklären.[12] Damit ist dies eines der seltenen Beispiele für metabolische Wirkungen von D-Enantiomeren. Eine genetisch bedingte Stoffwechselstörung ist Phenylketonurie (PKU), hier wird L-Phenylalanin im Körper nicht vollständig abgebaut. Die Erkrankten vertragen nur einen Bruchteil der üblichen Zufuhr phenylalaninhaltiger Nahrungsmittel. Das betrifft vor allem natürliches Eiweiß, aber auch synthetisch hergestellte Substanzen, wie z. B. den Süßstoff Aspartam. An PKU erkrankten Menschen fehlt das Enzym Phenylalaninhydroxylase. Es wandelt beim gesunden Menschen L-Phenylalanin in L-Tyrosin um. Fehlt das Enzym, steigt die Konzentration an L-Phenylalanin im Blut auf ein zu hohes Niveau an. Dies wirkt sich auf Reifung und Funktion des Gehirns ungünstig aus. Daneben können auch entzündliche Prozesse die Aktivität des Enzyms schwächen und zu moderater Hyperphenylalaninämie führen.[13]
Siehe auch
- Homophenylalanin als Strukturmotiv in Arzneistoffen, vor allem ACE-Inhibitoren der 2. Generation.
Literatur
- K. Drauz, A. Kleemann, J. Martens: Induktion von Asymmetrie durch Aminosäuren. In: Angew. Chem., 94, 1982, S. 590–613.
- J. Martens: Asymmetric Syntheses with Amino Acids, Topics in Current Chemistry. In: Fortschritte der Chemischen Forschung, 125, 1984, S. 165–246.
- A. Kleemann, J. Martens, M. Samson, W. Bergstein: Asymmetric Synthesis of Peptides. In: Synthesis, 1981, S. 740–741.
Weblinks
Einzelnachweise
- Eintrag zu PHENYLALANINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. August 2020.
- Eintrag zu L-Phenylalanin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Mai 2014.
- Datenblatt DL-Phenylalanin (PDF) bei Merck, abgerufen am 21. Dezember 2019.
- Breaking the code. DNA Learning Center des Cold Spring Harbor Laboratory, abgerufen am 25. November 2013.
- Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Ausgabe.
- Verordnung (EG) Nr. 1333/2008 (PDF) des Europäischen Parlaments und des Rates vom 16. Dezember 2008 über Lebensmittelzusatzstoffe, Artikel 23, Absatz 3b.
- P. B. Pencharz, J. W. Hsu, R. O. Ball: Aromatic amino acid requirements in healthy human subjects. In: J. Nutr. 137(6 Suppl 1); June 2007, S. 1576S–1578S, PMID 17513429.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, 1982, ISBN 3-527-25892-2, S. 40.
- H.-D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie. 5. Auflage. Springer-Verlag, Berlin/ Heidelberg/ New York 2001, ISBN 3-540-41096-1, S. 33.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dieter Reichert: Pharmaceutical Substances. 4. Auflage. 2 Bände erschienen im Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2, S. 1406–1407; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- Axel Kleemann, Jürgen Engel, Bernd Kutscher, Dieter Reichert: Pharmaceutical Substances. 4. Auflage. 2 Bände erschienen im Thieme-Verlag, Stuttgart 2000, ISBN 1-58890-031-2, S. 46; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- D. W. Christianson, S. Mangani, G. Shoham, W. N. Lipscomb: Binding of D-phenylalanine and D-tyrosine to carboxypeptidase A. In: Journal of Biological Chemistry. 264 (22), 1989, S. 12849–12853. PMID 2568989.
- G. Neurauter, K. Schröcksnadel, S. Scholl-Bürgi, B. Sperner-Unterweger, C. Schubert, M. Ledochowski, D. Fuchs: Chronic immune stimulation correlates with reduced phenylalanine turnover. In: Current Drug Metabolism, 9 (7), September 2008, S. 622–627.