Ozon
Ozon (von altgriechisch ὄζειν ozein „riechen“, ὄζον ozon: wörtlich „das Riechende“) ist ein aus drei Sauerstoffatomen (O) aufgebautes Molekül (O3) und das daraus bestehende farblose bis bläuliche, in hoher Konzentration tiefblaue[8] Gas von charakteristischem Geruch. Ozonmoleküle in der Luft zerfallen unter Normalbedingungen innerhalb einiger Tage zu biatomarem, das heißt aus zwei Sauerstoffatomen bestehendem, Sauerstoff (O2).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
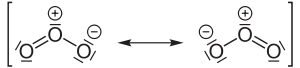 | |||||||||||||||||||
| Mesomere Grenzstrukturen des Ozonmoleküls | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ozon | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | O3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses[3] bis bläuliches[4], in hoher Konzentration tiefblaues Gas mit unangenehm stechendem, chlorähnlichem „Höhensonnengeruch“[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 48,00 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte |
2,154 kg·m−3 (0 °C)[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−111,9 °C[3] | ||||||||||||||||||
| Löslichkeit |
sehr schwer in Wasser (494 ml·l−1 bei 0 °C[5], 570 mg·l−1 bei 20 °C[3]) | ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Ozon ist ein starkes und giftiges Oxidationsmittel, das bei Menschen und Tieren zu Reizungen der Atemwege und der Augen sowie Begünstigung von Atemwegserkrankungen führen kann. In der Troposphäre ist Ozon der drittwirksamste Treiber der globalen Erwärmung (nach Kohlendioxid und Methan).[9]
Die Ozonschicht in der Stratosphäre schützt die Lebewesen auf der Erde vor Schädigungen durch energiereiche mutagene ultraviolette Strahlung der Sonne.
Geschichte
Im Jahre 1839 beschrieb Christian Friedrich Schönbein erstmals die einzigartige Erscheinung, dass ein chemisches Element in Gasform in zwei verschiedenen molekularen Formen nebeneinander beständig ist – Ozon und Disauerstoff. Zunächst erschien diese Tatsache aber zu eigenartig, als dass die einfache Deutung Schönbeins, eine Allotropie im Gaszustand, allgemeine Anerkennung gefunden hätte.[10]
Die Abbaureaktionen von Ozon durch Stickoxide beschrieb 1970 erstmals Paul Josef Crutzen (Nobelpreis für Chemie 1995).
Vorkommen
Die Menge an Ozon in der Atmosphäre wird in Dobson-Einheiten (also pro Erdoberfläche) oder in ppm (also pro Stoffmenge Luft) angegeben. Die höchste Konzentration mit einigen ppm weist Ozon in der Stratosphäre auf. Es entsteht dort im Ozon-Sauerstoff-Zyklus. Ozon ist in der Stratosphäre unschädlich und absorbiert teilweise die Ultraviolettstrahlung der Sonne. In der Atemluft ist es jedoch bereits in weit geringeren Konzentrationen gesundheitsschädlich, insbesondere verursacht die lokal sehr unterschiedliche Ozonbelastung Reizungen der Atemwege.
Diese sehr unterschiedliche Gefahreneinschätzung in den verschiedenen atmosphärischen Schichtungen führt sehr häufig zu Verwechslungen und zur Unterschätzung der Gefahren. Das gesundheitliche Risiko des Ozons in den bodennahen Luftschichten ist durch seine Reaktivität begründet; Ozon ist eines der stärksten Oxidationsmittel.[11]
In Reinluftgebieten ist die Ozon-Konzentration im Sommer oft höher als in Städten. Dies liegt daran, dass Stickoxid (NO) der Ozonbildung entgegenwirkt. In Städten ist die NO-Konzentration durch Emissionen von Fahrzeugen (Land-, Wasser- und Luftfahrzeuge) relativ hoch. Im Einzelnen laufen folgende Reaktionen ab:
Ozon entsteht wie folgt:
Gleichzeitig wird Ozon durch NO wieder abgebaut:
Wären also nicht noch weitere Stoffe, sogenannte flüchtige Kohlenwasserstoffe oder auch CO, in der unteren Luftschicht vorhanden, würde sich kein weiteres Ozon bilden, sondern abhängig von der Sonneneinstrahlung stellt sich dann ein Gleichgewicht zwischen O3, NO und NO2 ein. Je stärker die Sonne scheint, desto mehr Ozon und weniger NO2 ist vorhanden, da letzteres durch die UV-Strahlung gespalten wird (Reaktion 1).
In der (verschmutzten) planetaren Grenzschicht der Atmosphäre finden sich auch Kohlenwasserstoffe, die sowohl vom Menschen (anthropogen) als auch von der Vegetation (biogen) emittiert werden. Sie werden von OH-Radikalen oxidiert, wobei Peroxid-Radikale R-O-O· entstehen. Diese wiederum sorgen dafür, dass NO zu NO2 oxidiert wird, ohne dass dabei ein O3 verbraucht wird, wie in Reaktion 3, also:
Wenn danach wieder Reaktion 1 und 2 stattfinden, wird netto neues Ozon gebildet.
Da NO durch Autos und Industrie ausgestoßen wird, wird Ozon in der Stadt schneller wieder abgebaut (nach Reaktion 3) als in ländlichen Gegenden. Außerdem finden sich in ländlichen Gebieten häufig Kohlenwasserstoffe, die leichter von OH-Radikalen angegriffen werden können, wodurch Reaktion 4 schneller abläuft. Ein bekanntes Beispiel für so einen leicht abbaubaren biogenen Kohlenwasserstoff ist Isopren. Die genaue Reaktionskette ist im Artikel Sommersmog beschrieben.
Die im Zusammenhang mit der Ozonschicht häufig erwähnten FCKW (Fluorchlorkohlenwasserstoffe) werden durch UV-Strahlung gespalten, wodurch freie Chlorradikale entstehen, die wiederum viele Ozon-Moleküle „zerstören“ können.
Bildung
Ozon entsteht aus gewöhnlichem Sauerstoff gemäß der Reaktion[12]
wobei ΔH die molare Reaktionsenthalpie bezeichnet.
Ozon bildet sich in der Atmosphäre vor allem auf drei Arten:
- Energiereiche Sonnenstrahlung spaltet Sauerstoff-Moleküle in der Stratosphäre in zwei einzelne Atome, die sich jeweils mit einem weiteren Sauerstoff-Molekül zu Ozon vereinigen. Dieser Vorgang der Spaltung von Sauerstoff-Molekülen durch energiereiche UV-C-Strahlung mit einer Wellenlänge von < 242 nm wird als Photodissoziation bezeichnet.
- In Erdnähe bildet sich Ozon bei der Reaktion von Stickoxiden (z. B. NO2) mit Sauerstoff O2 unter dem Einfluss von UV-Strahlung. Trotz Einführung des Motoren-Katalysators ist der Straßenverkehr über den Ausstoß von Schadstoffen indirekt für diese Form der Ozonbildung in erdnahen Luftschichten (vornehmlich Städten) mitverantwortlich.[13][14]
- Bei Gewitter: Durch den elektrischen Stromfluss zwischen Wolke und Erdboden entsteht bei der Blitzentladung Ozon (neben Salpetersäure und weiteren Stoffen).
Raumluftreinigungsgeräte

Beim Betrieb von Raumluftreinigungsgeräten kann es gezielt oder ungewollt zur Bildung von Ozon kommen. So bilden einige Ionisatoren Ozon, um geruchlich wahrgenommene Moleküle der Umgebungsluft zu spalten und zu eliminieren. Allerdings bergen die Abbauprodukte von Nikotin und Zigarettenrauch, neben dem Ozon selbst, hohe gesundheitliche Risiken, so dass z. B. die Deutsche Lungenstiftung davor warnt, den schlechten Geruch verrauchter Räume mit Ozon generierenden Luftreinigern zu beseitigen.[15] Die Richtlinie VDI 6022 Blatt 5 „Raumlufttechnik, Raumluftqualität - Vermeidung allergener Belastungen - Anforderung an die Prüfung und Bewertung von technischen Geräten und Komponenten mit Einfluss auf die Atemluft“ empfiehlt daher, beim Einsatz von Ionisatoren gegebenenfalls die Ozon-Emissionsrate zu bestimmen.[16]
Ozon kann auch beim Betrieb von elektrostatischen Abscheidern (Elektrofiltern), die zur Raumluftreinigung eingesetzt werden, entstehen.[17] Dies ist insbesondere dann der Fall, wenn durch die negative Polung der Sprühelektrode eine negative Koronaentladung erzielt wird. Deshalb wird in der Regel bei raumlufttechnischen Anlagen von dieser Konstellation abgesehen.[18]
Ozon kann ebenfalls beim Betrieb von Raumluftreinigungsgeräten entstehen, die gezielt nichtthermisches Plasma erzeugen. Die Menge des erzeugten Ozons hängt dabei von der Bauart und der Leistungsaufnahme des eingesetzten Geräts ab.[19]
Fotokopierer
Bei älteren Fotokopierern sowie Laserdruckern kann man einen typischen „Ozongeruch“ wahrnehmen. Dieser Geruch rührt nur indirekt vom durch die Ionisation der Luft im Gerät gebildeten Ozon her; er kommt vielmehr durch Spuren nitroser Gase (NOx) zustande, die durch Reaktion des Ozons mit dem Luftstickstoff gebildet werden. Das Funktionsprinzip der Geräte erfordert eine Ionisierung der Luft bei Spannungen von 5–15 kV. Meist besitzen die Geräte Ozonfilter, die das produzierte Ozon in Kohlenstoffdioxid umwandeln. Dennoch sollten diese Geräte möglichst nicht in unbelüfteten Räumen verwendet werden. Moderne Drucker und Fotokopierer arbeiten mit einer Transferrollentechnik, welche die Ozonbildung verhindert und die ältere Coronadrahttechnik weitestgehend ersetzt hat.
Gewinnung und Darstellung
Darstellung im Labor
Ozon kann aus der Reaktion von Kaliumpermanganat mit konzentrierter Schwefelsäure gewonnen werden. Das als Zwischenprodukt entstehende instabile Dimanganheptoxid Mn2O7 zerfällt bei Raumtemperatur zu Mangandioxid und Sauerstoff, der reich an Ozon ist.
Bei der Elektrolyse verdünnter Schwefelsäure (ca. 20 %) entwickelt sich an einer Gold- oder Platinanode besonders bei hohen Stromdichten Ozon. Bei guter Kühlung lassen sich so 4–5 % Ozongehalt im entstehenden Sauerstoff erreichen, eine Konzentration, die ausreicht, um alle Reaktionen des Ozons im präparativen Maßstab ausführen zu können. Über ausgefeilte Apparaturen (z. B. feine Platindrahtwendeln) und Kühlung auf −14 °C lassen sich noch erheblich höhere Ozonkonzentrationen erreichen.
Ozon lässt sich weiterhin aus Luftsauerstoff unter Einwirkung von Ultraviolettstrahlung oder stillen elektrischen Entladungen herstellen. Entsprechende, als Ozonisatoren bezeichnete Geräte gibt es im Handel.[20]
Erzeugung durch Ionisierung von Luft oder Sauerstoff
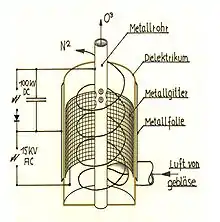
Aufgrund seiner Instabilität kann Ozon nicht über längere Zeit gelagert oder wie andere industriell verwendete Gase in Druckflaschen gekauft werden. Vor seiner Anwendung (chemische Synthese, Wasseraufbereitung, als Bleichmittel etc.) muss es an Ort und Stelle erzeugt werden.
Zur Herstellung wird meistens getrocknete Luft oder Sauerstoff (Taupunkt mind. −65 °C) als Trägergas eingesetzt. In selteneren Fällen wird Sauerstoff mit Argon, Kohlenstoffdioxid u. ä. gemischt. Im Ozonerzeuger (Ozongenerator) werden die Sauerstoffmoleküle durch stille elektrische Entladung zu Sauerstoffatomen dissoziiert, wonach noch im Plasma der Entladungsfilamente die Ozonsynthese und Ozonanreicherung stattfindet. In Luft bewegen sich typische Endkonzentrationen zwischen einem und fünf Prozent Massenanteil, in Sauerstoff zwischen sechs und dreizehn Prozent Massenanteil.
Aus reinem, trockenem Sauerstoff können bis zu 90 g·m−3, aus Luft (bei Kühlung) bis zu 40 g·m−3 Ozon gewonnen werden. Für 1 kg Ozon aus Sauerstoff (im Bereich von 1–6 Gew-%) werden 7–14 kWh Strom und 1,8 m3/h Kühlwasser verbraucht.[21]
Die in der Praxis eingesetzten technischen Vorrichtungen können auf folgenden Elektrodenkonfigurationen basieren:
- ineinander geschobene Röhren (z. B. metallisch innenbeschichtetes Glasrohr im Stahlrohr)
- parallele Platten
- drahtumwickelte Elektroden für Oberflächenentladungen
- Spitze zu Platte
Bei Anlagen mit mehr als 20 kg Ozon pro Stunde werden üblicherweise nur Röhrenozonisatoren eingesetzt.
In erster Näherung ist die Ozonanreicherung eine Funktion des elektrischen Energieeintrags pro Gasvolumen. Zur Optimierung des Wirkungsgrades können folgende Parameter variiert werden:
- Elektrodenabstand
- Elektrodenausrichtung
- Dielektrikumsmaterial
- Spitzenspannung und Frequenz
Auch durch Überlagerung eines inhomogenen elektrischen Feldes während des Energieeintrags (Dielektrophorese) kann das chemische Gleichgewicht, welches sich aus Synthese und Zersetzung bei wenigen Gewichtsprozenten einstellt, zugunsten des Ozons verschoben werden.
Obwohl die Ozonbildung aus Sauerstoff unter Wärmeabsorption erfolgt, sind Ozonerzeugerkessel in industriellen Anwendungen wassergekühlt, da fast 90 Prozent der eingetragenen Energie infolge der hohen Zersetzungsrate wieder abgeführt werden müssen. Für den Wirkungsgrad der Ozonsynthese ist die Gastemperatur ein weiterer dominierender Faktor.
Wegen der hohen Reaktivität von Ozon sind nur wenige Materialien gegen Ozon beständig. Dazu gehören Edelstahl (z. B. 316L), Glas, Polytetrafluorethylen (PTFE), Perfluoralkoxy-Polymere (PFA), Polyvinylidenfluorid (PVDF) und Perfluorkautschuk. Bedingt beständig ist Viton, das unter Ozon keiner mechanischen Wechselbelastung ausgesetzt werden darf.
Erzeugung durch Elektrolyse von Wasser
Neben der Darstellung durch Ionisierung von Luftsauerstoff oder reinem Sauerstoff besteht die Möglichkeit, Ozon durch Elektrolyse von Wasser herzustellen. Hierbei werden meist Blei(IV)-Oxid Anoden verwendet, welche durch eine Polyelektrolytmembran von der Kathodenseite getrennt sind. An der Anode wird Wasser zu molekularem Sauerstoff oder bei Überspannung zu Ozon oxidiert. Die an der Anode entstehenden Protonen wandern durch die Membran an die Kathode und werden dort zu molekularem Wasserstoff reduziert. Das eigentliche Reaktionssystem ist jedoch komplexer. Die Ozonausbeute liegt bei der Darstellung durch Wasserelektrolyse bei etwa 20 %. Zudem entsteht das Ozon direkt in der Lösung und muss bei der Nutzung in flüssigen Medien nicht erst gelöst werden.[22]
Lagerung
Flüssiges Ozon lässt sich in Form einer 30 bis 75 %igen Lösung in flüssigem Sauerstoff bei −183 °C in Gegenwart von Stabilisatoren wie CClF3, OF2, SF6 oder andere ohne Explosionsgefahr lagern.[23][24] Gasförmiges Ozon lässt sich im reinen Zustand (keine Verunreinigungen durch organische Verbindungen, Schwefel oder bestimmte Metalle) bei −112 bis −50 °C bei leichtem Überdruck recht gut lagern.[25][26][27][28]
Eigenschaften
Ozon ist bei Standardbedingungen gasförmig. Aufgrund seiner oxidierenden Wirkung reizt es bei Menschen und Tieren die Atemwege. Es vermag sogar Silber bei Raumtemperatur zu oxidieren. Ozonaufnahme kann beim Menschen häufig zu heftigen Schläfenkopfschmerzen führen. In hohen Konzentrationen riecht das Gas aufgrund der oxidierenden Wirkung auf die Nasenschleimhaut charakteristisch stechend-scharf bis chlorähnlich, während es in geringen Konzentrationen geruchlos ist. Die Geruchsschwelle liegt bei 40 µg/m3, allerdings gewöhnt man sich schnell an den Geruch und nimmt ihn dann nicht mehr wahr. Reines O3 ist eine allotrope Form von Disauerstoff O2. Bei Zimmertemperatur liegt es als instabiles, farbloses bis bläuliches, in hoher Konzentration tiefblaues diamagnetisches Gas vor, das bei −110,5 °C zu einer tiefblauen Flüssigkeit[29] kondensiert und bei −192,5 °C (80 K) zu einem schwarzvioletten Feststoff[29] erstarrt.

Das gewinkelte polare Molekül mit einem Dipolmoment von 0,5337 D (entspricht 1,780 · 10−30 C · m) bleibt im Festkörper erhalten. Der O-O-Abstand beträgt 128 pm, der Winkel zwischen den drei Sauerstoffatomen beträgt 117°.
Ozon unterhält die Verbrennung sehr viel stärker als Disauerstoff: Etliche Materialien flammen schon bei Raumtemperatur bei Kontakt mit reinem Ozon auf. Gemische aus reinem Sauerstoff und Ozon ab einem Volumenanteil von 11,5 % können sich unter Atmosphärendruck bei entsprechend hoher Zündenergie explosionsartig zersetzen.[30] Durch Beimischung von 1 % Methan oder NO2 wird die Zündgrenze auf ca. 5 % Ozon herabgesetzt.[31]
Ozon ist ein stärkeres Oxidationsmittel als Disauerstoff und in saurer Lösung ein sehr starkes Oxidationsmittel. Das Standard-Elektrodenpotential Eº für die Halbreaktion
beträgt + 2,07 V. Bei normalen Temperaturen oxidiert Ozon Metalle wie Silber und Quecksilber zu ihren Oxiden. Es oxidiert Halogenide zu Halogenen, Stickoxide zu höheren Stickoxiden, Schwefeldioxid zu Schwefeltrioxid, Eisen(II)- zu Eisen(III)-salzen und Sulfide zu Sulfaten. Mit trockenem Kaliumhydroxid reagiert es zu Kaliumozonid. Es reagiert mit organischen Stoffen und greift die meisten Arten von Doppelbindungen in ungesättigten Verbindungen wie Olefinen, Cycloolefinen, Pinenen, Aromaten und Polybutadienen an. Mit Ethin reagiert es zu Ethinozonid, einer cyclischen Verbindung mit drei Sauerstoffatomen.[32]
Ozon zerfällt leicht zu Sauerstoff in Gegenwart eines Katalysators, wie Mangandioxid oder anderen Metalloxiden. Es zersetzt sich auch in Gegenwart von Chlor oder Brom. Diese Zersetzung erfolgt auch langsam nichtkatalytisch bei normalen Temperaturen sowie in wässriger Lösung.[32]
Verwendung
Ozon in der Wasseraufbereitung
Bei der Wasseraufbereitung dient Ozon unter anderem zur umweltfreundlichen Oxidation von Eisen, Mangan, organischer Substanz und zur Entkeimung. Der erste Ozongenerator zur Trinkwasseraufbereitung wurde 1893 in Oudshoorn (Niederlande) installiert, es folgten Paris (Frankreich, 1898), das Wasserwerk Schierstein in Wiesbaden (1901) sowie Paderborn (1902).[33][34] In diesen beiden deutschen Städten endete dadurch „schlagartig“ eine Typhus-Epidemie.[35] Eine Ozonierung gehört in vielen Trinkwasserwerken zu den zentralen Aufbereitungsstufen.
Oberflächenwasser kann in den wärmeren Jahreszeiten höhere Gehalte an Algen enthalten. Wird ein derartiges Wasser zu Brauchwasser für die Verwendung in der Industrie aufbereitet, so kann durch eine Hochozonisierung die Reinigungswirkung der Filteranlagen deutlich verbessert werden. Ozon tötet durch sein hohes Oxidationspotential sowohl Keime wie auch Algen weitgehend ab und verbessert die Abfiltrierbarkeit[36] dieser feindispersen Verunreinigungen und damit die Reinigungswirkung.
Auch in der Behandlung von kommunalen und industriellen Abwässern kommt Ozon zum Einsatz (Kläranlage). Die Ozonierung wird dabei der üblichen Abwasserreinigung durch Mikroorganismen zusätzlich nachgeschaltet. Allerdings handelt es sich bei Kläranlagen mit Ozonanlagen meist um Pilotprojekte (wie zum Beispiel in Regensdorf-Watt in der Schweiz), denn die Produktion von Ozon in solch großen Maßstäben ist teuer, energieaufwändig und die Schutzmaßnahmen gegen den giftigen und ätzenden Stoff sind erheblich. Zurzeit wird diskutiert, ob die Abwasserreinigung durch die ungiftige Aktivkohle nicht ungefährlicher, billiger und umweltfreundlicher ist.
Ziele einer weitergehenden Ozonbehandlung des konventionell gereinigten Abwassers sind: (a) Abtötung pathogener Keime (Desinfektion) zur Sicherung des Vorfluters (z. B. in Hinsicht auf die Badegewässerrichtlinie) (b) oxidative Elimination/Transformation von nicht oder nur schlecht abbaubaren organischen Spurenstoffen (insbesondere Medikamentenrückstände).
Ein Nachteil der Ozonierung ist die Entstehung von unbekannten und möglicherweise giftigen Produkten, wenn Ozon mit Schadstoffen im Wasser reagiert. So wird die Bildung von krebserregenden Nitrosaminen vermutet. Des Weiteren werden einige Schadstoffe, zum Beispiel iodhaltige Röntgenkontrastmittel, von Ozon praktisch nicht abgebaut. Sie gelangen deshalb weiterhin in die Umwelt.
Ozon kann sehr gut in Verfahrenskombinationen mit nachfolgenden biologischen Systemen (Biofilter) eingesetzt werden, so beispielsweise bei der Oxidation des chemischen Sauerstoffbedarfs (CSB) zum biologischen Sauerstoffbedarf (BSB), der dann im Biofilter weiterverarbeitet wird. Ebenso findet Ozon in Fischkreisläufen in der Aquakultur oder Aquariensystemen Anwendung.
Bei den meisten „chlorfrei“ benannten Produkten oder Verfahren wird Ozon eingesetzt, so zum Beispiel beim Bleichen von Papier. In diesem Zusammenhang ist oft von „aktivem Sauerstoff“ die Rede.
Ozon in der Abgasbehandlung
Bei der oxidierenden Gaswäsche wird Ozon als Oxidationsmittel in Gaswäschern eingesetzt, um in der Waschflüssigkeit gelöste Substanzen chemisch umzusetzen und so das treibende Konzentrationsgefälle zwischen zu reinigendem Gas und Waschflüssigkeit zu erhöhen.[37] Dieses Verfahren findet bei reaktionsträgen organischen Stoffen[38] und bei heterogenen Gasgemischen mit häufig geruchsintensiven Stoffen[39] Anwendung. Alternativ besteht die Möglichkeit, schwer wasserlösliche Verunreinigungen mittels Ozon, das in den Abgasstrom geleitet wird, in höhere Oxidationsstufen überzuführen, die dann mit einem Gaswäscher entfernt werden können.[40]
Zur Beseitigung von Gerüchen
Die Behandlung mit Ozon kann der Desodorierung, also der Entfernung von unangenehmen Gerüchen, dienen. Diese Ozonbehandlung wird in der professionellen Fahrzeugaufbereitung vorgenommen, insbesondere bei Gebrauchtwagen mit Geruchsbelastung im Innenraum (z. B. ehemalige Raucherfahrzeuge). Durch die oxidierende Wirkung des Ozons werden Geruchsstoffe in geruchsneutrale Stoffe umgewandelt. Ebenso werden Keime und geruchverursachende Bakterien dabei – auch an sonst unzugänglichen Stellen – abgetötet. Als Ergebnis ist das Fahrzeug nach dieser Behandlung desinfiziert und in der Regel geruchsfrei.
Waschen und Behandeln von Textilien
Einige moderne Waschmaschinen haben ein Ozonprogramm, welches Umgebungsluft nutzt und mittels eines Ozongenerators die Wäsche desinfiziert und Gerüche eliminiert. Auch Wäschereien nutzen diese Technik. Das Behandeln von Textilien mit Ozon kann dazu genutzt werden, ihre Färbung verblassen zu lassen, um beispielsweise neue Jeanshosen wie schon getragene und verwaschene aussehen zu lassen (vintage).[41][42]
Ozon als Bleichmittel
Ozon wird in modernen Industrien auch als starkes Bleichmittel eingesetzt, es muss jedoch aufgrund seiner chemischen Flüchtigkeit und Instabilität am besten am Ort der Verwendung hergestellt werden.[43][44]
Weitere Verwendungen
Ozon wurde z. B. zur Beschleunigung des Aushärtens von Lacken benutzt.[10] Früher – und in der Alternativmedizin teilweise noch heute – wurde die Ozontherapie in Behandlungsversuchen verschiedener Leiden eingesetzt, beispielsweise gegen Diabetes und Krebs. Solche Behandlungen zählen oft zur Quacksalberei und die intravenöse Anwendung von Ozon wurde in Deutschland 1984 wegen der möglichen schweren Nebenwirkungen verboten.[45]
Ozon ist auch ein wichtiges Reagens in der synthetischen Chemie. Beispielsweise kann Vanillin aus Eugenol erhalten werden, indem man dieses mit Ozon oxidiert. Die Ozonolyse, die Umsetzung von ungesättigten Verbindungen mit Ozon, war jahrzehntelang ein wichtiges Verfahren zur Strukturaufklärung solcher Stoffe.
Schadwirkungen
Ozon in der Atemluft
Die EU hat schon seit längerer Zeit Richtwerte für die Ozonkonzentration festgelegt. Keine Gefahr für die Gesundheit besteht laut EU-Richtlinie durch Ozon unter einem Gehalt von 110 µg/m3. Ab einem Ein-Stunden-Mittelwert von 180 µg/m3 erfolgt die Unterrichtung der Bevölkerung, da bei dieser Konzentration die Leistungsfähigkeit empfindlicher Menschen bereits beeinträchtigt werden kann. Ab ungefähr 200 µg/m3 Ozon können Symptome wie Tränenreiz, Schleimhautreizungen in Rachen, Hals und Bronchien, Kopfschmerzen, verstärkter Hustenreiz, Verschlechterung der Lungenfunktion auftreten. Ab einem Ein-Stunden-Mittelwert von 360 µg/m3 werden Warnungen ausgesprochen, da ab dieser Konzentration Gefahr für die menschliche Gesundheit bestehen kann.
In der Schweiz liegt die Grenze des Ein-Stunden-Mittelwertes bei 120 µg/m3 (ca. 60 ppb). Dieser Wert wird jedoch sehr oft überschritten.[46][47][48] Im Hitzesommer 2018 ist z. B. in Winterthur der Grenzwert für Ozon bereits vor Ende Juli mehr als 50-mal überschritten worden, im Vergleich zum Vorjahr mit 39-mal.[49]
Eine langanhaltende Erhöhung der Ozonkonzentration in der Atemluft führt zu einem erhöhten Risiko, an Atemwegserkrankungen zu sterben.[50] Eine 2018 veröffentlichte Studie zeigt einen Zusammenhang zwischen der Exposition mit Ozon sowie Feinstaub und der Alzheimer-Krankheit.[51]
2021 hat die Weltgesundheitsorganisation ihre Luftgüte-Richtlinie nach unten hin angepasst. Die neue Empfehlung bei Ozon liegt bei einem Maximum von 60 – 100 µg/m3 [52]
Erhöhte Immissionswerte treten vor allem im Einflussbereich von Industriegroßräumen und Autobahnen auf. Dabei wirken sich meteorologische Effekte stark auf die lokale Bildung und den Transport des Ozons aus, so dass räumliche Abhängigkeiten über mehrere Hundert Kilometer entstehen können.[11]
Bei Hitzewellen nimmt die Konzentration zu, da Pflanzen weniger Ozon absorbieren können. Es wird geschätzt, dass dieser Effekt beispielsweise in Großbritannien während des Hitzesommers 2006 für 450 zusätzliche Tote verantwortlich war.[53]
Schäden an Pflanzen und Ernte

Ozon hat nachteilige Effekte auf Pflanzen und deren Wachstum. So sinken die Konzentrationen von Chlorophyll, Carotinoiden und Kohlenhydraten, während bei der Aminocyclopropancarbonsäure eine Erhöhung eintritt und vermehrt Ethen gebildet wird. Es konnte gezeigt werden, dass eine erhöhte Exposition von Zitruspflanzen gegenüber Ozon Schutzreaktionen gegen oxidativen Stress auslöste.[54] Über längere Zeit anhaltende hohe Ozonbelastungen können besonders Laubbäume, Sträucher und Kulturpflanzen schädigen und deren Wachstum vermindern, so dass es zu Ertragseinbußen kommen kann.[55][56][57][58]
Laut einer 2022 veröffentlichten Studie entstehen durch das Verbrennen fossiler Energieträger und die damit verbundene Ozon-Belastung in Ostasien Ernteschäden von 63 Milliarden Dollar. Allein China verliert den Autoren zufolge rund ein Drittel seiner jährlichen Getreideernte und ein Viertel seiner Reisernte, da das Ozon die Pflanzen schädigt.[59][60]
Effekte auf Materialien
Ozon kann Materialien, insbesondere verschiedene Elastomere und Kautschuke schädigen: es kann zur Ozonrissbildung kommen. Früher war das Problem vor allem bei Reifen sehr verbreitet. Seit etwa den 1950er Jahren werden den Elastomeren Ozonschutzmittel zugesetzt. Aufgrund der Präventionsmaßnahmen tritt das Problem daher kaum noch auf.[61]
Messung von Ozon
.jpg.webp)
Analyse, Einheiten
Ozon-Konzentrationen wurden früher und werden in den USA weiterhin überwiegend in ppb (also Milliardstel Volums-, Teilchen- oder Partialdruck-Anteilen) und werden SI-konform in µg/m3 angegeben. 1 ppb Ozon entspricht 2,15 µg/m3 (unter Normalbedingungen).[62]
Immissionsmessung
Ozon in der Außenluft kann photometrisch erfasst werden. Dazu wird die kontinuierlich angesaugte Probenluft durch eine Messküvette geleitet, die mit monochromatischer Strahlung einer bestimmten Wellenlänge beaufschlagt wird. Die durchtretende und somit nicht absorbierte Strahlung wird mittels Photodiode oder Photomultiplier gemessen und gibt damit Auskunft über die Ozonkonzentration in der Luft.[63] Dieses Messverfahren beruht auf dem lambert-beerschen Gesetz.[64]
Ein anderes Verfahren zur messtechnischen Erfassung von Ozon in der Außenluft ist das Kaliumiodid-Verfahren: In wässriger Lösung reagiert Ozon mit Kaliumiodid unter Freisetzung von Iod und Sauerstoff.[65] Die Extinktion der Iodlösung ist ein Maß für die Ozonkonzentration der Probenluft, die durch die Kaliumiodidlösung geleitet wurde.[66] Das Verfahren ist nicht selektiv bezüglich Ozon. Als Absorptionsgefäße sind Muenke-Waschflaschen zu verwenden.
Auch die differenzielle optische Absorptionsspektroskopie DOAS wird zur Ozonmessung eingesetzt.[67][68] Untersuchungen zur Qualitätssicherung unterschiedlicher Messmethoden liegen ebenfalls vor.[69]
Problematisch bei der Immissionsmessung von Ozon ist, dass keine haltbaren Prüfgase hergestellt werden können.[70] Zudem ist darauf zu achten, dass die eingesetzten Werkstoffe nicht mit dem Ozon reagieren können.
Bioindikation
Wirkungen von Ozon können mit Tabakpflanzen systematisch untersucht werden.[71] Zur Bioindikation werden die makroskopisch erkennbaren Blattschäden an der Pflanze als Wirkungsmessgröße herangezogen.[72]
Literatur
- Das Ozon. In: Die Gartenlaube. Heft 6, 1891, S. 99 (Volltext [Wikisource]).
- Dietmar Kunath: Ozon. In: Claus Schaefer, Torsten Schröer (Hrsg.): Das große Lexikon der Aquaristik. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9, S. 734 f.
Weblinks
Als Luftschadstoff:
- „Ozon schadet!“ (ozon-info.ch)
- Ozon – Eine Fallstudie (Uni Bielefeld, chemieunterricht.de)
- International Chemical Safety Card (ICSC) für Ozone beim National Institute for Occupational Safety and Health (NIOSH)
Messung und Vorhersage:
- Ozon. 3-Tage-Vorhersage Europa (WRF/Chem), auf der Website des österreichischen Wetterdienstes (ZAMG): Umwelt: Luftqualität
- Aktuelle Informationen über Ozon – Ozonwerte, etc. (Umweltbundesamt)
Einzelnachweise
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 535.
- Eintrag zu OZONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. September 2021.
- Eintrag zu Ozon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- W. Schröter, K.-H. Lautenschläger, H. Bibrack: Chemie. Fakten und Gesetze. 16. Auflage. Verlag Buch und Zeit, Köln 1992, ISBN 3-8166-0190-1, S. 226.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 460.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-51.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 10028-15-6 bzw. Ozon), abgerufen am 2. November 2015.
- Alfons Ahrens, Michael Becker, Uwe Behmel, Thomas Buscham, Hartmut Evers: Wasser in der Getränkeindustrie. Fachverlag Hans Carl, 2016, ISBN 978-3-418-00912-4 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 17. September 2019]).
- spiegel.de: Ozonwerte in der Atmosphäre steigen, 21. August 2020.
- Ernst Hermann Riesenfeld: Das Ozon, seine Bildung und Verwendung. In: Die Naturwissenschaften. Band 15, Nr. 38, September 1927, S. 777–784, doi:10.1007/BF01504659.
- Renate Eberts: Analyse der räumlichen Struktur von Brandenburger Ozonmeßdaten. (Memento vom 25. September 2015 im Internet Archive; PDF) TU Berlin, 1998.
- Ozone in the Atmosphere (abgerufen am 17. Mai 2008).
- Bundesamt für Umwelt (Schweiz): Schriftenreihe Umwelt, Nr. 179.
- Systemadmin_Umwelt: Ozon. 24. Juni 2011, abgerufen am 5. Juli 2020.
- Warnung vor Luftreinigern mit Ozon bzw. Ozon-Generatoren zur Geruchsbeseitigung. Bundesverband der Pneumologen, 10. September 2010, abgerufen am 8. Dezember 2015.
- VDI 6022 Blatt 5:2016 11 Raumlufttechnik, Raumluftqualität; Vermeidung allergener Belastungen; Anforderung an die Prüfung und Bewertung von technischen Geräten und Komponenten mit Einfluss auf die Atemluft (Ventilation and indoor-air quality; Avoidance of allergenic exposure; Requirements regarding the testing and evaluation of technical products and components affecting the indoor air). Beuth Verlag, Berlin, S. 21.
- Hartmut Finger, Ute Schneiderwind, Christof Asbach: Bewertung mobiler Raumluftreinigungsgeräte. In: Gefahrstoffe – Reinhalt. Luft. 75, Nr. 11/12, 2015, S. 497–502.
- VDI 3678 Blatt 2:2010-12 Elektrofilter; Prozessluft- und Raumluftreinigung (Electrostatic precipitators; Process air and indoor air cleaning). Beuth Verlag, Berlin, S. 11.
- Henning Heberer, Eberhard Nies, Markus Dietschi, Angela Möller, Wolfgang Pflaumbaum, Marco Steinhausen: Überlegungen zur Wirkung und toxikologischen Relevanz von NTP-Luftreinigungsgeräten. In: Gefahrstoffe – Reinhalt. Luft. 65, Nr. 10, 2005, S. 419–424.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2. Auflage. vol. 1, Academic Press, 1963, S. 337–340.
- Eintrag zu Ozon. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juni 2014.
- Yun-Hai Wang, Qing-Yun Chen: Anodic Materials for Electrocatalytic Ozone Generation. In: International Journal of Electrochemistry. Band 2013, 2013, ISSN 2090-3529, S. 1–7, doi:10.1155/2013/128248 (hindawi.com [abgerufen am 6. September 2021]).
- Google Patentsuche: Patent US3400024 - Inhibiting ozone decomposition with SF6, CCl2F2 or CF4, abgerufen am 1. Juli 2018
- В.Н. Зрелов, Е. П. Серегин: Жидкие ракетные топлива, »Химия«, 1975, S. 197
- Google Patentsuche: Patent US3186930 - Method for the production of ozone - Google Patentsuche, abgerufen am 28. Juni 2018
- Google Patentsuche: Patent US3186930 - Method for the production of ozone - Google Patentsuche, abgerufen am 28. Juni 2018
- J. G. Waller, G. McTurk: Storage of compressed gaseous ozone. In: Journal of Applied Chemistry. 15, 1965, S. 363, doi:10.1002/jctb.5010150803.
- C. S. Stokes, W. J. Murphy, T. R. Flint, A. E. Potter: Storage of Ozone in Dichlorodifluoromethane. In: Industrial & Engineering Chemistry Product Research and Development. 4, 1965, S. 176, doi:10.1021/i360015a007.
- Hans Rudolf Christen, Gerd Meyer: Grundlagen der allgemeinen und anorganischen Chemie. Diesterweg, 1997, ISBN 3-7935-5493-7.
- Kunihiko Koike, Masaharu Nifuku u. a.: Explosion properties of highly concentrated ozone gas. In: Journal of Loss Prevention in the Process Industries. 18, 2005, S. 465–468, doi:10.1016/j.jlp.2005.07.020.
- Kernforschungszentrum Karlsruhe, Institut für Radiochemie: Ergebnisbericht über Forschungs- und Entwicklungsarbeiten 1984 (PDF)
- Pradyot Patnaik: Handbook of Inorganic Chemicals. S. 684, McGraw-Hill, New York 2002 ISBN 0-07-049439-8
- B. Langlais, D. A. B. Reckhow, R. Deborah: Ozone in Water Treatment – Application and Engineering. Lewis Publishers, 1991, ISBN 0-87371-474-1, S. 3–4, doi:10.1201/9780203744635.
- Georg Erlwein: Siemenssche Ozonwasserwerke. Wiesbaden‐Schierstein und Paderborn. In: Zeitschrift für Elektrochemie, Band 8, Nummer 48, S. 881–887, November 1902, doi:10.1002/bbpc.19020084802.
- Sigfrid von Weiher: Erlwein, Georg in der Deutschen Biographie, abgerufen am 3. Dezember 2020. Veröffentlicht in: Neue Deutsche Biographie 4, 1959, S. 597.
- Dimitriadou Agapi, Komi Evangelia, Lykou Maria: Urbaner Metabolismus – Wasseraufbereitung. in Kapitel 5, Abschnitt 5.7.
- VDI 3679 Blatt 4:2014-10 Nassabscheider; Abgasreinigung durch oxidierende Gaswäsche (Wet separators; Waste gas cleaning by oxidative gas scrubbing). Beuth Verlag, Berlin, S. 3–6.
- Günter Baumbach: Luftreinhaltung. 2. Auflage. Springer-Verlag, Berlin/ Heidelberg/ New York 1992, ISBN 3-540-55078-X, S. 385.
- Franz Joseph Dreyhaupt (Hrsg.): VDI-Lexikon Umwelttechnik. VDI-Verlag, Düsseldorf 1994, ISBN 3-18-400891-6, S. 889.
- VDI 2441:2016-05 Prozessgas- und Abgasreinigung durch Kaltplasmaverfahren; Barriere-, Koronaentladung, UV-Strahlung (Process gas and waste gas cleaning by cold plasma - Barrier discharge, corona discharge, UV radiation). Beuth Verlag, Berlin, S. 12.
- Chi-wai Kan, Hing-fu Cheung, Queenie Chan: A study of plasma-induced ozone treatment on the colour fading of dyed cotton. In: Journal of Cleaner Production. Band 112, Januar 2016, S. 3514–3524, doi:10.1016/j.jclepro.2015.10.100.
- Lizhu Hu, Xinyi Zhou, Juanfen Chen, Xiuling Zhang, Guoqiang Chen: Investigation of Color Fading and Fabric-Touch Test for Jeans through Ozonation. In: Ozone: Science & Engineering. 11. August 2020, ISSN 0191-9512, S. 1–8, doi:10.1080/01919512.2020.1796584.
- Aktivchlorfreie Zellstoffbleiche Leibnitz Information Center for Science and Technology. Abgerufen am 16. Oktober 2020.
- Ozon Springer. Abgerufen am 16. Oktober 2020.
- Velio Alvaro Bocci: Scientific and Medical Aspects of Ozone Therapy. State of the Art. In: Archives of Medical Research. Band 37, Nr. 4, Mai 2006, S. 425–435, doi:10.1016/j.arcmed.2005.08.006.
- Amt für Lebensmittelkontrolle und Umweltschutz des Kantons Schaffhausen: Die gesundheitliche Bedeutung der Ozongehalte in der Luft. Merkblatt Juni 2001.
- Bundesamt für Statistik & Bundesamt für Umwelt: Luftqualität. (PDF, ca. 6 MB) Kapitel 7. In: Umwelt Schweiz 2007.
- Was ist Ozon? → Rückblick bei ozon-info.ch.
- Zu hohe Ozonbelastung – Stadt überprüft Aktionsplan. In: landbote.ch, 19. Juli 2018, abgerufen am 2. August 2018.
- Michael Jerrett, Richard T. Burnett u. a.: Long-Term Ozone Exposure and Mortality. In: New England Journal of Medicine. 360, 2009, S. 1085–1095, doi:10.1056/NEJMoa0803894.
- Lilian Calderón-Garcidueñas, Angélica Gónzalez-Maciel u. a.: Hallmarks of Alzheimer disease are evolving relentlessly in Metropolitan Mexico City infants, children and young adults. APOE4 carriers have higher suicide risk and higher odds of reaching NFT stage V at ≤ 40 years of age. In: Environmental Research. 164, 2018, S. 475, doi:10.1016/j.envres.2018.03.023.
- WHO: WHO global air quality guidelines: particulate matter (PM2.5 and PM10), ozone, nitrogen dioxide, sulfur dioxide and carbon monoxide.
- It’s not just the heat – it’s the ozone: Study highlights hidden dangers. University of York, abgerufen am 14. Januar 2014.
- Domingo J. Iglesias, Ángeles Calatayuda, Eva Barrenob, Eduardo Primo-Milloa, Manuel Talon: Responses of citrus plants to ozone: leaf biochemistry, antioxidant mechanisms and lipid peroxidation. In: Plant Physiology and Biochemistry. Band 44, Nr. 2–3, 2006, S. 125–131, doi:10.1016/j.plaphy.2006.03.007, PMID 16644230.
- Die Ozonwerte sinken, aber die Belastung der Wälder bleibt hoch. In: wsl.ch. Eidgenössische Forschungsanstalt für Wald, Schnee und Landschaft, 18. Dezember 2018, abgerufen am 6. Februar 2019.
- Madeleine S. Günthardt-Goerg: Ozonsymptome an Laubbäumen an ausgewählten Standorten in der Ostschweiz 2008 / 2009 / 2011. (PDF; 2,4 MB) In: Ostluft, Juni 2010, aktualisiert Februar 2013.
- Rising Ozone Levels Pose Challenge to U.S. Soybean Production, Scientists Say. NASA Earth Observatory, 31. Juli 2003, abgerufen am 10. Mai 2006.
- Randall Mutters: Statewide Potential Crop Yield Losses From Ozone Exposure. (Nicht mehr online verfügbar.) California Air Resources Board, März 1999, archiviert vom Original am 17. Februar 2004; abgerufen am 10. Mai 2006.
- Gloria Dickie: Ozone harms East Asian crops, costing $63 bln a year, scientists say. In: Reuters. 17. Januar 2022 (reuters.com [abgerufen am 23. Januar 2022]).
- Air pollution takes a bite out of Asia’s grain crops. In: Nature. 21. Januar 2022, doi:10.1038/d41586-022-00117-3.
- Robert W. Layer, Robert P. Lattimer: Protection of Rubber against Ozone. In: Rubber Chemistry and Technology. Band 63, Nr. 3, 1. Juli 1990, ISSN 1943-4804, S. 426–450, doi:10.5254/1.3538264 (allenpress.com).
- Faktenblatt Ozon. (PDF) In: Bayerisches Landesamt für Umwelt (LfU), Augsburg, lfu.bayern.de. Oktober 2018, abgerufen am 20. November 2019.
- DIN EN 14625:2012-12 Außenluft; Messverfahren zur Bestimmung der Konzentration von Ozon mit Ultraviolett-Photometrie; Deutsche Fassung EN 14625:2012. Beuth Verlag, Berlin, S. 11.
- VDI 2468 Blatt 6:1979-07 Messen gasförmiger Immissionen; Messen der Ozonkonzentration; Direktes UV-photometrisches Verfahren (Basisverfahren). VDI Verlag, Düsseldorf, S. 2.
- VDI 2468 Blatt 1:1978-05 Messen gasförmiger Immissionen; Messen der Ozon- und Peroxid-Konzentration; Manuelles photometrisches Verfahren; Kaliumjodid-Methode (Basisverfahren). VDI Verlag, Düsseldorf, S. 2.
- Franz Joseph Dreyhaupt (Hrsg.): VDI-Lexikon Umwelttechnik. VDI-Verlag, Düsseldorf 1994, ISBN 3-18-400891-6, S. 663.
- A. Nawahda: Ozone monitoring using differential optical absorption spectroscopy (DOAS) and UV photometry instruments in Sohar, Oman. I: Environ Monit Assess. 187(8), Aug 2015, S. 485. PMID 26138853
- J. A. Adame, A. Notario, F. Villanueva, J. Albaladejo: Application of cluster analysis to surface ozone, NO2 and SO2 daily patterns in an industrial area in Central-Southern Spain measured with a DOAS system. In: Sci Total Environ. 429, 1. Jul 2012, S. 281–291. PMID 22591990
- E. J. Williams, F. C. Fehsenfeld, B. T. Jobson, W. C. Kuster, P. D. Goldan, J. Stutz, W. A. McClenny: Comparison of ultraviolet absorbance, chemiluminescence, and DOAS instruments for ambient ozone monitoring. In: Environ Sci Technol. 40, Nr. 18, 15. Sep 2006, S. 5755–5762. PMID 17007137
- Franz Joseph Dreyhaupt (Hrsg.): VDI-Lexikon Umwelttechnik. VDI-Verlag, Düsseldorf 1994, ISBN 3-18-400891-6, S. 892.
- Jutta Köhler, Joachim Nittka, Michael Außendorf, Ludwig Peichl: Langzeitbeobachtung von Immissionswirkungen – 30 Jahre Bioindikation in Bayern. In: Gefahrstoffe – Reinhalt. Luft. 68, Nr. 6, 2008, ISSN 0949-8036, S. 227–234.
- VDI 3957 Blatt 6:2003-04 Biologische Messverfahren zur Ermittlung und Beurteilung der Wirkung von Luftverunreinigungen auf Pflanzen (Bioindikation); Ermittlung und Beurteilung der phytotoxischen Wirkung von Ozon und anderen Photooxidantien; Verfahren der standardisierten Tabak-Exposition (Biological measuring techniques for the determination und evaluation of the effects of air pollutants on plants (bioindication); Determination and evaluation of the phytotoxic effect of photooxidants; Method of the standardised tobacco exposure). Beuth Verlag, Berlin, S. 6.




