Tetrahydromethanopterin
Tetrahydromethanopterin (THMPT, H4MPT) ist ein Coenzym in der Methanogenese. Es wurde in verschiedenen Mikroorganismen entdeckt und spielt dort eine wichtige Rolle im Stoffwechsel von Methylgruppen. Eine modifizierte Form von THMPT ist Tetrahydrosarcinapterin (mit an der 2-Hydroxyglutarsäure gebundenem Glutamylrest) und auch die bekanntere Tetrahydrofolsäure ist mit THMPT verwandt.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
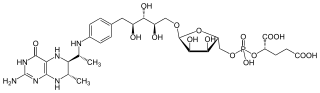 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Tetrahydromethanopterin | ||||||||||||
| Andere Namen |
H4MPT | ||||||||||||
| Summenformel | C30H45N6O16P | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 776.68 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Eigenschaften
Tetrahydromethanopterin enthält die Methylgruppe, die im Zuge der Methanogenese reduziert und anschließend auf Coenzym M übertragen wird.[2]
Im Vergleich zu Tetrahydrofolat ist Methyl-THMPT aufgrund der fehlenden Carbonylgruppe am Phenylring schwerer zu reduzieren. Die Reduktion wird durch eine iron-sulfur cluster free hydrogenase vermittelt.[3]
Im C1-Stoffwechsel gibt N-Formylmethanofuran die C1-Gruppe an das N5 des Pteridins, wodurch Formyl-THMPT entsteht.[4] Die Formylgruppe kondensiert zum kationischen Methenyl-THMPT, welches anschließend zum Methylen-THMPT reduziert wird.[3] Methylen-THMPT wird durch die Methylen-THMPT-Reduktase mittels Coenzym F420 zu Methyl-THMPT reduziert. Methyl-THMPT überträgt die Methylgruppe an Coenzym M durch die Methyl-THMPT:Coenzym-M-Methyltransferase.[2]
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Thauer RK: Biochemistry of methanogenesis: a tribute to Marjory Stephenson. 1998 Marjory Stephenson Prize Lecture. In: Microbiology. 144, Nr. Pt 9, September 1998, S. 2377–406. doi:10.1099/00221287-144-9-2377. PMID 9782487.
- Korbas M, Vogt S, Meyer-Klaucke W, et al.: The iron-sulfur cluster-free hydrogenase (Hmd) is a metalloenzyme with a novel iron binding motif. In: J. Biol. Chem.. 281, Nr. 41, Oktober 2006, S. 30804–13. doi:10.1074/jbc.M605306200. PMID 16887798.
- Acharya P, Warkentin E, Ermler U, Thauer RK, Shima S: The structure of formylmethanofuran: tetrahydromethanopterin formyltransferase in complex with its coenzymes. In: J. Mol. Biol.. 357, Nr. 3, März 2006, S. 870–9. doi:10.1016/j.jmb.2006.01.015. PMID 16466742.