Oberflächenspannung
Die Oberflächenspannung ist die infolge von Molekularkräften auftretende Erscheinung bei Flüssigkeiten, ihre Oberfläche klein zu halten. Die Oberfläche einer Flüssigkeit verhält sich ähnlich einer gespannten, elastischen Folie. Dieser Effekt ist zum Beispiel die Ursache dafür, dass Wasser Tropfen bildet, und trägt dazu bei, dass einige Insekten über das Wasser laufen können oder eine Rasierklinge auf Wasser „schwimmt“.


Die Oberflächenspannung (Formelsymbol: , ) ist also eine Grenzflächenspannung, die zwischen Flüssigkeiten und Gasphasen auftritt. Gemessen wird sie in den SI-Einheiten kg/s2, gleichbedeutend mit N/m.
Bedeutung

Die Oberflächenspannung ist eine ziehende Kraft, die an der Oberfläche einer Flüssigkeit lokalisiert ist und ihre Wirkungsrichtung ist parallel zur Flüssigkeitsoberfläche. Demnach steht eine Flüssigkeitsoberfläche stets unter Spannung. Eine Flüssigkeitsoberfläche kann somit mit einer leicht gespannten dünnen Folie verglichen werden, bloß dass die Spannung nicht von der Dehnung abhängt.

Die Oberflächenspannung verleiht einer Flüssigkeitsoberfläche spezielle Eigenschaften. So können nichtbenetzte Objekte von einer Wasseroberfläche getragen werden, solange ihr Gewicht nicht ausreicht, um die Oberflächenspannung zu überwinden. Anschaulich wird dies, wenn man beispielsweise eine Büroklammer – aus fettigem Eisendraht – auf eine Wasseroberfläche legt. Sie wird nicht oder nur teilweise benetzt, sinkt etwas unter den Wasserspiegel, nimmt dabei aber die Oberfläche mit, dellt sie ein. Die Oberflächenspannung greift mit vertikalen Kraftkomponenten an der Büroklammer an und trägt diese. Dieser Effekt wird auch von Lebewesen wie dem Wasserläufer ausgenutzt, um auf einer Wasseroberfläche laufen zu können.
Die Oberflächenspannung ist die Ursache dafür, dass Flüssigkeiten kugelförmige Gestalt annehmen, wenn keine anderen Kräfte auf sie wirken. Ein Beispiel dafür sind Flüssigkeitstropfen in der Schwerelosigkeit einer Raumstation. Nach Quecksilber als Spitzenreiter unter den Reinstoffen hat Wasser eine besonders hohe Oberflächenspannung. Diese sinkt mit steigender Temperatur deutlich und kann durch Hinzufügen schon geringer Mengen oberflächenaktiver Stoffe (Detergentien) deutlich reduziert werden.
Ein praktisches Beispiel sind besonders kleine Wassertröpfchen. Zur Erklärung denke man sich eine Flüssigkeit, deren Gestalt nicht kugelförmig ist. Die Oberflächenspannung greift parallel zur Flüssigkeitsoberfläche an und gleicht lokal abweichende Krümmungen aus.
Wenn andere Kräfte auf einen Flüssigkeitstropfen wirken, so weicht dessen Gestalt von der kugelförmigen ab. Ein Beispiel dafür sind Regentropfen von mehr als 1 mm Durchmesser und Flüssigkeitstropfen auf einer Festkörperoberfläche, wo zusätzlich anziehende Kräfte zwischen Festkörper und Flüssigkeit wirken (Adhäsion). Je höher die Adhäsion zwischen Festkörper und Flüssigkeit ist, desto mehr weicht die Form des Tropfens von der kugelförmigen ab: er wird flacher oder es bildet sich ein durchgehender Flüssigkeitsfilm, der die Festkörperoberfläche benetzt.
Ein anderes Beispiel für die Wirkung der Oberflächenspannung ist die sechseckige Form von Wabenzellen der Honigbienen. Die Zellen werden zuerst rund aus Bienenwachs gebaut. Das Material gibt aber durch die im Bienenstock herrschenden Temperaturen nach (fließt) und bildet dabei plane Grenzflächen (Minimalflächen) zwischen den einzelnen Zellen.
Physikalischer Hintergrund

Es gibt zwei Definitionen der Oberflächenspannung, die konsistent sind. Einerseits die mechanische Definition, nach der die Oberflächenspannung eine Kraft pro Länge ist, und die thermodynamische, wonach die Oberflächenspannung eine Energie pro Fläche ist.
Mechanische Definition
Die mechanische Definition lässt sich anhand eines Bügels mit der Breite erklären, in dem ein Flüssigkeitsfilm eingespannt ist. Wenn der Flüssigkeitsfilm durch eine Kraft parallel zur Oberfläche und senkrecht zu um auseinandergezogen wird, so wird am Film die Arbeit verrichtet und die Oberfläche wächst um (Faktor 2 wegen Vorder- und Rückseite des Films). Die Oberflächenspannung ist das Verhältnis . Demnach handelt es sich bei der Oberflächenspannung um eine Kraft pro Länge, die parallel zur Flüssigkeitsoberfläche gerichtet ist.
Die Richtigkeit der Vorstellung der Oberflächenspannung als Kraft parallel zur Oberfläche zeigt sich in zahlreichen Messmethoden und Effekten wie der Bügelmethode, der Kapillarität oder dem Kontaktwinkel.[1]
Thermodynamische Definition
Die thermodynamische Vorstellung der Oberflächenspannung als Energie pro Fläche rührt von dem Bild her, dass an der Flüssigkeitsoberfläche die Symmetrie der Flüssigkeitsmoleküle gestört ist. Das Fehlen von Flüssigkeitsmolekülen vertikal zur Flüssigkeitsoberfläche und die somit „fehlende“ Bindungsenergie muss durch eine positive Energie kompensiert werden. Um die Oberfläche einer Flüssigkeit zu vergrößern benötigt man Energie, wobei die Oberflächenspannung definiert ist als Energie die man benötigt um die Flüssigkeitsoberfläche um eine Einheitsfläche zu vergrößern. Somit folgt
- ,
womit die Analogie der Vorstellung „fehlender Bindungsenergie“ zur mechanischen Definition gezeigt ist.
Diese anschauliche Interpretation ist jedoch noch nicht ausreichend um die Oberflächenspannung thermodynamisch zu definieren. Um dies zu tun geht man von der Änderung der freien Enthalpie bei konstanter Temperatur und konstantem Druck aus, welche durch Gleichung (1) beschrieben wird, wobei die Enthalpie, die Temperatur und die Entropie kennzeichnet.
Man kann diese Gleichung umschreiben, indem man die Definition der Enthalpie einsetzt und berücksichtigt, dass gilt.
 Durch die Oberflächenspannung wölbt sich das Getränk über dem Glas.
Durch die Oberflächenspannung wölbt sich das Getränk über dem Glas.
Für die Änderung der inneren Energie wird eingesetzt, wobei für die verrichtete Arbeit steht. Für die Wärmemenge gilt . Daraus folgt:
Der Ausdruck für die Arbeit kann in einen Term für die Volumenarbeit und nicht expansive Arbeit zerlegt werden.
Bei konstanter Temperatur und konstantem Druck entspricht die Änderung der freien Enthalpie der nicht expansiven Arbeit. Dieser Ausdruck kann nun in Verbindung mit der Oberflächenspannung gebracht werden. Sofern nur Arbeit aufgewendet wird um die Oberfläche einer Flüssigkeit zu vergrößern so entspricht diese dem Ausdruck . Da nun die Oberflächenspannung als Arbeit pro Einheitsfläche definiert ist muss noch die Oberfläche der Flüssigkeit berücksichtigt werden. Somit folgt:
Die Oberflächenspannung ist somit thermodynamisch als partielle Ableitung der freien Enthalpie nach der Oberfläche bei konstanter Temperatur und konstantem Druck definiert.[2]
Molekulare Theorie zur Oberflächenspannung
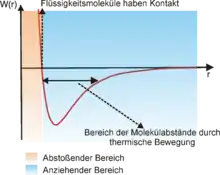
Die Vorstellung der fehlenden Flüssigkeitsmoleküle an der Oberfläche verleitet intuitiv zu der Annahme, dass die Oberflächenspannung eine Kraft vertikal zur Flüssigkeitsoberfläche sei. Dies stimmt jedoch nicht mit der mechanischen Definition der Oberflächenspannung überein. Um die mechanische Definition hierbei in Einklang mit der thermodynamischen zu bringen muss man berücksichtigen, dass innerhalb einer Flüssigkeit sowohl anziehende als auch abstoßende Kräfte auf ein Molekül wirken. Während in einem Festkörper lokal entweder anziehende oder abstoßende Kräfte wirken, da sich die Teilchen an fixierten Plätzen befinden, so sind in einer Flüssigkeit die Moleküle beweglich. Die Abstände zwischen den Flüssigkeitsmolekülen können sich verändern und somit können auf ein Flüssigkeitsteilchen abstoßende und auch anziehende Kräfte wirken. Dieser Sachverhalt kann auch in einem Lennard-Jones-Potential veranschaulicht werden. Dieses beschreibt allgemein das Potential zwischen zwei ungeladenen Teilchen in Abhängigkeit von deren Distanz. Geraten die Teilchen bei kurzen Distanzen in Kontakt, so stoßen sie sich ab, während sie sich bei größeren Distanzen anziehen. Während in einem Festkörper der Abstand zwischen zwei Teilchen fixiert ist, kann sich dieser in einer Flüssigkeit aufgrund der thermischen Bewegung ändern, was anziehende und auch abstoßende Kräfte auf ein Flüssigkeitsmolekül ermöglicht. Im Bild rechts ist eine schematische Darstellung eines Lennard-Jones-Potentials abgebildet, das die Kräfte zwischen Flüssigkeitsmolekülen erklärt. Haben die Flüssigkeitsmoleküle Kontakt, so stoßen sie sich ab (oranger Bereich), während sie sich bei großen Distanzen anziehen (blauer Bereich). In einer Flüssigkeit ändern sich die Abstände zwischen den Teilchen ständig aufgrund der Wärmebewegung, was durch den schwarzen Doppelpfeil in der Abbildung dargestellt ist. Somit können auf ein Flüssigkeitsmolekül sowohl anziehende als auch abstoßende Kräfte wirken.
Man kann die abstoßenden Kräfte als Kontaktkräfte interpretieren. Aufgrund dessen kann deren Wirkung im Raum als richtungsunabhängig, also isotrop angesehen werden. Die anziehenden Kräfte innerhalb einer Flüssigkeit wirken bei weiteren Entfernungen, sind bedingt durch die Struktur der Moleküle und können als richtungsabhängig im Raum, also anisotrop angesehen werden.
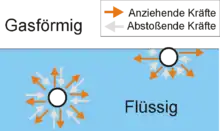
An der Phasengrenzfläche zwischen Flüssigkeit und Gasphase ändert sich die Dichte der Flüssigkeit sprunghaft im Bereich weniger Moleküllängen, bis sie konstant auf dem Wert des Flüssigkeitsinneren bleibt. Dies bewirkt, dass auch die abstoßenden Kräfte in der Flüssigkeit sprunghaft an der Oberfläche größer werden, bis sie den konstanten Wert des Flüssigkeitsinneren erreichen, wobei dieser Anstieg in alle Raumrichtungen gleich groß ist aufgrund der isotropen Natur der abstoßenden Kräfte. Zur weiteren Erklärung dient das Bild rechts, in dem die Kräfte auf ein Flüssigkeitsmolekül an der Oberfläche und im Inneren veranschaulicht sind. An der Flüssigkeitsoberfläche ist die Symmetrie gestört, das heißt, die Moleküle dort haben in vertikaler Richtung keine benachbarten Moleküle. Somit wirken in vertikaler Richtung nur von unten abstoßende Kräfte (grauer Pfeil) auf die Moleküle. Um das Kräftegleichgewicht zu wahren, werden die abstoßenden Kräfte in vertikaler Richtung durch anziehende Kräfte (oranger Pfeil) ausgeglichen. In horizontaler Richtung, also parallel zur Oberfläche ist dies nicht notwendig, da die Symmetrie nicht gestört ist. Das heißt, dass in horizontaler Richtung von allen Seiten abstoßende Kräfte auf die Flüssigkeitsmoleküle an der Oberfläche wirken. Zusätzlich zu den abstoßenden Kräften wirken auch anziehende Kräfte in horizontaler Richtung. Diese sind jedoch nicht notwendig um das Kräftegleichgewicht zu wahren und können daher und aufgrund ihrer anisotropen Natur in ihrem Betrag größer sein als die abstoßenden Kräfte. Das bedeutet, dass an der Flüssigkeitsoberfläche in horizontaler Richtung die anziehenden Kräfte auf die Flüssigkeitsmoleküle größer sind als die abstoßenden Kräfte. Im Flüssigkeitsinneren sind die anziehenden und abstoßenden Kräfte auf ein Molekül gleich groß.
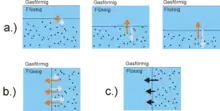
Um die Oberflächenspannung nun als Kraft parallel zur Oberfläche weiter zu verstehen, ist es anschaulich, die Flüssigkeit in zwei Hälften zu teilen, wie es im Bild rechts abgebildet ist. Dort sieht man eine gepunktete und eine nicht gepunktete Hälfte, wobei diese lediglich zur Markierung der beiden Teile dienen. Man betrachtet die Kräfte, die von dem nicht gepunkteten Teil auf den gepunkteten Teil der Flüssigkeit ausgeübt werden. a.) Erst legt man die Trennlinie zwischen den Flüssigkeitshälften parallel zur Flüssigkeitsoberfläche. In Richtung des Flüssigkeitsinneren nimmt die Dichte zu, daher werden auch die abstoßenden Kräfte (grau) auf den gepunkteten Teil größer. Diese werden durch anziehende Kräfte (orange) ausgeglichen. b.) Legt man nun die Trennlinie zwischen den Hälften in vertikaler Richtung, so kann man wiederum die abstoßenden Kräfte, die auf den gepunkteten Teil wirken, einzeichnen. Diese sind aufgrund ihrer isotropen Natur in ihrem Betrag gleich groß wie in vertikaler Richtung. Die anziehenden Kräfte auf den gepunkteten Teil sind jedoch nicht isotroper Natur und können in ihrem Betrag größer sein als die abstoßenden Kräfte. Man erkennt auch, dass sich dieser Unterschied verkleinert je weiter man ins Flüssigkeitsinnere fortschreitet. Bereits nach ein paar Moleküllängen gleichen sich anziehende und abstoßende Kräfte in horizontaler Richtung aus, da die Dichte in Richtung des Flüssigkeitsinneren zunimmt. c.) Der nicht gepunktete Teil der Flüssigkeit übt eine anziehende Kraft auf den gepunkteten Teil aus, die in Richtung des Flüssigkeitsinneren abnimmt.
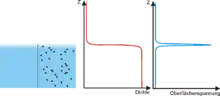
Zusammenfassend kann gesagt werden, dass sich im Bereich weniger Moleküllängen die Dichte an der Flüssigkeitsoberfläche (rote Kurve im Bild rechts) ändert, bis sie den konstanten Wert des Flüssigkeitsinneren erreicht. Dies hat zur Folge, dass an der Flüssigkeitsoberfläche eine ziehende Kraft in horizontaler Richtung wirkt. Die blaue Kurve im Bild rechts beschreibt die Differenz zwischen anziehender und abstoßender Kraft, die von dem nicht gepunkteten Teil der Flüssigkeit auf den gepunkteten Teil in horizontaler Richtung ausgeübt wird. Sie entspricht der Oberflächenspannung und ist im Bereich weniger Moleküldurchmesser an der Oberfläche lokalisiert.[3]
Abhängigkeiten
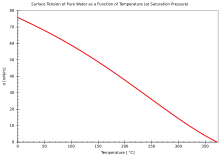
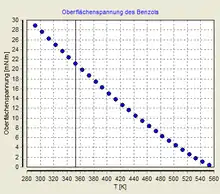
- Für Wasser gilt ausgehend von dem Wert bei 20 °C und der gewünschten Temperatur T die folgende Näherungsgleichung (vgl. Eötvössche Regel):
- (in SI-Einheit: N/m)
- In einem Flüssigkeitstropfen herrscht aufgrund der Oberflächenspannung ein erhöhter Druck, ebenso wie im Inneren einer Seifenblase. Die Druckerhöhung im Flüssigkeitstropfen wird durch die Young-Laplace-Gleichung beschrieben.
- Bei Bildung von Flüssigkeitspartikeln an Kondensationskernen tritt der Krümmungseffekt auf. Es zeigt sich dabei, dass über den gekrümmten Oberflächen der entstehenden Flüssigkeitstropfen ein höherer Sättigungsdampfdruck auftritt als im Vergleich zu einer ebenen Wasseroberfläche.
- Grenzflächenaktive Substanzen wie Tenside setzen die Oberflächenspannung herab. Ihr Effekt kann durch einen der Oberflächenspannung entgegengesetzten Lateraldruck beschrieben werden. ist kein Druck, sondern hat dieselbe Einheit wie die Oberflächenspannung.
- Die angrenzende Luftschicht ist vom Dampf der Flüssigkeit gesättigt. Das Eindringen anderer Dämpfe von außen kann die Oberflächenspannung erheblich verändern.
- Die Oberflächenspannung ist temperaturabhängig und nimmt im Allgemeinen mit steigender Temperatur ab. Am kritischen Punkt ist sie gleich null. Die Temperaturabhängigkeit wird durch die Eötvössche Regel beschrieben; die oben bereits angegebene Gleichung ist ein für Wasser geltender Spezialfall dieser Regel.
Werte
| Flüssigkeit | Oberflächenspannung in mN/m = 10−3 N/m |
|---|---|
| n-Pentan | 16,00 |
| n-Hexan | 18,40 |
| Ethanol | 22,55 |
| Methanol | 22,60 |
| Aceton | 23,30 |
| Benzol | 28,90 |
| Ethylenglycol | 48,4 |
| Wasser bei 80 °C | 62,6 |
| Glycerin | 63,4 |
| Wasser bei 50 °C | 67,9 |
| Wasser bei 20 °C | 72,75 |
| Quecksilber bei 18 °C | 471,00 |
| Quecksilber bei 20 °C | 476,00 |
| Galinstan bei 20 °C | 718,0[4] |
Wasser hat also eine vergleichsweise hohe Oberflächenspannung (siehe auch Drucktabellen Wasser in WikiBooks).
Messung
Man kann die Oberflächenspannung zum Beispiel mit Hilfe der Ring- (von Lecomte De Noüy), Platten- (von Wilhelmy) oder Bügel-Methode (von Lenard), mit einem Tensiometer oder durch den Kapillareffekt messen.
Auch kann man über eine optische Auswertung den liegenden oder hängenden Tropfen vermessen und so die Oberflächenspannung der Flüssigkeit ermitteln.
Bügelmethode


Bei der Bügelmethode (auch als Abreißmethode bekannt) wird ein Bügel mit einem darin eingelöteten extrem dünnen Draht (meist aus Platin) in die Flüssigkeit gehängt, sodass dieser gerade in die Flüssigkeit eintaucht und von dieser benetzt wird. Mit einer Präzisionsfederwaage wird dann die Zugkraft am Bügel nach und nach erhöht. Der Draht wird dann aus der Flüssigkeit gezogen und zieht einen Flüssigkeitsfilm mit. An einem bestimmten Punkt reißt dieser Film ab.
Durch das Ziehen am Bügel wird Arbeit gegen die Oberflächenspannung verrichtet. Aus der maximal möglichen Zugkraft am Bügel, bevor der Flüssigkeitsfilm abreißt, den Abmessungen des Bügels und der Dichte der Flüssigkeit kann dann die Oberflächenspannung berechnet werden.
Bei Flüssigkeiten wie Ethanol und Drahtlängen von 2–3 cm bei einem Radius von 0,1 mm liegt der Erwartungswert für die Masse im zwei- bis dreistelligen Milligramm-Bereich. Es sind also sehr präzise Waagen nötig. Bei einer Messunsicherheit der Waage von 5 mg und einer Vermessung des Drahtes auf 1 µm genau beträgt der größte Fehler des Endergebnisses bereits 8 bis 12 %.
Messung mit dem Kapillareffekt

Bei dieser Messmethode macht man sich den Kapillareffekt zunutze, also, dass Flüssigkeiten in dünnen Röhren nach oben steigen. Man benötigt ein Gefäß (etwa eine Küvette) und eine möglichst dünne Kapillare. Diese wird dann einfach in die Flüssigkeit gestellt und die Steighöhe wird gemessen.
Da die Flüssigkeit theoretisch unendlich lange braucht, um ihren Endstand zu erreichen, zieht man die Flüssigkeit zunächst in der Kapillare (etwa mit einer Spritze) nach oben und lässt sie anschließend wieder absinken. Die Oberflächenspannung kann dann direkt aus der Steighöhe abgelesen werden, wenn die Dichte der Flüssigkeit und der Kapillarradius bekannt sind. Da dessen Messung recht schwierig ist, nimmt man Einmalmikropipetten und misst deren Länge. Da das Volumen bekannt ist, lässt sich so der Innenradius berechnen.
Wasser erreicht in Kapillaren mit einem Radius von 0,2 mm Steighöhen von bis zu 7 cm. Für die möglichst exakte Messung der Steighöhe eignet sich beispielsweise ein Kathetometer. Ist die Dichte der Flüssigkeit genau bekannt und kann man die Steighöhe auf 0,1 mm genau ablesen, liegt der Fehler im unteren einstelligen Prozentbereich.
Weitere Methoden
- Du-Noüy-Ringmethode: klassische Methode zur Messung der Grenzflächenspannung und Oberflächenspannung. Unkritisch auch bei schwierigen Benetzungsverhältnissen. Gemessen wird die Kraft einer vom Ring hochgezogenen Flüssigkeitslamelle.
- Wilhelmy-Plattenmethode: Universalmethode, speziell geeignet für Oberflächenspannungsmessungen über einen längeren Zeitbereich. Gemessen wird die Kraft, die sich durch die Benetzung der senkrecht aufgehängten Platte ergibt.
- Kontaktwinkelmessung: Gibt auch Aufschluss über die Benetzbarkeit eines Stoffes. Über die Youngsche Gleichung lässt sich aus dem Cosinus des Kontaktwinkels die Oberflächenspannung berechnen.
- Spinning-Drop-Methode: zur Bestimmung von Grenzflächenspannungen. Besonders geeignet für niedrige bis extrem niedrige Messbereiche. Gemessen wird der Durchmesser eines rotierenden Tropfens in der schweren Phase.
- Pendant-Drop-Methode: geeignet für Grenz- und Oberflächenspannungsmessungen. Messmöglichkeiten auch bei extremen Drücken und Temperaturen. Optische Erfassung der Tropfengeometrie. Größe der Tropfen, die von einer Kapillare abtropfen, ist proportional zur Oberflächenspannung.
- Sessile-Drop-Methode: Bestimmung von Grenz- und Oberflächenspannungen aus dem Profil eines auf einem Substrat ruhenden Tropfens. In der Vergangenheit beliebte Methode zur Messung an flüssigen Metallen und Legierungen, da die Messung unter hohen Temperaturen und/oder extremen Drücken mit dieser Methode verhältnismäßig leicht zu realisieren ist.
- Blasendruck-Methode: geeignet zur messtechnischen Erfassung der dynamischen Oberflächenspannung (Messung in Abhängigkeit vom Oberflächenalter). Gängige Messverfahren sind das Maximaldruckverfahren und das Differenzdruckverfahren.
- Tropfen-Volumen-Methode: überlegene Methode zur dynamischen Messung von Grenzflächenspannungen. Gemessen wird die Tropfenanzahl, in die sich ein vorgegebenes Flüssigkeitsvolumen teilt.
- Prüftinten-Methode: ein in der Industrie (z. B. bei der Verklebung von Selbstklebefolien) auf Kunststoffen angewandter Test. Auf die zu prüfende Oberfläche wird mittels Pinsel eine gefärbte Flüssigkeit („Tinte“) mit definierter Oberflächenspannung aufgetragen. Wenn die Oberfläche von der Tinte benetzt wird (d. h. der Pinselstrich bleibt für > 3 Sekunden bestehen ohne sich zusammenzuziehen), ist die Oberflächenspannung der geprüften Oberfläche gleich oder größer als die der Prüftinte. Zieht sich der Pinselstrich dagegen binnen 3 Sekunden zusammen, ist die Oberflächenspannung der geprüften Oberfläche kleiner als die der Prüftinte.
- Expanding/Oscillating-Drop-Methode (EDM/ODM): Methode zur Erfassung der oberflächenrheologischen Eigenschaften von Flüssigkeiten. Beschrieben wird die Abhängigkeit der Oberflächenspannung vom Grad und von der Geschwindigkeit der Flächenausdehnung eines Tropfens, der entweder schnell ausgedehnt wird und dann stillsteht (EDM) oder einer sinoidal oszillierenden Schwingung unterliegt (ODM). Mit Hilfe dieser Messtechnik kann die Schaumstabilität und die Emulsionsstabilität beschrieben werden.
- Methode mit einem Gemisch aus Ethylenglycolmonoethylether und Formamid. Beide Flüssigkeiten werden in einem bestimmten Verhältnis miteinander vermischt. Dadurch erhält man einen definierten Dyn-Wert zur Oberflächenspannungsbestimmung. Hergestellt wird das Gemisch mittels eines Tensiometers.
- Stalagmometer-Methode beruht auch auf der Tropfenform.
Historisches
Der Begriff der Oberflächenspannung wurde erstmals 1629 von Niccolò Cabeo verwendet und 1751 von Johann Andreas von Segner klarer gefasst. Zur Theorie wurde 1805 von Thomas Young, 1806 von Pierre-Simon Laplace, 1830 von Siméon Denis Poisson (siehe auch Young-Laplace-Gleichung, Youngsche Gleichung) und 1842 bis 1868 von Joseph Plateau Wertvolles beigetragen.
Siehe auch
- Dortmunder Datenbank und DETHERM: Sammlung experimentell bestimmter Oberflächenspannungen
- DIPPR 801: Parameter für die Berechnung von Oberflächenspannungen (zumeist per Polynom)
Literatur
- Cyril Isenberg: The Science of Soap Films and Soap Bubbles. Tieto, Clevedon 1978, ISBN 0-905028-02-3.
Weblinks
- Oberflächenspannung von Flüssigkeiten und Messmethoden
- Oberflächenspannung: Hintergrund, technische Bedeutung, Messmethoden
- Prozessmessgröße Oberflächenspannung
- Video: Oberflächenspannung und die Folgen – Sind Oberflächen immer Minimalflächen?. Jakob Günter Lauth (SciFox) 2013, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.5446/15671.
Einzelnachweise
- B. Lautrup: Physics of Continuous Matter. CRC Press, Boca Raton 2011, ISBN 978-1-4200-7700-1.
- V. Ribitsch: Vorlesungsskriptum der Universität Graz. (PDF) Kapitel 3. (Nicht mehr online verfügbar.) In: kfunigraz.ac.at. Karl-Franzens-Universität Graz, ehemals im Original; abgerufen am 3. Februar 2014. (Seite nicht mehr abrufbar, Suche in Webarchiven) .
- Antonin Marchand, Joost H. Weijs, Jacco H. Snoeijer, Bruno Andreotti: Why is surface tension a force parallel to the interface? In: American Journal of Physics. Band 79, Nr. 10, 1. Oktober 2011, S. 999–1008, doi:10.1119/1.3619866, arxiv:1211.3854.
- Ch. Karcher, V. Kocourek, D. Schulze: Experimental Investigations of Electromagnetic Instabilities of Free Surfaces in a Liquid Metal Drop. In: International Scientific Colloquium – Modelling for Electromagnetic Processing, 24.–26. März 2003. 2003, S. 105–110 (sci-toys.com [PDF; abgerufen am 28. März 2016]).