Enzymhemmung
Enzymhemmung (auch Enzyminhibition) ist die Hemmung einer enzymatischen Reaktion durch einen Hemmstoff, der Inhibitor genannt wird. Dabei wird die Geschwindigkeit der katalysierten Reaktion herabgesetzt. Inhibitoren können an unterschiedliche Reaktanten binden, wie zum Beispiel an das Enzym oder das Substrat. Auch der Bindungsort am Enzym kann vom aktiven Zentrum, an dem das Substrat bindet, bis hin zu anderen Stellen, die für die Aktivität des Enzyms wichtig sind, variieren. Enzymhemmung spielt eine wichtige Rolle bei der Regulation des Stoffwechsels in allen Lebewesen.
Grundlagen
Enzyme sind für jeden Organismus essentiell. Sie sind an jedem Stoffwechselprozess beteiligt und wirken als Katalysatoren für die meisten Reaktionen. Um diese Prozesse regulieren zu können, brauchen die Zellen bestimmte Mechanismen, welche die Aktivität der Enzyme beeinflussen. Manche Enzyme können durch Modifikationen angeschaltet, also aktiviert werden. Beispielsweise wird die bei der Verwertung von Glukose benötigte Pyruvatkinase durch Phosphorylierung reguliert, d. h., dem Enzym kann eine Phosphorylgruppe angehängt werden. Diese phosphorylierte Form der Pyruvatkinase ist wenig aktiv. Wurde das Enzym jedoch nicht durch eine Phosphorylgruppe modifiziert, besitzt es volle Aktivität.
Die Aktivität von Enzymen kann auch durch Bindung von bestimmten Stoffen beeinflusst werden. Diese Stoffe werden Effektoren genannt. Je nachdem wie Effektoren auf ein Enzym wirken, werden sie Aktivatoren oder Inhibitoren genannt. Aktivatoren erhöhen die Aktivität von Enzymen, d. h., sie fördern die durch das Enzym katalysierte Reaktion. Inhibitoren senken die Aktivität und somit hemmen sie die durch das Enzym katalysierte Reaktion.
Es gibt weitere Möglichkeiten zur Verringerung der Enzymaktivität, welche aber nicht zur Enzymhemmung gehören. Dazu zählen Beeinflussungen durch die Temperatur, den pH-Wert, die Ionenstärke oder Lösungsmitteleffekte. Diese Faktoren wirken unspezifisch auf eine Vielzahl von Vorgängen.
Einteilung der Enzymhemmung
Die Enzymhemmung unterteilt sich abhängig von der Bindung des Inhibitors in reversible und irreversible Hemmung. Bei der reversiblen Enzymhemmung kann der Inhibitor wieder vom Enzym abgespalten oder verdrängt werden. Er bindet sich nicht fest an das Enzym. Diese Form der Enzymhemmung wird zur Regulation verschiedener Stoffwechselprozesse genutzt, die zeitweise nicht ablaufen sollen. Zum Beispiel wird die Glykolyse zur Energiegewinnung aus Glucose genutzt. Ein Enzym dieses Prozesses ist die erwähnte Pyruvatkinase. Ein weiteres Enzym der Glykolyse ist die Phosphofructokinase. Besitzt die Zelle viel Energie, speichert sie diese in Form von Adenosintriphosphat (ATP). Dieses ATP hemmt als Inhibitor die Phosphofructokinase und auch die Pyruvatkinase. Somit wird keine Glucose mehr in Energie, also ATP, umgewandelt. Diese spezielle Form der Enzymhemmung, bei der das Endprodukt rückwirkend das generierende Enzym hemmt, wird Endprodukthemmung oder Feedback-Hemmung genannt.
Bei der irreversiblen Hemmung bindet der Inhibitor so fest, dass er nicht mehr vom Enzym zu lösen ist. Die Aktivität des Enzyms geht verloren. Irreversible Hemmung entfalten zum Beispiel Antibiotika mancher Pilze zu deren Schutz.
Reversible Enzymhemmung
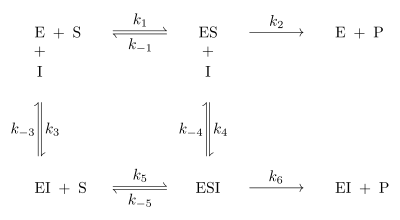
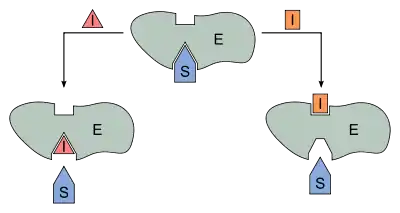
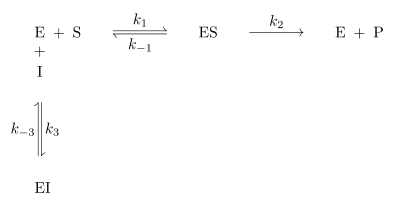
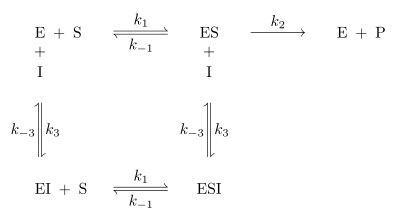
Bei der reversiblen Enzymhemmung bindet der Inhibitor I reversibel an das Enzym E und senkt somit dessen Aktivität bzw. die Geschwindigkeit der Reaktion des Substrates S zum Produkt P. Der Inhibitor kann aber zum Beispiel vom Substrat wieder verdrängt werden. Mathematisch gesehen gibt die Geschwindigkeitskonstante die Geschwindigkeit der ungehemmten Reaktion an. Bindet nun der Inhibitor an den Enzym-Substrat-Komplex ES so wird die Reaktion durch die Geschwindigkeitskonstante definiert. ist kleiner als . Da es sich um reversible Enzymhemmung handelt, stellt sich bei den Reaktionen zu ES, dem Enzym-Inhibitor-Komplex EI und dem Enzym-Substrat-Inhibitor-Komplex ESI ein Gleichgewicht ein. Alle Geschwindigkeitskonstanten auch für die Gleichgewichte sind in Abb. 1 an den entsprechenden Reaktionspfeilen abgebildet.
Im Fließgleichgewicht kann die Reaktionsgeschwindigkeit sogar rechnerisch bestimmt werden:
Durch Umformulieren erhält man folgende für die reversible Enzymhemmung allgemein gültige Gleichung für die Reaktionsgeschwindigkeit:
Die eingeführte Konstante entspricht und die Konstante . Die Gleichgewichtskonstanten und lassen sich aus Abb. 1 ableiten: und .
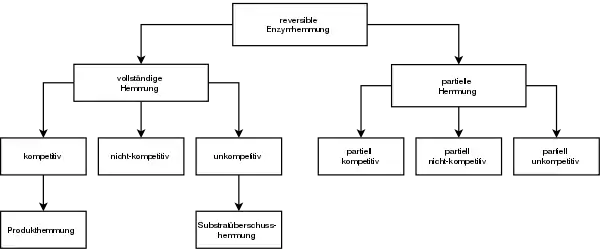
In Abb. 2 sind die wichtigsten Hemm-Mechanismen der reversiblen Enzymhemmung aufgeführt. Die Einteilung erfolgte in vollständige und partielle Hemmung, die sich in unterscheiden. Bei der vollständigen Enzymhemmung liegt bei 0, bei der partiellen ist dieser Wert ungleich 0. Das heißt, das Enzym behält bei einer partiellen Hemmung seine katalytische Aktivität bei, die allerdings durch den Inhibitor beeinflusst wird. Bei der vollständigen Enzymhemmung hingegen kann der ESI-Komplex nicht mehr an der Reaktion teilnehmen und ist somit inaktiv.
Die Produkthemmung ist ein Sonderfall der kompetitiven Hemmung, denn der Inhibitor ist das Produkt der Reaktion. Auch die Substratüberschusshemmung ist ein Sonderfall der unkompetitiven Hemmung. Das Substrat ist in diesem Fall der Inhibitor, wenn dieses in hoher Konzentration vorliegt.
Kompetitive Hemmung
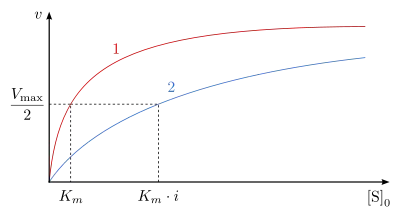
Kompetitive Inhibitoren sind Substanzen, die mit dem Substrat um die Bindungsstelle im aktiven Zentrum des Enzyms konkurrieren. Sie werden nicht umgesetzt und können dadurch vom Substrat wieder verdrängt werden. Kompetitive Inhibitoren haben oft hohe Ähnlichkeit mit dem Substrat. Der Mechanismus der kompetitiven Hemmung ist in Abb. 3 dargestellt. Deutlich zu sehen ist, dass das Enzym E das Substrat S und den Inhibitor I nicht gleichzeitig binden kann. Durch die reversible Bindung von S bzw. I an E entsteht ein Gleichgewicht zwischen freiem Enzym E, dem Enzym-Substrat-Komplex ES und dem Enzym-Inhibitor-Komplex EI. Unter der Voraussetzung, dass sowohl das Substrat S als auch der Inhibitor I in sehr viel höheren Konzentrationen als das Enzym E vorliegen, kann man für den steady-state-Zustand folgende Reaktionsgeschwindigkeitsgleichung formulieren:
Die enthaltenen Konstanten sind so definiert:
und
- .
Die Reaktionsgeschwindigkeit ist in Abhängigkeit von der Ausgangssubstratkonzentration in Ab- und Anwesenheit des kompetitiven Inhibitors in Abb. 4 dargestellt. Die Michaelis-Menten-Konstante wird in Gegenwart des Inhibitors um den Faktor erhöht. Die Maximalgeschwindigkeit bleibt jedoch unverändert.
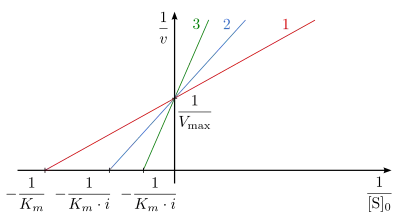
Die Linearisierung der Michaelis-Menten-Auftragung wird durch den Reziprokwert der Gleichung erreicht.
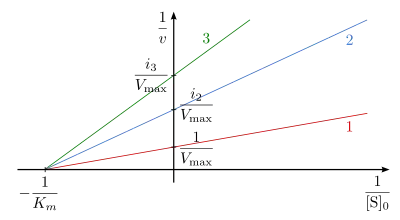
Die doppelt reziproke Auftragung, also die Auftragung von gegen in Gegenwart unterschiedlicher Konzentrationen des Inhibitors ist in Abb. 5 dargestellt und wird Lineweaver-Burk-Auftragung genannt. Die Steigung des Graphen erhöht sich in Anwesenheit des Inhibitors um . Da unverändert bleibt, schneiden sich alle Geraden auf der Ordinate im Punkt . Die Schnittpunkte mit der Abszisse spiegeln den Wert wider.
Die oben beschriebenen Gleichungen wurden für die kompetitive Hemmung abgeleitet, bei der die gleichzeitige Bindung von Substrat und Inhibitor ausgeschlossen wird. Die Bedingungen für eine kompetitive Hemmung können aber auch erfüllt werden, wenn der Inhibitor nicht die gleiche Bindungsstelle am Enzym einnimmt wie das Substrat. Eine Bindung im aktiven Zentrum, wodurch die Substratbindung sterisch eingeschränkt ist, führt auch zum kompetitiven Hemmtyp.
Hemmung durch ein konkurrierendes Substrat
In diesem speziellen Fall reversibler Enzymhemmung ist das Enzym in der Lage, zwei Reaktionen zu katalysieren, also zwei verschiedene Substrate zu binden. Das Enzym E bindet das Substrat A und setzt dieses zum Produkt P um. Die Bindung des Substrates B an das Enzym E führt zur Bildung von Produkt Q. Somit wird die Reaktionsgeschwindigkeit durch Zugabe des Substrates B verringert, da auch das zweite Substrat B gebunden und umgesetzt werden kann. Das eine Substrat wirkt bei dieser Konkurrenzreaktion auf die Reaktionsgeschwindigkeit der Reaktion des jeweils anderen Substrates als kompetitiver Inhibitor. Dadurch ergeben sich folgende Geschwindigkeitsgleichungen:
Nichtkompetitive und allosterische Hemmung
Bei der allosterischen Hemmung (griech.: allos: anders; steros: Ort) lagern sich die Inhibitoren, auch allosterische Effektoren genannt, nicht (wie bei der kompetitiven Hemmung) an das aktive Zentrum, sondern an einer anderen Stelle des Enzyms an, das allosterische Zentrum. Dabei wird die Konformation des Enzyms so verändert, dass die Bindung des Substrats am aktiven Zentrum erschwert bzw. ganz unmöglich gemacht wird.
Die allosterische Hemmung lässt sich nur durch die Entfernung des Effektors rückgängig machen. Ein Enzym, das die erste Reaktion einer Reaktionskette katalysiert, wird oft durch die am Ende gebildete Substanz gehemmt. In diesem Falle bezeichnet man diese negative Rückkopplung als Endprodukthemmung oder Feedback-Hemmung.
Bei der nichtkompetitiven Hemmung wird durch Bindung des Inhibitors I an das Enzym E die Substratbindung nicht beeinflusst. Da der Inhibitor I nicht im substratbindenden, aktiven Zentrum andockt, ist er in der Lage sowohl an das freie Enzym E als auch an den Enzym-Substrat-Komplex ES zu binden. Das Substrat kann mit dem Enzym-Inhibitor-Komplex EI zwar chemisch reagieren, jedoch ist die Abspaltung des Produkts P gehemmt (Abb. 6).
Unter steady-state-Bedingungen kann eine Geschwindigkeitsgleichung hergeleitet werden:
- .
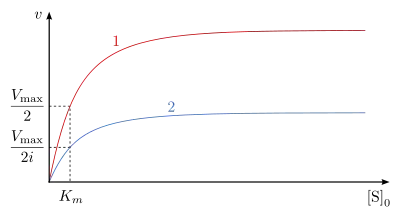
Die Konstanten und sind folgendermaßen definiert: und . Aus der Geschwindigkeitsgleichung kann man ableiten, dass der nichtkompetitive Inhibitor die Maximalgeschwindigkeit um den Faktor verringert. Der -Wert für das Substrat bleibt unverändert.
Die Auftragung nach Lineweaver-Burk mit der Formel
- .
ist in Abb. 8 dargestellt. Die reziproke Reaktionsgeschwindigkeit in Abhängigkeit von der reziproken Substratkonzentration ist in Gegenwart eines nichtkompetitiven Inhibitors i-fach erhöht, der Ordinatenschnittpunkt ergibt den Wert . Die Reaktionsgeraden bei unterschiedlichen Inhibitorkonzentrationen schneiden sich auf der Abszisse in dem Punkt mit dem Wert .
In manchen Fällen der nichtkompetitiven Hemmung weicht das Verhalten des Inhibitors etwas vom „Normalfall“ ab. Die Umsetzung des Inhibitors mit dem Enzym erfolgt dann sehr viel schneller als die des Substrates. Bei niedrigen Substratkonzentrationen ist die Verminderung der Maximalgeschwindigkeit nicht so stark. Daher ergibt sich für die Bedingungen und folgende Geschwindigkeitsgleichung:
- .
Bei Ermittlungen des Hemmtypes eines Inhibitors sollte mit einem solchen Verhalten gerechnet werden.
Unkompetitive Hemmung
Gelegentlich kommt neben der kompetitiven und der nichtkompetitiven Hemmung auch der unkompetitive Hemmtyp vor. Dabei geht der Inhibitor nur mit dem Enzym-Substrat-Komplex ES eine Reaktion ein, wie in Abb. 9 zu sehen ist. Die für diesen Mechanismus unter steady-state-Bedingungen abgeleitete Gleichung für die Reaktionsgeschwindigkeit lautet wie folgt:
Die Konstanten sind so definiert: und . Aus der in Abb. 10 dargestellten Michaelis-Menten-Auftragung einer unkompetitiven Hemmung kann man sehen, dass durch den Inhibitor sowohl die maximale Reaktionsgeschwindigkeit als auch der -Wert verändert wird.
Durch Umformung der Geschwindigkeitsgleichung in die reziproke Form kann die Abhängigkeit von Reaktionsgeschwindigkeit zu Ausgangskonzentration des Substrates linearisiert dargestellt werden:
Aus dieser Formel ist zu erkennen, dass der Anstieg unabhängig vom unkompetitiven Inhibitor ist, das heißt, die Graphen liegen bei unterschiedlichen Inhibitorkonzentrationen parallel zueinander. Die Nullstelle gibt den Wert wieder. Die Geraden schneiden die Ordinate im Punkt .
Die unkompetitive Hemmung kommt zum Beispiel bei Oxidasen vor, wenn der Inhibitor nur mit einer bestimmten Oxidationsstufe des Enzyms reagieren kann. Eine weitere Möglichkeit für einen unkompetitiven Inhibitor bietet sich bei einem Ordered-Mechanismus, einer Zwei-Substratreaktion, bei der der Inhibitor konkurrierend zu einem der Substrate auftritt.
Partiell kompetitive Hemmung
Eine partiell-kompetitive Hemmung gibt es definitionsgemäß eigentlich nicht, da bei der kompetitiven Hemmung Substrat und Hemmstoff nicht gleichzeitig an das Enzym binden können, es gibt also keinen EIS-Komplex der Substrat umsetzen könnte. In der älteren Literatur wird dieser Ausdruck jedoch für einen Spezialfall der partiell-nichtkompetitiven Hemmung gebraucht mit kcat = k*. In diesem Fall ähnelt der Lineweaver-Burk-Plot einer kompetitiven Hemmung, der Sekundärplot ist gekrümmt. Der Ausdruck „partiell-kompetitiv“ ist also mechanistisch falsch und sollte nicht mehr verwendet werden[1].
Substratüberschusshemmung
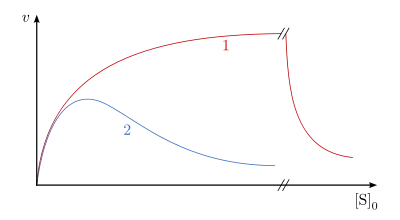
Durch sehr hohe Substratkonzentrationen kann es bei manchen Enzymen zur Bindung eines zweiten Substratmoleküls an das Enzym kommen. Der so entstandene ESS-Komplex ist nicht in der Lage in Produkt und Enzym zu zerfallen. Für diesen Reaktionsmechanismus lautet die Geschwindigkeitsgleichung:
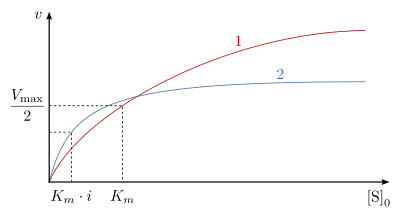
Die Dissoziationskonstante des ESS-Komplexes wurde als bezeichnet. Wenn der -Wert sehr viel niedriger als der -Wert ist, erhält man eine hyperbole Abhängigkeit in der Michaelis-Menten-Auftragung (Abb. 13, Kurve 1). Sind diese beiden Werte annähernd gleich oder der -Wert höher, so entsteht sozusagen eine Optimumkurve (Abb. 13, Kurve 2).
Hemmung durch Reaktion eines Inhibitors mit dem Substrat
Bei diesem Hemmtyp reagiert der Inhibitor mit dem Substrat, welches dann von dem Enzym nicht mehr umgesetzt wird. Die Bindung des Inhibitors wird bei dieser Hemmung als reversibel angesehen. Dadurch wird die dem Enzym frei zugängliche Substratkonzentration herabgesetzt:
In Gegenwart des Inhibitors wird die Maximalgeschwindigkeit bei hohen Substratkonzentrationen erreicht. Im Lineweaver-Burk-Diagramm lässt sich dieser Mechanismus von einem kompetitiven Inhibitor differenzieren, da eine Abweichung von der Linearität auftritt.
Inaktivierung
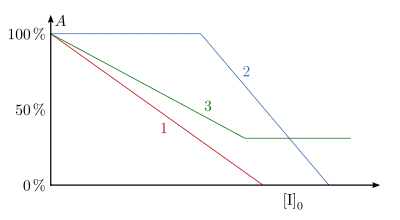
Durch die irreversible Bindung des Inaktivators an das Enzym wird die katalytische Aktivität vermindert (fälschlich auch als „irreversible Enzymhemmung“ bezeichnet, Hemmung ist jedoch per Definitionem immer reversibel). Eine Dissoziation des Enzym-Inaktivator-Komplexes in freies Enzym und Inaktivator ist nicht möglich, d. h., das Enzym bleibt für immer inaktiv. Die Aktivität hängt linear von der Inaktivatorkonzentration ab. Diese Abhängigkeit ist in Abb. 14 (Kurve 1) zu erkennen. Abweichend von diesem Verlauf entsteht die Kurve 2 in der Abbildung. Dabei reagiert der Inaktivator irreversibel mit mehreren Gruppen unterschiedlicher Spezifität, was zum Austitrieren der spezifischeren, aber nicht aktiv am Katalysemechanismus beteiligten Gruppen, führt. Anschließend reagieren die für die Katalyse bedeutsamen Gruppen, wodurch die Aktivität gesenkt wird. Andererseits kann der Inaktivator mit dem Enzym einen Komplex eingehen, der noch geringe Aktivität aufweist. Dies ist bei der Kurve 3 der Abbildung der Fall.
Ist die Inaktivatorkonzentration erheblich höher als die des Enzyms, so kann man die Geschwindigkeitskonstante für die Reaktion des Enzyms mit dem Inaktivator als Reaktion pseudo-erster Ordnung formulieren:
entspricht in dieser Gleichung der Aktivität. Die Geschwindigkeitskonstante kann aus dem Anstieg bestimmt werden, indem man den Logarithmus der Aktivität gegen die Reaktionszeit aufträgt.
Die Geschwindigkeitskonstante wird durch die Anwesenheit des Substrates beeinflusst. Denn dieses schützt das Enzym vor der Inaktivierung durch den Inaktivator, wodurch die Geschwindigkeitskonstante kleiner ist als ohne Substratzugabe. Bei einem solchen Verhalten kann es sein, dass der Inaktivator an eine spezifische Gruppe im aktiven Zentrum bindet, also eine gleiche Bindungsstelle wie das Substrat aufweist.
Ein Beispiel für eine Inaktivierung sind die sogenannten „Suizid-Substrate“, die mit der funktionellen Gruppe des Enzyms eine kovalente Bindung eingehen und dieses somit blockieren. Inaktivierung durch solche Substanzen erfordert nicht nur eine Bindungsstelle am Enzym, sondern auch katalytische Umsetzung des Inaktivators im Enzym. Solche Substanzen sind also sehr spezifisch und verursachen, als Medikamente verabreicht, wenige Nebenwirkungen (Beispiel: Penicillin).
Weblinks
- Seite zur Enzymhemmung
- Eintrag zu Enzym im Flexikon, einem Wiki der Firma DocCheck
Literatur
- Hans Bisswanger: Enzymkinetik. Theorie und Methoden Wiley-VCH, 2000, ISBN 3-527-30096-1.
- Alfred Schellenberger (Hrsg.): Enzymkatalyse: Einführung in die Chemie, Biochemie und Technologie der Enzyme Gustav Fischer Verlag, Jena 1989.
Einzelnachweise
- H. Bisswanger: Enzymkinetik. Theorie und Methoden, 2. Aufl., Weinheim (VCH) 1994, S. 119