Veresterung
Eine Veresterung (auch Esterbildung) ist eine chemische Reaktion, bei der aus einer organischen oder anorganischen Oxosäure und einem Alkohol ein sogenannter Ester gebildet wird. Im klassischen Sinn ist eine Veresterung die Reaktion einer Carbonsäure mit einem Alkohol unter Bildung eines Carbonsäureesters bei Wasserabspaltung. Carbonsäureester lassen sich jedoch auch durch Umsetzung von Alkoholen und bspw. Carbonsäurechloriden oder Carbonsäureanhydriden herstellen. Die Kondensationen anderer Oxosäuren wie Phosphorsäure, Schwefelsäure oder Sulfonsäuren mit Alkoholen führen ebenfalls zu Estern und können damit auch als Veresterungen betrachtet werden.
Übersichtsreaktion
Die Reaktion ist eine Gleichgewichts- und Kondensationsreaktion, bei der ein Alkohol oder ein Phenol mit einer Carbonsäure (oder einer anorganischen Säure) zu einem Ester und Wasser reagieren.

Der hier farbig dargestellte Mechanismus ist für primäre und sekundäre Alkohole gültig, nicht jedoch bei tertiären Alkoholen. Bei tertiären Alkoholen wird im Zuge der Reaktion die OH-Gruppe des Alkohols abgespalten und das dabei entstandene Carbeniumion an die Carbonsäure addiert. Es bleibt also der Sauerstoff der Carbonsäure im Ester erhalten.
Mechanismus der säurekatalysierten Veresterung von Carbonsäuren (Fischer-Veresterung)
Emil Fischer hat erkannt[1], dass schon geringe Mengen an Schwefelsäure die Esterausbeute stark erhöhen und nicht, wie damals üblich, große Mengen an Säure notwendig sind.[2]
Der erste Schritt der Veresterung ist die Protonierung der Carbonsäure zu einem mesomeriestabilisierten Kation.
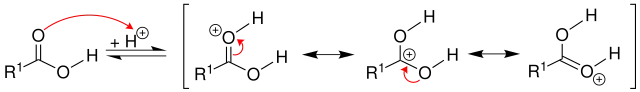
Das durch die Protonierung gebildete Kation wird von einem freien Elektronenpaar der Hydroxygruppe des Alkohols nukleophil angegriffen. Das Wasserstoffatom des ursprünglichen Alkanols bildet eine intramolekulare Wasserstoffbrücke zu einem Sauerstoffatom der Carboxygruppe aus und geht mit diesem schließlich eine Bindung ein.

Das oben im letzten Schritt entstandene Oxoniumion spaltet zunächst Wasser zu einem Kation ab, das nach Deprotonierung den Ester ergibt.

Dieser Mechanismus konnte durch Isotopenmarkierung des Sauerstoffatoms im Alkohol nachgewiesen werden.[3]
Das rasch gebildete Gleichgewicht der Esterbildung erfordert eine erhöhte Temperatur, oder die Zugabe von Säuren. Zur Säurekatalyse wird oft Schwefelsäure verwendet, denn diese bindet durch ihr Hydrationsvermögen eine gewisse Menge an Wasser, sodass das Wasser aus dem Reaktionsgleichgewicht entfernt wird (das Reaktionsgleichgewicht wird zugunsten des Esters verschoben).[4]
Die im Labormaßstab gängigste Methode zur Herstellung von Estern ist die azeotrope Veresterung.[5] Dabei wird das bei der Reaktion gebildete Wasser mit einem Lösemittel als Azeotrop herausdestilliert (herausgeschleppt). Als Lösemittel/Wasserschlepper nutzt man meist Hexan, Chloroform oder Toluol. Das früher häufig verwendete Benzol wird kaum noch verwendet, weil es ein krebserzeugender Arbeitsstoff ist. Als Katalysator wird meist p-Toluolsulfonsäure statt Schwefelsäure verwendet, weil sie bei vergleichbarer Aktivität angenehmer zu handhaben ist und bei dieser Methode die wasserbindenden Eigenschaften der Schwefelsäure nicht vonnöten sind. Nutzt man einen Wasserabscheider kann zudem der Verlauf der Veresterung quantitativ verfolgt werden.
Als besonders wirksame Katalysatoren haben sich Hafnium(IV)-salze (u. a. Hafniumdichloridoxid) erwiesen (ein Hafnium(IV)-salz-Molekül kann 7 Wassermoleküle binden).[6]
Weitere Veresterungsreaktionen
Es gibt eine Reihe weiterer Möglichkeiten, Alkohole und Säuren bzw. Säurederivate zu Estern umzusetzen, so z. B. die Reaktion zwischen Alkohol und Säurechlorid (Schotten-Baumann-Methode), Alkohol und Säureanhydrid, die Steglich-Veresterung oder die Mitsunobu-Reaktion. Die Umesterung erlaubt den Austausch der alkoholischen oder Säurekomponente eines vorhandenen Esters. Speziell Ester des tert-Butanol kann man meist nicht durch eine direkte Veresterung herstellen; sie werden durch säurekatalysierte Addition von Isobuten an Carbonsäuren hergestellt.
Esterspaltung
Die Rückreaktion der Veresterung ist die saure Esterhydrolyse (siehe Hydrolyse). Die basische oder alkalische Esterhydrolyse folgt einem anderen Reaktionsmechanismus als die saure und ist deswegen unter Verseifung explizit dargestellt.
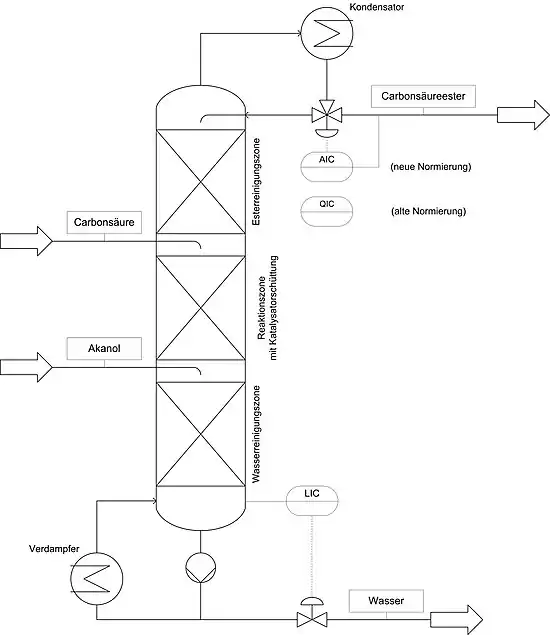
Herstellungsprozess
Viele chemische Produkte werden in einer chemischen Reaktion hergestellt und anschließend destilliert. Bei der Gewinnung eines Esters werden beide Prozesse miteinander verbunden. Dieses Verfahren wird Reaktivdestillation genannt. Während der Reaktion können ein oder mehrere Produkte (bei der Veresterung: Wasser) durch das Verdampfen entfernt werden. Das chemische Gleichgewicht stellt sich darauf immer neu ein, und dadurch kann eine größere Ausbeute des Esters erlangt werden. Der Prozess hat den Vorteil, dass zwei Arbeitsschritte vereint werden können. Der apparative Aufwand ist gering, und das Verfahren ist preiswert.[7]
Einzelnachweise
- Théophile-Jules Pelouze, Amédée Gélis: Mémoire sur l'acide butyrique. In: Annales de Chimie et de Physique. 3ème Série IX, 1844, S. 434–456, hier S. 453 (eingeschränkte Vorschau in der Google-Buchsuche).
- Emil Fischer, Arthur Speier: Darstellung der Ester. In: Chemische Berichte. 28, 1895, S. 3252–3258. doi:10.1002/cber.189502803176.
- Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie. Springer, Wien/New York 1972, ISBN 3-211-81060-9, S. 73–74.
- Walter Beyer: Lehrbuch der organischen Chemie. Band 24, 2004, S. 272.
- Klaus Schwetlick u. a.: Organikum. 24. Auflage. Wiley-VCH, Weinheim 2015, ISBN 978-3-527-33968-6.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1539.
- Chemie und Life Science: Reaktivdestillation eröffnet neue Perspektiven.