Umesterung
Eine Umesterung ist eine chemische Reaktion, bei der ein Ester in einen anderen übergeführt wird. Bei der Umesterung wird der Alkoholrest eines Esters durch einen anderen Alkoholrest ersetzt. Die Reaktion kann säurekatalytisch und mit Überschüssen des freien Alkohols oder aber durch Verwendung der sehr viel nucleophileren Alkoholate vorgenommen werden. Säurekatalysiert ist diese Reaktion eine Gleichgewichtsreaktion und unterliegt damit dem Massenwirkungsgesetz.
Grundlagen
Bei einer Umesterung handelt es sich um den Angriff eines Alkoholat-Ions als Nucleophil auf einen Ester der gleichen oder einer anderen Alkohol-Komponente eines Esters. So erfolgt irgendwann die Einstellung eines Gleichgewichtes zwischen den konkurrierenden Alkoholat-Ionen. Die Reaktion ist auch unter anderem als Zemplén-Reaktion bekannt.[1] Bei der säurekatalysierten Umesterung wird das Carbonyl-Sauerstoffatom protoniert, der Alkohol kann am stark positivierten Carbonyl-Kohlenstoffatom mit seinem Sauerstoff-Atom angreifen. Dabei muss aufgrund des Massenwirkungsgesetzes entweder mit großen Überschüssen der Alkoholkomponente gearbeitet werden oder aber der entstehende Alkohol entfernt werden, z. B. durch Destillation.
.png.webp)
Es können auch zwei unterschiedliche Carbonsäureester eingesetzt werden, welche dann unter Säurekatalyse ihre Alkoholreste austauschen. Diese Vorgehensweise hat aber in der Praxis eine geringe Bedeutung, da man hier in der Regel Stoffgemische erhält:
 säurekatalysierte Umesterung von zwei Carbonsäuren
säurekatalysierte Umesterung von zwei Carbonsäuren
Bei der säurekatalysierten Umesterung von zwei Carbonsäureestern werden die Alkoholreste R2 in blau und R4 in lila gegeneinander ausgetauscht.
Mechanismus
Eine Umesterung (Alkoholyse) kann sowohl durch Säuren wie auch durch Basen katalysiert werden. Es handelt sich um eine Gleichgewichtsreaktion. Im Sauren beginnt die Reaktion mit der Protonierung des Carbonyl-Sauerstoffatoms, gefolgt von einem Angriff des Alkohols auf das Carbonyl-Kohlenstoffatom. Im Basischen wird zunächst der Alkohol deprotoniert. Dann greift er als Alkoholat-Anion das positiv polarisierte Carbonyl-Kohlenstoffatom des Esters an, siehe Abbildung:[2]
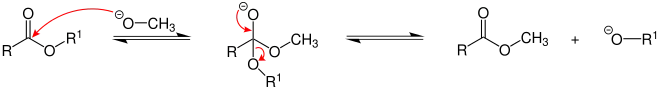 Genereller Mechanismus der Umesterung
Genereller Mechanismus der Umesterung
In diesem Beispiel wird als Alkoholat das Methanolat gewählt, somit entsteht ein Methylester.
Technische Bedeutung
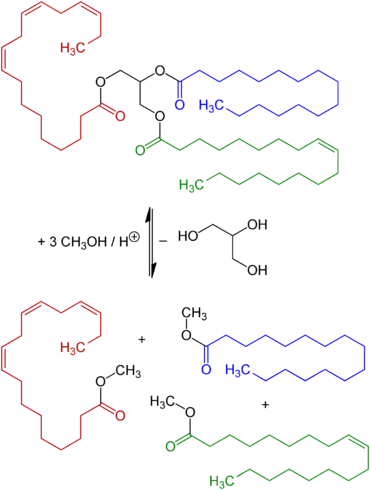
Die Umesterung wird bei folgenden technischen Produkten eingesetzt:
- Herstellung von Biodiesel: Aus Triacylglyceriden (pflanzliche Fette oder Öle) werden durch Umesterung mit Methanol sogenannte FAME (Fettsäuremethylester, z. B. Rapsmethylester, RME) erzeugt. Als Nebenprodukt entsteht unter anderem der dreiwertige Alkohol Glycerin. In Deutschland wird in Umesterungsanlagen Biodiesel im industriellen Maßstab erzeugt.
- Herstellung von Polyethylenterephthalat aus Dimethylterephthalat
Anwendung in der Nahrungsmittelindustrie
Die Umesterung wird in der Lebensmittelchemie zur Herstellung von:[3]
- Margarine
- Zuckertensiden
- Monoglyceriden aus Triglyceriden
- Rapsölmethylestern aus Rapsöl-Triglyceriden
verwendet. Das getrocknete und entsäuerte Fett wird dafür bei 80–100 °C mit Natriummethanolat als Katalysator gerührt.[4] Mit Lipasen kann eine positionsspezifische Umesterung erreicht werden.
Analytik
Besonders in der Gaschromatographie werden weniger flüchtige Ester wie Fettsäureester oft in besser flüchtige Methylester umgeestert um sie hier zugänglich zu machen.
Einzelnachweise
- Karl W. Rosenmund, Felix Zymalkowski, Eckart Güssow: Über die Verwendung von Aluminium-Alkoholaten zu Umesterungs- und Verseifungsreaktionen. In: Archiv der Pharmazie. 286, 1953, S. 324–330, doi:10.1002/ardp.19532860704.
- Kurt Peter C. Vollhardt, Neil Eric Schore, Katrin-M. Roy, Holger Butenschön: Organische Chemie. 5. Auflage. Wiley-VCH, Weinheim 2011, ISBN 978-3-527-32754-6, S. 1006 (eingeschränkte Vorschau in der Google-Buchsuche).
- Römpp - Lebensmittelchemie. 9. Auflage, Thieme, Stuttgart 1995, ISBN 3-13-736601-1.
- Hans-Dieter Belitz, Peter Schieberle, Werner Grosch: Lehrbuch Der Lebensmittelchemie⁵. Springer, 2001, S. 645 (eingeschränkte Vorschau in der Google-Buchsuche).
Literatur
- Charles E. Mortimer: Chemie – Das Basiswissen der Chemie. Thieme Verlag, Stuttgart 2007, 9. überarbeitete Auflage, 766 S.