Reduktiver Acetyl-CoA-Weg
Der reduktive Acetyl-CoA-Weg (auch Wood-Ljungdahl-Weg) ist ein Stoffwechselweg autotropher, strikt anaerober Mikroorganismen und dient der Kohlenstoffdioxid-Assimilation, aber auch zur Energiegewinnung. Dieser Weg ist das biologische Äquivalent des Monsanto-Prozesses, bei dem auf technischen Wege Acetat dargestellt wird.
| Übergeordnet |
| Kohlenstoffdioxid-Assimilation |
| Gene Ontology |
|---|
| QuickGO |
Vorkommen
Der reduktive Acetyl-CoA-Weg ist bei allen homoacetogenen sowie vielen sulfatreduzierenden grampositiven Bakterien bekannt. Anhand Moorella thermoacetica[1] wurden die meisten Untersuchungen über die Biochemie des reduktiven Acetyl-CoA-Weges durchgeführt.
Der Stoffwechselweg wurde auch bei Archaeen nachgewiesen:[2]
- bei Euryarchaeota:
- in vielen methanogenen Archaeen
- aber auch in sulfatreduzierenden Vertretern (Gattung Ferroglobus und Art Archaeoglobus fulgidus)
- bei Proteoarchaeota:
- in vielen Asgard-Archaeen
- in den Bathyarchaeota
- bei DPANN-Archaeen:
In allen Fällen läuft der reduktive Acetyl-CoA-Weg nur unter anaeroben Bedingungen ab.
Biochemie
Bei dem reduktiven Acetyl-CoA-Weg handelt es sich um einen nichtzyklischen Weg der Fixierung von Kohlenstoffdioxid (CO2) bzw. verschiedenen C1-Verbindungen wie Formiat, Methanol, Kohlenmonoxid, Methylamin oder Methylether. Als Reduktionsmittel dient hierbei elementarer Wasserstoff (H2). Oben genannte Mikroorganismen können mit diesen C1-Verbindungen und H2 wachsen, da die Acetatbildung unter Standardbedingungen energetisch günstig ist (ΔG0’ = −95 kJ/mol[3] bzw. −104 kJ/mol[4]):
- Vier Moleküle Wasserstoff und zwei Moleküle Kohlenstoffdioxid werden zu einem Molekül Essigsäure (hier dissoziiert) und zwei Molekülen Wasser umgesetzt.
Das Schlüsselenzym ist hierbei die hoch oxidationsempfindliche CO Dehydrogenase/Acetyl-CoA-Synthase (CODH/ACS bzw. Acetyl-CoA-Synthase-Komplex), die sowohl eine Kohlenmonoxiddehydrogenase-Aktivität hat (CO-Dehydrogenase), als auch Acetyl-CoA synthetisieren kann (Acetyl-CoA-Synthase). Die Fixierung beinhaltet zwei Zweige, die nach ihren Entdeckern benannt wurden. Im „Methyl-Zweig“ wird CO2 zu einem Methylrest (CH3) reduziert, was durch die wissenschaftliche Arbeit von Lars Ljungdahl entdeckt wurde. Harland Woods Arbeit klärte den Weg im sogenannten „Carbonyl-Zweig“, bei dem das zweite Molekül CO2 zu Kohlenstoffmonoxid (CO) reduziert wird. In der Literatur sind ferner die Bezeichnungen östlicher (eastern) bzw. westlicher (western) Zweig für den Methyl- bzw. Carbonyl-Zweig bekannt.[5]
Es sind viele Varianten des reduktiven Acetyl-CoA-Weges bekannt. Die dabei stattfindenden biochemischen Prozesse sind bisher nur in Acetogenen, Methanogenen und Sulfatreduzierern identifiziert worden. Sie unterscheiden sich in den beteiligten Coenzymen und den Elektronenüberträgern. Allgemein zeigen die an dem Vorgang beteiligten Enzyme des Carbonylzweiges unter Bakterien und Archaeen eine große Homologie auf.[6]
Im Folgenden wird der Weg für Bakterien beschrieben, weiter unten findet sich ein Kapitel über den Weg in Archaeen.
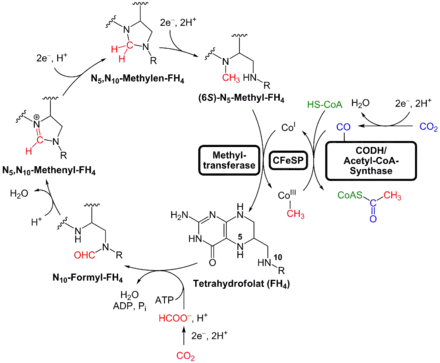
Methyl-Zweig
Ein Molekül CO2 wird durch eine Formiatdehydrogenase (EC 1.2.1.43) unter Verbrauch von NADPH zu Ameisensäure reduziert, was unter physiologischen Bedingungen als Formiat (HCOO−) vorliegt. Die Dehydrogenase ist ein Wolfram- und Selenocystein-enthaltenes Enzym. Formiat kondensiert dann mit Tetrahydrofolat (TH4) zu N10-Formyl-FH4, dabei wird ein Molekül ATP benötigt. Diese Reaktion katalysiert eine 10-Formyl-THF-Synthetase (EC 6.3.4.3), ein Homotetramer in M. thermoacetica. N10-Formyl-FH4 wird durch mehrere Reduktionsschritte schließlich zu N5-Methyl-FH4 umgesetzt, dabei wird die Formylgruppe zu einer Methylgruppe reduziert. Diese Methylgruppe wird schließlich bei Na+-Acetogenen[7] durch eine Methyltransferase auf das Cobalt(I)-Atom eines organometallischen Methylcobamid (ein Vitamin-B12-Derivat) übertragen, eine prosthetische Gruppe des Corrinoid-Eisen-Schwefel-Proteins (CFeSP[8] oder auch CoFeSP). Damit die Methylgruppe von Tetrahydrofolat auf das Cobaltatom übertragen werden kann, muss sie erst aktiviert werden. Es wird vorgeschlagen, dass hierfür das Stickstoffatom an Position 5 von N5-Methyl-FH4 protoniert wird.[9]
CFeSP lagert sich dann an den Acetyl-CoA-Synthese-Komplex an und kann damit die Methylgruppe für die folgende Kondensation einspeisen.
Carbonyl-Zweig
Das zweite Molekül CO2 wird durch eine CO-Dehydrogenase zu Kohlenmonoxid reduziert, was enzymgebunden am Acetyl-CoA-Synthese-Komplex verbleibt. Falls die Mikroorganismen auf CO wachsen, kann dieses auch direkt gebunden werden. Die CODH ist ein Nickel enthaltendes Eisen-Schwefel-Protein. Der Acetyl-CoA-Synthese-Komplex katalysiert schließlich die Kondensation des Methylrestes, des Carbonylrestes und von Coenzym A zu Acetyl-CoA:
Stoffwechselweg in Archaeen
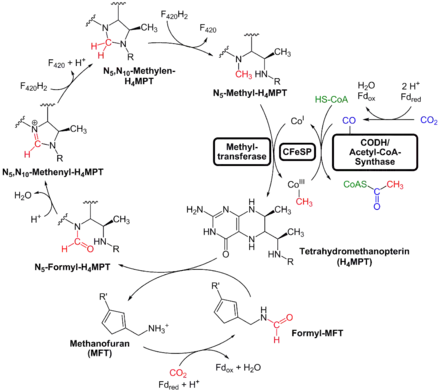
Der reduktive Acetyl-CoA-Weg in Archaeen entspricht weitgehend dem in Bakterien. Es gibt jedoch ein paar Unterschiede (vgl. auch rechtes Bild).
So wird in Archaeen im Methyl-Zweig Kohlenstoffdioxid reduktiv an Methanofuran gebunden, dabei wird Ferredoxin oxidiert und es entsteht Formylmethanofuran. Formylmethanofuran gibt die Formylgruppe an Tetrahydromethanopterin ab, was an Stelle von Tetrahydrofolat verwendet wird. Dabei entsteht Formyltetrahydromethanopterin (Formyl-H4MPT), was die Formylgruppe am N-5 statt N-10 wie beim Tetrahydrofolat gebunden hat. Im Gegensatz zu Weg in Bakterien wird also kein ATP benötigt. Die Reduzierung dieser Formylgruppe verläuft analog wie bei Bakterien, die Elektronen stammen aus dem Cofaktor F420.
Auch für die Reduzierung von Kohlenstoffdioxid nutzt die CO-Dehydrogenase die Reduktionskraft des Cofaktors F420.
Bedeutung
Bei dieser Art der CO2-Fixierung handelt es sich vermutlich um die älteste und wurde bereits eine Milliarde Jahre vor der ersten Sauerstoffbildung betrieben.[3] Das gebildete Acetyl-CoA wird zum Aufbau von Zellbestandteilen zu Triosephosphat weiter umgesetzt. Hierbei wird ein weiteres Molekül CO2 fixiert, was eine Ferredoxin-abhängige Pyruvatsynthase katalysiert. Dieses wird schließlich unter Verbrauch von drei Molekülen ATP zu Triosephosphat umgesetzt.
Insgesamt werden für den Aufbau von einem Molekül Triosephosphat vier Moleküle ATP verbraucht. Damit ist der reduktive Acetyl-CoA-Weg energetisch gesehen der günstigste Weg zur Kohlendioxidfixierung. Jedoch benötigt er viele Coenzyme und viele seltene Metalle (Fe, Co, Ni, Mo oder W).
Der Weg kann aber auch, wie bei homoacetogenen Bakterien, zur Energiegewinnung genutzt werden (Homoacetatgärung). Dadurch wird ein Molekül Glucose zu drei Molekülen Acetat abgebaut. Hierbei wird Glucose in der Glykolyse zu zwei Molekülen Pyruvat umgesetzt. Diese werden durch eine Pyruvat-Ferredoxin-Oxidoreduktase zu zwei Molekülen Acetyl-CoA oxidativ decarboxyliert. Die energiereiche Thioesterbindung in Acetyl-CoA wird ausgenutzt, um ATP durch Substratkettenphosphorylierung zu generieren (über Acetylphosphat[10]). Infolgedessen entstehen neben Acetat auch Reduktionsäquivalente und CO2. Letztere können dann im reduktiven Acetyl-CoA-Weg zu Acetat umgesetzt werden.
Es wird auch ein Protonengradient (z. B. bei M. thermoacetica) über der Membran aufgebaut. Dieser wird von einer ATPase zur weiteren protonengetriebenen ATP-Synthese genutzt. Manche Acetogene, beispielsweise Acetobacterium woodii oder Propionigenium modestum, translozieren Natriumionen statt Protonen. Sie besitzen dementsprechend eine Natriumionen-abhängige ATP-Synthase.
Umkehrbarkeit des Weges
Der Stoffwechselweg kann in beide Richtungen ablaufen. Entweder können – wie oben geschildert – aus C1-Verbindungen Acetat erzeugt werden. Manche Mikroorganismen können jedoch durch ihn auch auf Acetat wachsen, da dieses im Wood-Ljungdahl-Weg zu zwei Molekülen CO2 abgebaut wird, teilweise ersetzt diese Totaloxidation von Acetat zu Kohlenstoffdioxid sogar den Krebs-Zyklus.[11]
Die reversible Maschinerie des Stoffwechselweg wird auch in der Methanogenese bei C1-Verbindungen genutzt, wodurch sowohl Kohlenstoffdioxid als auch Methan erzeugt werden.
Literatur
- H. L. Drake u. a.: Old acetogens, new light. In: Ann NY Acad Sci. Band 1125, 2008, S. 100–128; doi:10.1196/annals.1419.016. PMID 18378590.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008, ISBN 978-3-13-144861-3, S. 413.
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. 8. Auflage. Thieme Verlag, Stuttgart 2007, ISBN 978-3-13-444608-1, S. 248f.
- Wolfgang Fritsche: Mikrobiologie. 3. Auflage. Spektrum Akademischer Verlag, 2001, ISBN 3-8274-1107-6, S. 251ff.
- S. W. Ragsdale, E. Pierce: Acetogenesis and the Wood-Ljungdahl pathway of CO(2) fixation. In: Biochim Biophys Acta. Band 1784, Nr. 12, 2008, S. 1873–1898. PMID 18801467; PMC 2646786 (freier Volltext)
- S. W. Ragsdale: Life with carbon monoxide. In: Crit Rev Biochem Mol Biol. Band 39, Nr. 3, 2004, S. 165–195. PMID 15596550; PDF (freier Volltextzugriff, engl.)
Einzelnachweise
- M. thermoacetica bei KEGG; 1994 erfolgte Umbenennung von Clostridium thermoaceticum
- I. A. Berg u. a.: Study of the distribution of autotrophic CO2 fixation cycles in Crenarchaeota. In: Microbiology. Band 156, Pt 1, 2010, S. 256–269. PMID 19850614; doi:10.1099/mic.0.034298-0
- S. W. Ragsdale: Life with carbon monoxide. In: Crit Rev Biochem Mol Biol. Band 39, Nr. 3, 2004, S. 165–195. PMID 15596550; PDF (freier Volltextzugriff, engl.)
- Wolfgang Fritsche: Mikrobiologie. 3. Auflage. Spektrum Akademischer Verlag, 2001, ISBN 3-8274-1107-6, S. 252.
- S. W. Ragsdale: The eastern and western branches of the Wood/Ljungdahl pathway: how the east and west were won. In: Biofactors. Band 6, Nr. 1, 1997, S. 3–11. PMID 9233535
- G. Borrel, P. S. Adam, S. Gribaldo: Methanogenesis and the Wood-Ljungdahl Pathway: An Ancient, Versatile, and Fragile Association. In: Genome Biol Evol. Band 8, Nr. 6, 13. Jun 2016, S. 1706–1711. doi:10.1093/gbe/evw114 PMID 27189979
- W. Martin, M. J. Russell: On the origin of biochemistry at an alkaline hydrothermal vent. In: Philos Trans R Soc Lond B Biol Sci. Band 362, Nr. 1486, 2007, S. 1887–1925. PMID 17255002; PMC 2442388 (freier Volltext).
- S. I. Hu u. a.: Acetate synthesis from carbon monoxide by Clostridium thermoaceticum. Purification of the corrinoid protein. In: J Biol Chem. Band 259, Nr. 14, 1984, S. 8892–8897. PMID 6746629; PDF (freier Volltextzugriff, engl.)
- S. W. Ragsdale: Enzymology of the wood-Ljungdahl pathway of acetogenesis. In: Ann NY Acad Sci. Band 1125, 2008, S. 129–136; doi:10.1196/annals.1419.015. PMID 1837859.
- Acetylphosphat, Lexikon der Biologie; Acetylphosphat, Lexikon der Chemie. Auf spektrum.de.
- Georg Fuchs: Alternative pathways of carbon dioxide fixation: insights into the early evolution of life? In: Annu Rev Microbiol. Band 65, 2011, S. 631–658. doi:10.1146/annurev-micro-090110-102801. PMID 21740227