Säurehalogenide
Säurehalogenide sind eine Stoffgruppe in der Chemie. Man unterscheidet dabei zwischen den Derivaten der Carbonsäuren (Carbonsäurehalogenide) und Sulfonsäuren (Sulfonsäurehalogenide), die der organische Chemie zugerechnet werden, und den Derivaten anorganischer Sauerstoffsäuren.
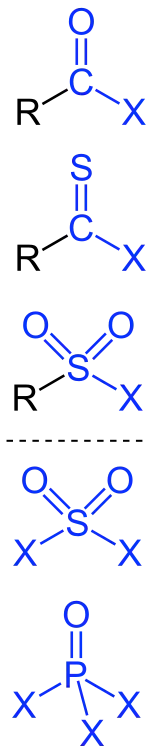
Säurehalogenide haben meist einen tieferen Siedepunkt als die entsprechenden Säuren, sie sind oft recht reaktionsfähig und werden durch Wasser meist rasch zersetzt.[1] Die Säurehalogenide langkettiger Fettsäuren sind jedoch bei 20 °C fest, während die Säuren flüssig sind.[2]
Derivate von Carbonsäuren, Thiocarbonsäuren und Sulfonsäuren
Wenn in Carbonsäuren, Thiocarbonsäuren oder Sulfonsäuren eine Hydroxygruppe durch ein Halogenatom ersetzt wird, resultieren Carbonsäure-, Thiocarbonsäure- bzw. Sulfonsäurehalogenide. Besonders wichtig sind die Carbonsäurehalogenide. Dabei unterscheidet man zwischen Carbonsäurefluoriden, Carbonsäurechloriden, Carbonsäurebromiden und Carbonsäureiodiden. Unter den Carbonsäurehalogeniden besitzen die Carbonsäurechloride als reaktive Edukte oder Zwischenprodukte in organischen Synthesen besondere Bedeutung, beispielsweise Acetylchlorid oder Benzoylchlorid. Sulfonsäurehalogenide (besonders Sulfonsäurechloride) werden in organischen Synthese benutzt, um bei der nucleophilen Substitution aus einer schlechten Hydroxid-Abgangsgruppe eine gute Abgangsgruppe (Mesylat, Tosylat) zu bilden.
Darstellung der Carbonsäurehalogenide
Zur Darstellung eines Carbonsäurechlorids setzt man eine Carbonsäure mit Thionylchlorid, Phosphorpentachlorid, Phosphoroxidchlorid oder Phosphortrichlorid um. Die analogen Carbonsäurefluoride, -bromide und -iodide erhält man durch Umsetzung der Carbonsäure mit Thionylhalogeniden SOX2 (X = F, Br, I).[2]
Derivate anorganischer Sauerstoffsäuren
Wenn in anorganischen Sauerstoffsäuren (Beispiele: Schwefelsäure, Phosphorsäure, Kieselsäure) ein Hydroxy-Rest formal durch ein Halogen ersetzt ist, resultieren Säurehalogenide dieser Sauerstoffsäuren. Wichtige anorganische Säurehalogenide sind Siliziumtetrafluorid (Tetrafluorid der Kieselsäure, SiF4), Sulfurylchlorid (das Dichlorid der Schwefelsäure, SO2Cl2), Thionylchlorid (Dichlorid der Schwefligen Säure, SOCl2), Chlorsulfonsäure (Monochlorid der Schwefelsäure, HSO3Cl), Phosgen (Dichlorid der Kohlensäure, COCl2), Phosphoroxidchlorid (Trichlorid der Phosphorsäure, POCl3), Nitrosylchlorid (Chlorid der salpetrigen Säure, NOCl), Phosphortribromid (Tribromid der phosphorigen Säure, PBr3).
Darstellung der Halogenide anorganischer Sauerstoffsäuren
Die anorganischen Säurehalogenide werden meist durch spezifische Verfahren hergestellt, z. B. entsteht Phosphortribromid durch die Einwirkung von elementarem Brom auf roten Phosphor.[2]
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 5: Pl–S. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1987, ISBN 3-440-04515-3, S. 3655–3656.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1236.