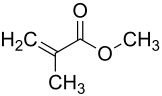
Methacrylsäuremethylester
Methacrylsäuremethylester (Methylmethacrylat, MMA) ist eine farblose Flüssigkeit mit unangenehm esterartigem Geruch. MMA ist leicht entzündlich, verdunstet leicht und hat einen Siedepunkt von 101 °C. Mit Wasser gemischt, sinkt der Siedepunkt von MMA auf 83 °C zu einem azeotropen Gemisch. MMA hat die UN-Nummer 1247.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methacrylsäuremethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H8O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 100,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,94 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
101 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (15 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,414 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Herstellung
MMA wird vor allem aus Acetoncyanhydrin hergestellt, das mit Schwefelsäure zu Methacrylsäureamid umgesetzt und anschließend verestert wird.[6] Acetoncyanhydrin wird aus Aceton und Cyanwasserstoff hergestellt.
Methacrylsäuremethylester kann technisch auch durch zweistufige Oxidation von Isobuten und ohne Verwendung von Cyanwasserstoff hergestellt werden. Dieses sogenannte C4-Verfahren wird jedoch seltener angewandt. Isobuten selbst wird durch Dehydratisierung von tert-Butanol oder durch Spaltung von Methyl-tert-butylether (MTBE) hergestellt, beide Verfahren verlaufen in der Gasphase, werden üblicherweise durch heterogene Kontakte katalysiert und ergeben eine gute Ausbeute an Isobuten. Die erste Stufe der Oxidation verläuft zum Methacrolein, die eingesetzten Katalysatoren ähneln bzw. leiten sich ab von den Kontakten, die auch für die Propenoxidation zum Acrolein eingesetzt werden.
Methacrylsäuremethylester wird zur Vermeidung von spontaner Polymerisation nach der Herstellung stabilisiert.
Alpha-Verfahren
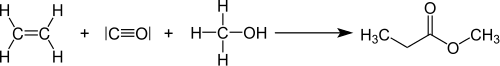
Ein neueres Verfahren, das erst 2008 realisiert wurde, geht von Ethylen als Rohstoff aus, das homogen katalysiert mit Kohlenmonoxid und Methanol in einem Schritt carboxymethyliert wird, es entsteht extrem effizient mit einer hohen Wechselzahl (TOF) und Turnover Number (TON, Maß für die Effizienz eines Katalysators, bevor er sich durch Nebenreaktionen oder andere Effekte verbraucht) Propionsäuremethylester als Zwischenprodukt. Propionsäuremethylester wird im nächsten Schritt in der Gasphase an einem speziellen Kontakt mit Formaldehyd aldolisiert und dehydratisiert, wobei direkt MMA entsteht. Das Verfahren wurde ursprünglich von ICI entwickelt, dann durch Lucite International zur technischen Reife gebracht und schließlich von MRC-Lucite in Singapur eine Produktionsanlage mit einer Jahreskapazität von 120.000 Tonnen gebaut. Das Verfahren wird in der Literatur als Alpha-Verfahren oder Alpha-Prozess bezeichnet.[7]
Hydroveresterung von Ethylen mit Kohlenmonoxid und Methanol zu Propionsäuremethylester (Methylpropionat):
Kondensation von Propionsäuremethylester und Formaldehyd zu Methacrylsäuremethylester und Wasser:
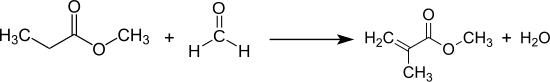
Ein von Lucite (heute MRC-Lucite) als β-Verfahren bezeichneter noch nicht umgesetzter Prozess geht von Propin als Edukt aus. Durch eine dem Alpha-Prozess ähnliche katalytische Umsetzung von Propin mit Methanol und Kohlenmonoxid wird direkt einstufig zum MMA umgesetzt. Der Prozess wurde trotz hoher katalytischer Effizienz noch nicht eingesetzt, da Propin kein gängiger, gehandelter petrochemischer Rohstoff und wenig verfügbar ist.
LiMA-Verfahren
Den neuesten Entwicklungsschritt stellt das LiMA („Leading in Methacrylates“)-Verfahren dar, mit dem Evonik Industries 2017 an die Öffentlichkeit trat.[8][9]
Wie der Alpha-Prozess ist auch das LiMA-Verfahren ein auf dem Rohstoff Ethylen basierender C2-Prozess, wobei das Ethylen in einer Oxosynthese mit Synthesegas an einem Rhodium-Kontakt zu Propionaldehyd hydroformyliert wird.
Im ersten Schritt (A) des LiMA-Verfahrens wird Propionaldehyd mit Formalin HCHO in einer Mannich-Reaktion mit Dimethylamin / Essigsäure-Katalysatorgemisch zu Methacrolein umgesetzt.[10]
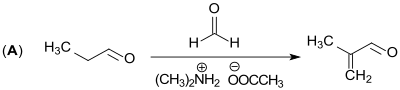
Der Umsatz der Einsatzstoffe ist praktisch quantitativ, die Selektivität zu Methacrolein beträgt über 98 %.
Im zweiten Schritt (B) reagiert Methacrolein mit Luftsauerstoff und Methanol an einem Nickel-Gold-Kontakt bei niedriger Temperatur (ca. 90 °C) und Druck (ca. 6 bar) zu Methylmethacrylat bei Methacroleinumsätzen von ca. 70 % und MMA-Selektivitäten > 95 %.
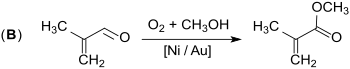
Das Verfahren ist bisher nur im Pilotmaßstab erprobt, soll aber kostengünstiger und umweltverträglicher als der Alpha-Prozess sein.[11]
Eigenschaften
Physikalische Eigenschaften
Methacrylsäuremethylester ist eine farblose Flüssigkeit mit einem Schmelzpunkt von −48,2 °C und bei Normaldruck einem Siedepunkt von 101 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,37785, B = 1945,56 und C = −7,569 im Temperaturbereich von 312,4 bis 362,3 K.[12] Wichtige thermodynamische Größen werden in der folgenden Tabelle gegeben:
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−388,8 kJ·mol−1[13] −348,7 kJ·mol−1[13] |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −2724,6 kJ·mol−1[13] | als Flüssigkeit |
| Wärmekapazität | cp | 215,3 J·mol−1·K−1 (25 °C)[14][15] 2,15 J·g−1·K−1 (25 °C) |
als Flüssigkeit |
| Schmelzenthalpie | ΔfH | 13,451 kJ·mol−1[16] | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH | 33,3 kJ·mol−1[17] | beim Normaldrucksiedepunkt |
Chemische Eigenschaften
Methacrylsäuremethylester kann, besonders wenn er Verunreinigungen enthält, spontan polymerisieren. Hierbei kommt es aufgrund des Trommsdorff-Effekts zu einem sprunghaften Temperaturanstieg, der mit einem Druckanstieg einhergeht. Diese Polymerisation kann gezielt durch die Zugabe von Initiatoren, meist Peroxiden, gestartet werden. Die Polymerisationswärme beträgt −59 kJ·mol−1 bzw. –590 kJ·kg−1.[18]
Sicherheitstechnische Kenngrößen
Methacrylsäuremethylester bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 10 °C.[2][19] Der Explosionsbereich liegt zwischen 1,7 Vol.‑% (70 g/m3) als untere Explosionsgrenze (UEG) und 12,5 Vol.‑% (520 g/m3) als obere Explosionsgrenze (OEG).[2][19] Der maximale Explosionsdruck beträgt 8,6 bar.[2] Die Grenzspaltweite wurde mit 0,95 mm bestimmt.[2] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[2][19] Die Zündtemperatur beträgt 430 °C.[2][19] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Methacrylsäuremethylester wird vornehmlich zur Herstellung von Acrylglas verwendet. Weiterhin ist MMA, in der Regel, der Hauptbestandteil jeder Dentalprothese aus Kunststoff. Dabei wird flüssiges MMA mit granuliertem PMMA (Polymethylmethacrylat) zu einem zähflüssigen Teig vermischt und ausgehärtet (polymerisiert). Es findet aber ebenso bei der Herstellung von Knochenzement für die Einzementierung von Kunstgelenken, in der Lackherstellung und als Zweikomponentenklebstoff (Methylmethacrylatklebstoff) Anwendung.
Risikobewertung
Methacrylsäuremethylester wurde 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Methacrylsäuremethylester waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition empfindlicher Bevölkerungsgruppen, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der vermuteten Gefahren durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2014 statt und wurde von Frankreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[20][21]
Einzelnachweise
- Eintrag zu METHYL METHACRYLATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu CAS-Nr. 80-62-6 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. März 2017. (JavaScript erforderlich)
- Datenblatt Methyl methacrylate bei Sigma-Aldrich, abgerufen am 10. April 2011 (PDF).
- Eintrag zu Methyl methacrylate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 80-62-6 bzw. Methacrylsäuremethylester), abgerufen am 2. November 2015.
- Eintrag zu Methacrylsäureester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. September 2014.
- Mark W. Hooper: Considerations of Industrial Fine Chemical Synthesis. In: S. M. Roberts, J. Xiao, J. Whittall, T. Pickett (Hrsg.): Catalysts for Fine Chemical Synthesis. Vol. 3: Metal Catalysed Carbon-Carbon Bond-Forming Reactions. John Wiley & Sons, 2004, ISBN 0-470-86199-1. (PDF)
- Klassenbester: Evonik entwickelt effizientestes Verfahren zur Herstellung von Methylmethacrylat. In: Pressemitteilung Evonik. Evonik, 5. Oktober 2017, abgerufen am 10. Juni 2020.
- How we develop the best process for methyl methacrylate. In: Präsentation Steffen Krill. Evonik, 5. Oktober 2017, abgerufen am 10. Juni 2020.
- Patent WO2014170223A1: Verfahren zur Herstellung von Methylmethacrylat. Angemeldet am 11. April 2014, veröffentlicht am 23. Oktober 2014, Anmelder: Evonik Industries AG, Erfinder: S. Krill, T. Balduf, M. Köstner, M. Grömping, A. Lygin, R. Burghardt.
- Methyl Methacrylate (MMA) Production by Evonik LiMA™ Process. In: PEP Review. IHS Markit, Mai 2018, abgerufen am 10. Juni 2020.
- Von A. Brockhaus, Jenckel, E.: Über die Kinetik des thermischen Abbaues von Polymethacrylsäuremethylester. In: Makromol. Chem. 18, 1956, S. 262–293, doi:10.1002/macp.1956.020180124.
- R. Vilcu, S. Perisanu: The ideal gas state enthalpies of formation of some monomers. In: Rev. Roum. Chim. 25, 1980, S. 619–624.
- M. Karabaev, T. P. Abduzhaminov, A. A. Saidov, Kh. T. Igamberdyev: Thermophysical properties of liquid methacrylic acid and its simple esters. In: Izv. Akad. Nauk Uzb. SSR Ser. Fiz.-Mat. Nauk. 4, 1985, S. 71–74.
- M. Karabaev, A. A. Saidov, T. P. Abduzhaminov, M. M. Kenisarin: Heat capacity and molecular kinetic processes of condensed phase acrylates and methacrylates. In: Izv. Akad. Nauk UzSSR, Ser. Fiz.-Math. 6, 1985, S. 51–54.
- M. K. Karabaev, T. P. Abduzhaminov, M. M. Kenisarin, A. A. Saidov: Thermodynamics of the crystal-liquid phase transition in acrylates and methacrylates. In: Izv. Akad. Nauk Uzb. SSR, Ser. Fiz.-Mat. Nauk. 5, 1985, S. 74–77.
- W. V. Steele, R. D. Chirico, A. B. Cowell, S. E. Knipmeyer, A. Nguyen: Thermodynamic Properties and Ideal-Gas Enthalpies of Formation for trans -Methyl Cinnamate, α-Methyl Cinnamaldehyde, Methyl Methacrylate, 1-Nonyne, Trimethylacetic Acid, Trimethylacetic Anhydride, and Ethyl Trimethyl Acetate. In: J. Chem. Eng. Data. 47, 2002, S. 700–714, doi:10.1021/je010086r.
- Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 008 Polyreaktionen und polymerisationsfähige Systeme. Ausgabe 05/2015, ISBN 978-3-86825-069-5, S. 26.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen: Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Methyl methacrylate, abgerufen am 26. März 2019.

