Netzhaut
Die Netzhaut oder Retina (von lateinisch rete ‚Netz‘[1]), auch Innere Augenhaut (Tunica interna bulbi) genannt, ist das mehrschichtige spezialisierte Nervengewebe, das die Innenseite der Augenwand bei Wirbeltieren sowie einigen Tintenfischen und Schnecken auskleidet. Im optischen Teil der Netzhaut wird das einfallende Licht – nachdem es die Hornhaut, die Linse und den Glaskörper durchquert hat – in Nervenimpulse umgewandelt. Dem abdunkelnden retinalen Pigmentepithel liegt von innen die Schicht der lichtempfindlichen Sinneszellen (Fotorezeptoren) an. Deren Impulse werden in weiteren, nach innen folgenden Netzhautschichten von Nervenzellen verarbeitet und weitergeleitet. Daneben enthält die Retina verschiedene unterstützende und versorgende Strukturen.
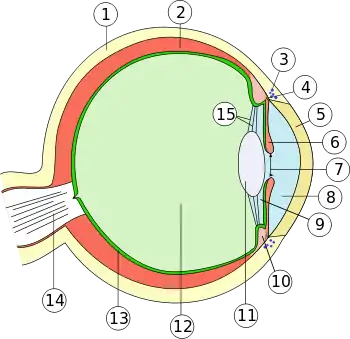
1. Lederhaut (Sclera)
2. Aderhaut (Choroidea)
3. Schlemm-Kanal (Sinus venosus sclerae)
4. Arterieller Gefäßring (Circulus arteriosus iridis major)
5. Hornhaut (Cornea)
6. Regenbogenhaut (Iris)
7. Pupille (Pupilla)
8. vordere Augenkammer (Camera anterior bulbi)
9. hintere Augenkammer (Camera posterior bulbi)
10. Ziliarkörper (Corpus ciliare)
11. Linse (Lens)
12. Glaskörper (Corpus vitreum)
13. Netzhaut (Retina) und Pigmentepithel
14. Sehnerv (Nervus opticus)
15. Zonulafasern (Fibrae zonulares)
Äußere Augenhaut (Tunica externa bulbi): 1. + 5.
Mittlere Augenhaut (Tunica media bulbi): 2. + 6. + 10.
Innere Augenhaut (Tunica interna bulbi): 13.
Vereinfacht ausgedrückt wird die Netzhaut damit zu einer Art Projektionsfläche für die Abbildung unserer Umgebung, ähnlich einer Leinwand oder einem lichtempfindlichen Film, und leitet die durch Lichtreize hervorgerufenen Erregungen weiter an Hirnregionen.
Die Struktur der Netzhaut hatte im 19. Jahrhundert der britische Anatom und Augenarzt William Bowman erkannt.[2]
Anatomie der Netzhaut des Menschen
Richtungs- und Lagebezeichnungen
Die Schichten der Netzhaut betreffend bezeichnet man als außen die Seite der Netzhaut, die näher zur Außenwand des Augapfels liegt. Als innen wird entsprechend die näher zur Augapfelmitte liegende Seite bezeichnet. Das durch die Pupille in den Augapfel eingefallene Licht erreicht also zunächst die inneren Netzhautschichten, und dann erst die äußeren; die äußerste Schicht der Netzhaut wird von einer Lage dunkel pigmentierter Zellen gebildet, dem retinalen Pigmentepithel.
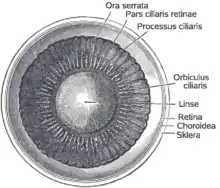
Als vorn, anterior oder distal, bezeichnet man die Netzhautanteile, die den Strukturen des vorderen Augenabschnitts, der Iris und der Linse, nahe sind. Hinten, posterior oder proximal, heißen somit Netzhautanteile an jener der Linse gegenüber liegenden Augapfelwand. Für die Angabe von Richtungen in der Querachse werden die Ausdrücke nasenseitig (nasal) und schläfenseitig (temporal) gebraucht.
Abschnitte und Grenzen
Den weitaus größten Teil der Innenfläche des Augapfels bildet die Pars optica retinae genannte Neuroretina, welche die Fotorezeptoren trägt. Nach vorne zu ist sie etwa 3 mm hinter dem Ziliarkörper (Corpus ciliare) mit einer zackenförmigen Grenze, der Ora serrata, von der Pars caeca retinae (lat. caecus ‚blind‘) abgesetzt, die ganz vorn als Pars ciliaris retinae den Ziliarkörper überzieht. Die vorderen Netzhautabschnitte können am intakten Auge bei der Kontaktglasuntersuchung mit einem Dreispiegelkontaktglas betrachtet werden.
Der Netzhaut liegt außen die Aderhaut (Choroidea) auf, welche per Diffusion die äußeren Netzhautschichten mit Nährstoffen versorgt. Innen liegt der Netzhaut der Glaskörper (Corpus vitreum) an. Hinten geht die Netzhaut in der Sehnervenpapille in den Sehnerv (Nervus opticus) über, welcher die Nervenfasern der Ganglienzellschicht enthält.
Dem Schutz der Netzhaut dient die sogenannte Blut-Retina-Schranke.
Makroskopisches Bild der Netzhaut, Augenhintergrund
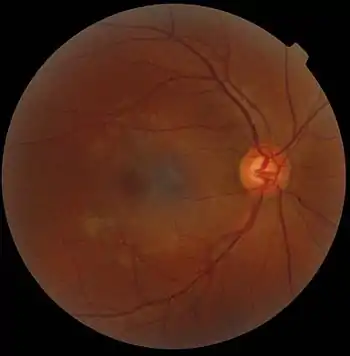
Zentral die Makula, rechts die Papille
Beim Blick auf den Augenhintergrund (Fundus oculi oder Fundus) durch die Pupille schaut man durch die farblose und durchsichtige Neuroretina hindurch auf das dunkel pigmentierte retinale Pigmentepithel (RPE) und die darunterliegende, typabhängig mehr oder weniger dunkel pigmentierte Aderhaut. Als auffällige Landmarke findet man etwa 15° nasal von der optischen Achse die Austrittsstelle des Sehnerven mit seiner Papille (Papilla nervi optici). Sie hebt sich durch ihre rosa bis hellrote Farbe vom übrigen Braunorange des Fundus ab. Die Papille hat einen Durchmesser von durchschnittlich etwa 1,5 mm und ist mit individuell unterschiedlich ausgeprägtem Rand rund oder oval geformt.
Der blinde Fleck
Als blinder Fleck wird im Gesichtsfeld die Stelle bezeichnet, auf die sich die Papille des Sehnerven projiziert (etwa 15° schläfenseitig vom Fixierpunkt). Dort, wo die Nervenfasern von Ganglienzellen der inneren Schicht zusammenlaufen und durch alle Netzhautschichten hindurchtretend den Augapfel verlassen, den Sehnerv bilden, befinden sich keine Lichtrezeptoren (siehe unten). Das Gebiet der Sehnervenpapille ist also wirklich lichtunempfindlich, „blind“.
Dass dieser „blinde“ Fleck auch bei einäugigem Sehen nicht wahrgenommen wird, liegt am sogenannten Ergänzungseffekt. Das visuelle System verwendet Informationen, die die Rezeptoren in der Umgebung der Papille liefern, um das Bild zu ergänzen.
Gefäße der Netzhaut, Macula lutea
Auch die großen Netzhautgefäße, Arteriola und Venola centralis retinae, die wesentlich zum okulären Blutfluss beitragen, passieren die Augapfelwand und treten im Zentrum der Papille durch. Sie verzweigen sich hier in ein oberes und ein unteres Büschel und teilen sich meist noch einmal in einen nasalen und einen schläfenseitigen Ast auf. An ihrer unterschiedlichen Rottönung und am Kaliber lassen sich die Arteriolen von den Venolen unterscheiden.
Die schläfenseitigen Gefäßzweige umrunden bogenförmig ein gefäßarmes und im Zentrum gefäßfreies Gebiet, das den gelben Fleck (Macula lutea) darstellt. Die gelbliche Färbung dieses im Durchmesser rund 3 mm großen Netzhautareals wird durch die hier eingelagerten Carotinoide Lutein und Zeaxanthin hervorgerufen. Diese filtern energiereiches (UV-)Licht und schützen die Netzhautzellen so vor photooxidativen Schäden. Inmitten der Macula lutea liegt eine seichte Vertiefung, die Fovea centralis, kurz Fovea oder Sehgrube genannt; um die Fovea centralis herum ist die Netzhaut zu einem flachen Wall verdickt. Diese Oberflächenform kommt durch Verlagerungen von Netzhautschichten zustande und kann bei Spiegelung des Augenhintergrundes an Lichtreflexen, dem sogenannten Wallreflex, erkannt werden.
Die Sehgrube im „gelben Fleck“ enthält die Stelle des schärfsten Sehens. Hier besitzt die Netzhaut die größte Auflösung, wie man sie etwa beim Lesen von Kleingedrucktem braucht. Die umgebende Netzhaut hat ein geringeres Auflösungsvermögen; diese peripheren Netzhautregionen dienen im Wesentlichen der Umfeldwahrnehmung, dem Erkennen von Dingen „aus den Augenwinkeln“, und sind die Grundlage des peripheren Gesichtsfeldes. Die zentrale Retina mit der Fovea centralis repräsentiert in der Foveola mit deren Mitte als motorischem Nullpunkt den Richtungswert geradeaus, auch Hauptsehrichtung genannt. Jeder periphere Netzhautpunkt besitzt ein anderes Richtungsempfinden, was zu entsprechend vielen Nebensehrichtungen führt.
Schwere Schädigungen der Macula lutea, z. B. durch die altersbedingte Makuladegeneration (AMD), können zu erheblichen Verlusten der Sehschärfe führen, sodass sie beispielsweise zum Lesen oder Autofahren nicht mehr ausreicht.
Nervenzellen der Netzhaut
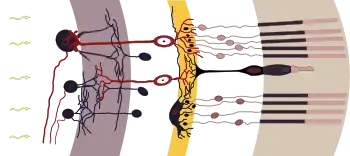
v. l. n. r.: weiß: Ganglienzellen und ihre Axone, grau: Innere plexiforme Schicht, weiß: Amakrine Zellen, Bipolare, Horizontalzellen, gelb: Äußere plexiforme Schicht, weiß: Fotorezeptoren, hellbraun: Fotorezeptoren Außensegmente
Ein Netzhautquerschnitt zeigt im Lichtmikroskop eine auffällige Schichtung, die durch abwechselnd zellkernreiche und -arme Lagen gebildet wird. Die Schichten besitzen charakteristische Zelltypen und subzelluläre Kompartimente. Die Nervenzellen der Netzhaut lassen sich in drei Gruppen gliedern:
- Die lichtempfindlichen oder fotorezeptiven Zellen, welche das eintreffende Licht in Nervenimpulse umwandeln. Dazu gehören die Stäbchen und Zapfen und eventuell weitere Zelltypen.
- Die zwischengeschalteten Zellen oder Interneurone, welche die erzeugten Impulse einer ersten Verarbeitung innerhalb der Netzhaut unterziehen. Dazu gehören die Horizontalzellen, die Bipolarzellen und die Amakrinen Zellen.
- Die Ganglienzellen, welche die verarbeiteten Informationen an die nächste Schaltstelle außerhalb der Netzhaut weiterleiten.
Als ein Ergebnis evolutionärer Entwicklung, nach der die Netzhaut aus einer Ausstülpung des Zwischenhirns gebildet wurde, ist sie invers aufgebaut, da sich die eigentlichen lichtempfindlichen Zellen in äußeren Schichten befinden, die am weitesten vom Licht entfernt liegen.[3][4]
Fotorezeptoren
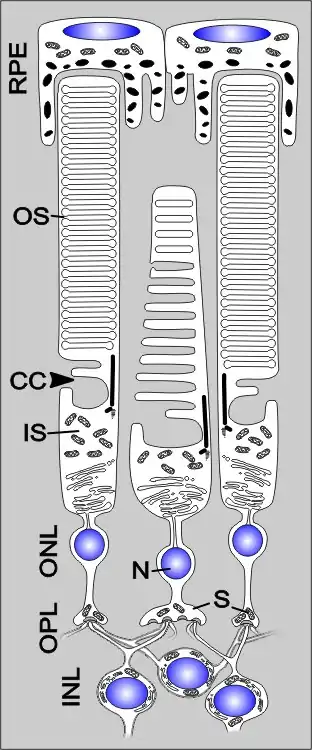
Den Fotorezeptorzellen kommt unter den Zellen der Netzhaut eine besondere Bedeutung zu, weil sie den eigentlich lichtempfindlichen Zelltyp darstellen. Die Fotorezeptorzellen sind hoch polare Zellen, welche aus einem Außensegment, einem Innensegment, dem Zellkörper und einem Axon mit einer komplexen Synapse bestehen. Grundsätzlich unterscheidet man in der Netzhaut der Wirbeltiere Fotorezeptorzellen nach ihrem Bau in zwei Arten, Stäbchen und Zapfen (englisch rods und cones), die mosaikförmig verteilt sind.[5] Die Stäbchenzellen dienen dem Sehen bei schwacher Beleuchtung (skotopisches Sehen), die Zapfenzellen, beim Menschen mit drei verschiedenen Typen vertreten, dem Farbsehen (photopisches Sehen). Im menschlichen Auge befinden sich etwa 120 Mio. Stäbchen und etwa 6 Mio. Zapfen, jedoch nicht gleichmäßig verteilt. Im Zentrum des Gelben Flecks (Macula lutea) liegt in der Sehgrube (Fovea centralis) der Bereich des schärfsten Sehens; hier sind die Zapfenzellen mit etwa 150.000 pro Quadratmillimeter besonders dicht gepackt, während Stäbchenzellen fehlen. Diese erreichen jedoch eine ähnlich hohe Dichte in einem ringförmigen Areal am Makularand; zur Netzhautperipherie hin nimmt ihre Anzahl ab bis auf etwa 35.000/mm², wobei Zapfen hier noch rund zehnmal seltener vorkommen. Ein dritter Typ von lichtempfindlichen Nervenzellen sind die fotosensitiven Ganglienzellen, die das lichtempfindliche Protein Melanopsin enthalten. Diese Zellen wirken bei der Synchronisation der inneren Uhr mit dem Tag-Nacht-Rhythmus, der Unterdrückung des Hormons Melatonin sowie bei der Steuerung der Pupillengröße mit.
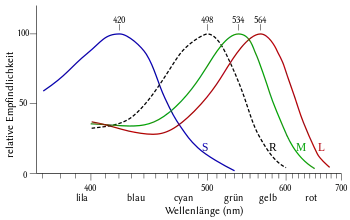
Menschen sind Trichromaten: Sie besitzen drei Zapfenarten mit unterschiedlichen Absorptionsmaxima. Vereinfacht kann man sagen, dass es rotempfindliche, grünempfindliche und blauempfindliche Zapfen gibt. Das Nervensystem kombiniert die Signale der drei Zapfenarten, um Licht einer bestimmten Spektralverteilung eine Farbe zuzuordnen. Die Zapfen sind weniger lichtempfindlich als die Stäbchen. Daher verändert sich das Farbempfinden bei Nacht, der sogenannte Purkinje-Effekt. Daher stimmt das Sprichwort: Nachts sind alle Katzen grau (zum Merken: mit den Stäbchen sieht man schwarz/weiß, mit den Zapfen Farben).
Schon ein einziges Lichtteilchen (Photon) kann ein Stäbchen aktivieren. Allerdings müssen mehrere Stäbchen aktiviert werden, damit die Netzhaut die Anwesenheit von Licht signalisiert. Beim Auftreffen eines Photons auf das in Membranstapel der Fotorezeptoren eingelagerte Sehpigment Rhodopsin erfährt letzteres eine Konformationsänderung. Dadurch wird eine Enzymkaskade ausgelöst, die sogenannte visuelle Signaltransduktionskaskade, die schließlich zur Aktivitätsänderung der Nervenzelle (Zapfen wie Stäbchen) führt. Für die Aufklärung der Bedeutung des Retinals 1933–1958 bekam der amerikanische Biochemiker George Wald 1967 den Nobelpreis für Medizin.
Möglicherweise gehört zu den Fotorezeptoren eine dritte Gruppe von Lichtsinneszellen; diese enthalten das Pigment Melanopsin. Dieser Zelltyp wurde erst vor kurzer Zeit entdeckt und ist noch relativ unerforscht. Es wurde nachgewiesen, dass die Melanopsin-Zellen als Fotorezeptoren wirken und bei der Funktion der „inneren Uhr“ eine wichtige Rolle spielen. Sie senden Signale an den (Nucleus suprachiasmaticus), in dem circadiane Rhythmen generiert und so Zeitinformationen an den Körper weitergegeben werden (siehe Chronobiologie). Nach neuen Erkenntnissen sind diese Ganglienzellen auch für den Pupillenreflex zuständig.
Horizontalzellen, Bipolarzellen, Amakrinzellen
Zwei unterschiedliche Typen von Horizontalzellen verschalten die Fotorezeptoren untereinander. Sie stehen selbst mit Nachbarzellen über Gap-Junction in Kontakt. Horizontalzellen dienen u. a. zur Kontrastverstärkung durch laterale Inhibition benachbarter Fotorezeptoren.
Die Bipolarzellen werden durch die Fotorezeptoren innerviert. In der Säugetierretina unterscheidet man je nach Tierart acht bis zwölf Typen von Bipolarzellen, die Zapfen kontaktieren (Zapfen-Bipolarzellen), und einen Bipolarzelltyp, der Stäbchen kontaktiert (Stäbchen-Bipolarzellen). Dabei unterscheidet man zwischen ON- und OFF-Bipolarzellen. ON-Bipolarzellen depolarisieren auf einen Lichtreiz, wobei OFF-Zellen mit einer Hyperpolarisation reagieren.
Die Bipolarzellen innervieren die Amakrinzellen. Amakrinzellen sorgen – ähnlich wie zuvor die Horizontalzellen – für eine sowohl laterale als auch vertikale Verschaltung des neuronalen Netzwerks in dieser Schicht der Netzhaut und tragen ebenfalls zur Modulation der Signalverarbeitung bei. Insgesamt gibt es über 30 verschiedene Amakrinzelltypen. Ein Typ, die sogenannte A2-Amakrinzelle, leitet Signale von Stäbchen-Bipolarzellen an die Zapfen-Bipolarzellen weiter und koppelt damit diese beiden Signalpfade. Ein anderer Typ der Amakrinzellen, die sogenannte Starburst-Zelle, ist am Bewegungssehen beteiligt.[6]
Ganglienzellen
Den Bipolar- und Amakrinzellen nachgeschaltet sind die Ganglienzellen. Sie sind die Ausgangsneurone der Netzhaut und leiten die visuelle Information über den Sehnerv (Nervus opticus) weiter zur nächsten Schaltstation im Gehirn, dem Corpus geniculatum laterale. Insgesamt lassen sich mindestens 30 Ganglienzelltypen unterscheiden.[7]
Schichten der Netzhaut
Das durch die Pupille einfallende Licht durchdringt Linse und Glaskörper als transparente Medien und passiert dann mehrere Schichten der Netzhaut, bevor es von den Photorezeptorzellen des Neuroepithels detektiert wird, die dem außen anliegenden Pigmentepithel zugewandt sind. Vom Glaskörper her zur Aderhaut hin, also bezogen auf das Auge von innen nach außen, zeigt die lichtempfindliche Netzhaut einen schichtartigen Aufbau aus Zellkörpern im Wechsel mit Zellfortsätzen. Hierbei lassen sich meist zehn Schichten unterscheiden, im Bereich der Sehgrube des Gelben Flecks sind einige seitwärts verlagert.
Epiretinale Membran (ERM) oder innere Grenzmembran
Die innere Grenzmembran (Membrana limitans interna), englisch epiretinal membrane (ERM) oder internal limiting membrane (ILM) genannt, setzt die Retina vom Glaskörper ab. Diese innere Begrenzung der Netzhaut wird von der Basalmembran und der Plasmamembran der Müllerschen Zellen sowie möglicherweise anderer Gliazellen gebildet. Darüber hinaus besteht sie aus Kollagenfasern und Proteoglykosiden. Die im Lichtmikroskop homogen erscheinende Schicht bedeckt die gesamte Retina und geht vorne mit einer etwas vergröberten Struktur in die Zonulalamelle über.
Die älteren Histologen waren der Ansicht, dass die pinselartigen Endfüße der Müllerschen Stützfasern fest in der Grenzmembran verankert sind, letztere also als gliöses Produkt zu werten ist. Das Elektronenmikroskop konnte jedoch zeigen, dass die innere Grenzmembran den Charakter einer Basalmembran hat und von den Fußpunkten der Müllerschen Zellen klar abgegrenzt werden kann. Die klinisch nachweisbare starke Haftung der Membran an der Retina kommt wahrscheinlich durch die mit Kittsubstanz gefüllte Zwischenschicht zustande, welche die Gliafortsätze der Müllerschen Zellen mit der Grenzmembran verbindet.
Die innere Grenzmembran wird auch als periphere Verdichtung des Glaskörpergewebes aufgefasst, da sich ihre Faserlamellen schichtweise von der Retina abheben und in die Glaskörpermembran übergehen. Die Dicke der Grenzmembran beträgt ca. 2–3 µm.
Nervenfaserschicht
Die Nervenfaserschicht (Stratum neurofibrarum), englisch nerve fiber layer (NFL), besteht aus Nervenfasern mit den Axonen der Ganglienzellen und nimmt zum Blinden Fleck hin an Dicke zu. Sie leiten jeweils die Signale einer retinalen Ganglienzelle mit der aufgearbeiteten Information von Photorezeptoren eines umschriebenen Netzhautareals zu verschiedenen Gehirnregionen. Die Nervenfaserschicht eines Auges enthält beim Menschen etwa 1 Million Ganglienzellaxone. Bei ihm sind diese Nervenfasern marklos und erhalten ihre Myelinscheiden erst mit dem Austritt aus dem Bulbus am Discus nervi optici, der Sehnervenpapille. Zerstörungen eines Anteils der Nervenfaserschicht, beispielsweise durch eine Druckschädigung bei Grünem Star, haben hinsichtlich des betroffenen Netzhautgebiets eine irreparable Erblindung zur Folge.
In der Foveola der Sehgrube (Fovea centralis) ist die Nervenfaserschicht am geringsten, da sie seitwärts verlagert ist. Vom Wall der Sehgrube gehen Axone zunächst sternförmig aus und ziehen dann in einem mehr oder weniger ausgeprägten Bogen zur Austrittsstelle des Sehnervs (Papille). Zwischen Fovea und Papille laufen sie zusammen und bilden so das makulopapilläre Bündel. Alle übrigen Ganglienzellaxone laufen um dieses Bündel entweder oben oder unten bogenförmig herum. Hierbei überschreiten sie nie die horizontale Mittellinie (Rhaphe).
Die Nervenfasern der vorderen Netzhaut, deren Ganglienzellkörper am weitesten von der Papille entfernt liegen, verlaufen am weitesten außen in der Faserschicht. So bleiben sie, wenn sie zur Papille ziehen, außen und nehmen deshalb auch eine mehr periphere Position im Sehnerv ein. Die Axone der Ganglienzellen, die dichter an der Papille liegen, verlaufen in der NFL oberflächennäher, dadurch kommen sie im Sehnerv auch eher zentral zu liegen.
Auch zentrifugale Fasern – vom Gehirn zur Retina – sind verschiedentlich in der Nervenfaserschicht beschrieben worden. Ihre Funktion und Bedeutung ist jedoch ungewiss. Einige Autoren ordnen ihnen Hemmfunktionen im Sehakt zu, andere bringen sie in Verbindung mit der Gefäßinnervation des retinalen Gefäßnetzes.
In der Nervenfaserschicht und der angrenzenden Ganglienzellschicht verlaufen auch die Aufzweigungen der zentralen Blutgefäße der Retina. Daneben sind in dieser Schicht auch Neurogliazellen vorhanden und versprengte Ganglienzellen zu finden. Die Dicke der Nervenfaserschicht beträgt ca. 20–30 µm.
Ganglienzellschicht
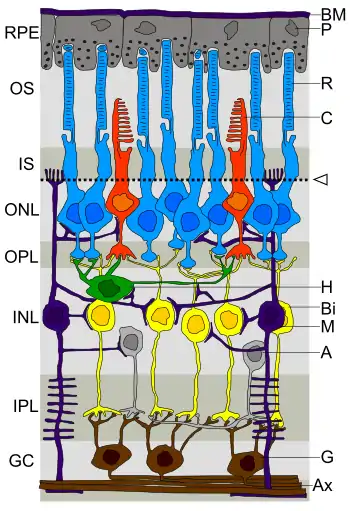
Legende linkerseits:
RPE retinales Pigmentepithel
OS Außensegmente der Photorezeptorzellen
IS Innensegmente der Photorezeptorzellen
ONL äußere nukleäre Schicht
OPL äußere plexiforme Schicht
INL innere nukleäre Schicht
IPL innere plexiforme Schicht
GC Ganglienzellschicht
Legende rechterseits:
BM Bruch-Membran, P Pigmentepithelzelle
R Stäbchen, C Zapfen
Pfeil: Membrana limitans externa
H Horizontalzelle, Bi Bipolarzelle
M Müller-Zelle, A Amakrinzelle
G Ganglienzelle, Ax Axone
Lichteinfall von innen (unten, GC) nach außen (oben, RPE)
Die Ganglienzellschicht (Stratum ganglionare), englisch ganglion cell layer (GCL), enthält die Zellkörper der retinalen Ganglienzellen.
Die Dendriten der Ganglienzellen ziehen in die angrenzende innere plexiforme Schicht (IPL), wo sie sich verzweigen und die Signale von den Bipolarzellen und den Amakrinzellen entgegennehmen. Weitergeleitet an Regionen im Gehirn werden die Signale schließlich über die Axone der Ganglienzellen, welche in der Nervenfaserschicht verlaufen und sich zum Nervus opticus bündeln.
Die Größe der Zellkörper ist verschieden, die Anordnung der Zellen in der peripheren Retina meist einschichtig, in mittleren und zentralen Zonen mehrschichtig. Neben den Ganglienzellen sind in der GCL noch einige Typen von Amakrinzellen ('displaced amacrine cells') und Gliazellen zu finden. Die Dicke der GCL beträgt ca. 20–30 µm.
Innere plexiforme Schicht
In der inneren plexiformen Schicht (Stratum plexiforme internum), englisch inner plexiform layer (IPL), findet eine Stufe der Vorverarbeitung statt, bevor die Information beispielsweise weitergeleitet wird an visuelle Zentren im Gehirn.
Die IPL besteht aus einem dichten Geflecht, das von den Axonterminalen der Bipolarzellen und von Dendriten der Amakrinzellen und der Ganglienzellen gebildet wird. Die Bipolarzellen liefern aufgearbeitete Signale der Photorezeptoren aus den äußeren Retinaschichten. Die IPL lässt sich untergliedern in fünf Subschichten. Diese Struktur ergibt sich aus den Verschaltungen der Bipolarzellen. Die tonischen OFF-Bipolarzellen bilden Synapsen in der ersten Subschicht der IPL. Die phasischen OFF-Bipolarzellen verschalten in der zweiten. Die phasischen ON-Bipolarzellen verschalten in Subschicht vier und die tonischen ON-Bipolarzellen in der fünften.[8]
Die Signalweitergabe wird jeweils durch synaptische Interaktionen mit Amakrinzellen moduliert und erreicht so schließlich die retinalen Ganglienzellen.
Gelegentlich finden sich in der IPL auch Zellkörper von „deplatzierten“ (misplaced) Neuronen, außerdem Neuroglia. Die Dicke dieser Schicht beträgt etwa 50–70 µm.
Innere Körnerschicht
Die innere Körnerschicht (Stratum nucleare internum), englisch inner nuclear layer (INL), enthält die Zellkörper von funktionell stark unterschiedlichen Zellen.
In der INL sind die Zellkörper von Bipolar-, Amakrin- und Horizontalzellen für die Vorverarbeitung von Signalen angesiedelt, sowie die Zellkörper des neuronalen Stützgewebes, der Müller-Zellen. Am weitesten außen liegen die Horizontalzellen, dann folgen die Zellkörper der Bipolarzellen und Müller-Zellen, an der inneren Begrenzung liegen die amakrinen Zellen. Innerhalb der Macula im Wall um die Sehgrube ist die INL mit einem Dutzend Zellreihen besonders dick, sie verjüngt sich peripher auf eine zwei- bis dreireihige Anordnung der Zellkerne. Die Dicke der inneren Körnerschicht beträgt 30 µm.
Äußere plexiforme Schicht
Die äußere plexiforme Schicht (Stratum plexiforme externum), englisch outer plexiform layer (OPL), stellt die Verbindung zwischen Photorezeptoren und den nachgeschalteten Zellen her.
Dendriten der Bipolar- und Horizontalzellen werden mit den synaptischen Enden der Photorezeptoren verschaltet und bilden somit die erste Stufe der intraretinalen Informationsverarbeitung. Diese Schicht enthält auch die Fortsätze der Müllerschen Stützfasern. In der Übergangszone zur nächsten Schicht liegt das tiefere Versorgungsnetz der retinalen Kapillaren, die Abkömmlinge der zentralen Netzhautarterie sind. Diese Gefäße verlaufen sehr konstant in einer Ebene und stoßen kaum in andere Schichten vor. Die Dicke dieser Schicht beträgt etwa 20 µm.
Äußere Körnerschicht
Die äußere Körnerschicht (Stratum nucleare externum), englisch outer nuclear layer (ONL), ist die Schicht der Zellkörper der Photorezeptoren.
Die Zellkörper der Stäbchen und Zapfen sind im ONL parallel nebeneinander gruppiert und erstrecken ihre verdickten lichtsensitiven Fortsätze, die Außensegmente, in Richtung des RPE. Die Kerne der Zapfen liegen in einer einzelnen Schicht nahe der Grenzmembran, die der Stäbchen bilden 4 bis 6 Lagen. Eine Ausnahme von dieser Anordnung besteht beim Menschen in der Fovearegion, in der Zapfen auch mehrschichtig gelagert sind.
Besonders zu vermerken ist, dass in dieser Schicht wesentlich mehr Zellkerne anzutreffen sind, als in der Schicht der Bipolar- und Ganglienzellen. Die Dicke dieser Schicht beträgt etwa 40 µm.
Äußere Grenzmembran (ÄGM)
Die äußere Grenzmembran (Membrana limitans externa), englisch external limiting membrane (ELM), ist eine weitgehend undurchlässige Trennschicht, auch Stratum limitans externum genannt.
Sie wird durch eine horizontal gelegene Reihe von Zelladhäsions-Verbindungen (Zonulae adhaerentes, adhering junctions) gebildet, welche zwischen Ausläufern der Müllerschen Zellen und den Photorezeptorzellen ausgebildet sind. Durch die Lücken dieses fibrillären Netzwerks treten die Innenglieder der Rezeptorzellen. In der Region der Ora serrata setzt sich die äußere Grenzmembran in jene Substanz fort, welche die beiden Schichten des Ziliarepithels verbindet.
Innensegment (IS)
Das Innensegment oder Innenglied, englisch inner segment (IS), besteht aus stoffwechselreichen Kompartimenten der Photorezeptoren.
Das IS ist der Bereich der Photorezeptorzellen, der Mitochondrien und endoplasmatisches Retikulum (ER) enthält. Hier erfolgt unter anderem die Proteinbiosynthese und andere Stoffwechselaktivität. Getrennt werden die inneren von den äußeren Segmenten durch ein schmales Verbindungscilium, durch welche alle Stoffe für das Außensegment aktiv transportiert werden müssen.
Außensegment (AS)
Das Außensegment oder Außenglied, englisch outer segment (OS), ist das lichtsensitive Kompartiment der Photorezeptoren. Hier erstrecken sich die Außensegmente der Photorezeptoren vom Verbindungscilium bis zum RPE. Am Verbindungscilium entstehen neue Diskmembranen, Membranabschnürungen bepackt mit Rhodopsin. Rhodopsin ist in die Disks eingelagert und initiiert die visuelle Signaltransduktion. Durch die Neusynthese bewegen sich diese Disks zum RPE und werden dort phagozytiert.
Retinales Pigmentepithel (RPE)
Das retinale Pigmentepithel (Stratum pigmentosum), englisch retinal pigment epithelium (RPE), ist zunächst ein abschattender Lichtfilter. Dort findet aber auch ein Stoffaustausch mit Photorezeptoren statt.
Mit dem Pigmentepithel, einem hexagonal aufgebauten, einschichtigen Epithel, das aus dem äußeren Blatt des embryonalen Augenbechers hervorgeht, wird die Netzhaut gegen die Aderhaut (Choroidea) abgesetzt. Die Zellen des RPE enthalten durch Melanin schwarz gefärbte Melanosomen, welche funktionell Lichtfilter darstellen. Apikal umgreifen fingerartige, mikrovilläre Fortsätze des RPE die Photorezeptorzellen, welche der Ernährung der Photorezeptoren, dem Recycling der alten Diskmembranen der Photorezeptoraußensegmente sowie der Regeneration des gebleichten Retinals aus aktiviertem Rhodopsin dienen. Basal zeigen diese Zellen tiefe Furchen, die dem besseren Stoffaustausch mit den Blutgefäßen der Choroidea dienen. RPE-Zellen verhindern ein Eintreten von Blut aus der stark vaskularisierten Choriocapillaris (die stark durchblutete Grenzschicht der Aderhaut). In der Pars optica retinae wird die Verbindung zwischen dem RPE und der Neuroretina nur durch einen vom RPE aktiv erzeugten Sog aufrechterhalten, eine feste Verbindung existiert nur an der Ora serrata. Eine Fixierung der RPE-Schicht an die Lamina choriocapillaris erfolgt im übrigen durch die Bruch-Membran.[9]
Erkrankungen der Netzhaut
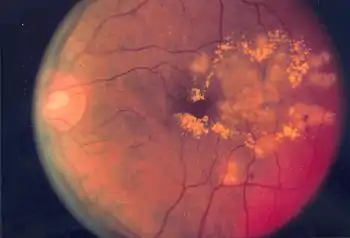
Beispiele für Erkrankungen der Netzhaut sind:[10]
- Diabetische Retinopathie, infolge einer Zuckerkrankheit auftretende Netzhauterkrankung
- hypertensive Retinopathie, durch Bluthochdruck hervorgerufene Netzhauterkrankung
- eklamptische Retinopathie, bei Schwangeren im Rahmen einer Eklampsie auftretende Netzhauterkrankung
- Retinopathia praematurorum, bei Frühgeborenen vorkommende Netzhauterkrankung
- Retinopathia pigmentosa, auch Retinitis pigmentosa (RP) genannte angeborene Netzhautkrankheit
- Retinopathia centralis serosa, schwellungsbedingte zentrale Netzhautabhebung
- Retinoblastom, bösartige Tumore im Säuglings- und Kleinkindalter
- Netzhautdystrophie
- Netzhautablösung
- Netzhautforamen
- Netzhautspaltung
- Gefäßverschlüsse, arteriell mit Ischämie, und Infarkte
- Makuladegeneration
- Makuläre Teleangiektasien
- Azoor Akute zonale okkulte äußere Retinopathie
- periphere Netzhautdegeneration mit Verdünnung der Netzhaut und Glitzerwolken
Acetylsalicylsäure
Eine US-amerikanische Langzeitstudie aus Wisconsin legt die Vermutung nahe, dass die regelmäßige Einnahme von Acetylsalicylsäure möglicherweise zu Netzhautschädigungen führen könne und das Risiko einer altersbedingten Makuladegeneration (AMD) deutlich erhöhe. Ein kausaler Zusammenhang mit der Krankheitsentstehung konnte jedoch nicht nachgewiesen werden.[11][12][13]
Untersuchungsverfahren
Eine Standardmethode zur Untersuchung der Netzhaut stellt die direkte beziehungsweise indirekte Ophthalmoskopie oder Funduskopie (Augenspiegelung) dar. Sie besteht in der Beleuchtung des Augenhintergrundes und der Betrachtung des reflektierten Bildes mit einer Lupe. Seit der Erfindung des Augenspiegels 1851 durch Hermann von Helmholtz ist dieses Verfahren in der ophthalmoskopischen Diagnostik etabliert.
In den letzten Jahrzehnten wurden weitere Verfahren zur Netzhautdiagnostik entwickelt:
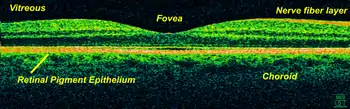
- Eine relativ neue, technisch herausragende und teurere Methode ist die Optische Kohärenztomografie (OCT), die die Abbildung des Untersuchungsgebietes um die dritte Dimension erweitert. Sie ermöglicht die Anfertigung hochauflösender Schnittbilder oder auch dreidimensionaler Tomografien mit einer zum histologischen Bilde vergleichbaren Qualität (Auflösungsvermögen bis 3 µm im Vergleich zu 0,3 µm beim Lichtmikroskop). Hier können die einzelnen Netzhautschichten aufgelöst und in ihrer Dicke vermessen werden. Dadurch lassen sich feinste Unterschiede feststellen, die für die adäquate Therapie bestimmter Netzhauterkrankungen oder auch beim Testen von Medikamenten maßgeblich sein können.
- Weitere bildgebende Verfahren bieten neuartige Scanning-Laser-Ophthalmoskope, wie der Heidelberg Retina Tomograph (HRT), die mittels punkt- oder zeilenweisem Abtasten der Netzhaut und konfokaler Blenden- und Beleuchtungstechnik hochauflösende dreidimensionale Schicht- oder Reliefdarstellungen erzeugen können.
Weitere Untersuchungs- und Beurteilungsmöglichkeiten bestehen auf elektrophysiologischer Ebene durch
- das Elektroretinogramm (ERG)
- das Elektrookulogramm (EOG)
sowie zur Darstellung der retinalen Durchblutung durch
- die Fluoreszenzangiographie (auch FLA, FAG oder Angio abgekürzt)
- die Indocyaningrün-Angiographie
- die Retinale Gefäßanalyse mit dem Retinal Vessel Analyzer, die nicht nur bei Diabetes mellitus, sondern auch zur Diagnostik allgemeiner Veränderungen der Mikrogefäße („Spiegelbild der Mikrovaskulatur“) eingesetzt wird.[14]
Siehe auch
Literatur
- Robert F. Schmidt, Hans-Georg Schaible (Hrsg.): Neuro- und Sinnesphysiologie. 5. Auflage. Springer Verlag, Berlin 2005, ISBN 978-3-540-25700-4.
- Franz Grehn: Augenheilkunde. 30. Auflage. Springer Verlag, Berlin 2008, ISBN 978-3-540-75264-6.
- Albert J. Augustin: Augenheilkunde. Springer Verlag, Berlin 2007, ISBN 978-3-540-30454-8.
- R. W. Young: The ninth Frederick H. Verhoeff lecture. The life history of retinal cells. In: Transactions of the American Ophthalmological Society. Band 81, 1983. S. 193–228, ISSN 0065-9533. PMID 6375087. PMC 1312450 (freier Volltext). (Review).
Weblinks
- Miniaturbildübersicht Netzhaut von Säugetieren
- Dendritic Processing in the Retina
- Das Fotolabor in der Netzhaut. (PDF) In: MaxPlanckForschung, 03/2001
- elektronenmikroskopische Bilder der menschlichen Netzhaut
- The Organization of the Retina and Visual System. Webvision, Webseite des John Moran Eye Centers der Universität Utah zu nahezu allen Aspekten der Säugerretina (englisch)
Einzelnachweise
- Der griechische Anatom Herophilos von Chalkedon hatte bereits im 3. Jahrhundert v. Chr. den Begriff der Netzhaut, griechisch amphiblästroaidäs, zum Vergleich mit einem zugezogenen Fischnetz verwendet und Galenos schrieb in einer, die alten Griechen rezipierenden Schrift „Somit erscheint uns die Gestalt der abgeplatteten Nervenhaut einem Fischernetz ähnlich; deshalb hat man das Gebilde auch Netzhaut genannt.“ Vgl. Julius Hirschberg: Geschichte der Augenheilkunde. 10 Bände (= Handbuch der gesamten Augenheilkunde. 2. Auflage, Band 12–15). Leipzig 1899–1918, Band 12, 1899, S. 19. Zitiert nach Carl Hans Sasse: Geschichte der Augenheilkunde in kurzer Zusammenfassung mit mehreren Abbildung und einer Geschichtstabelle (= Bücherei des Augenarztes. Heft 18). Ferdinand Enke, Stuttgart 1947, S. 23 f.
- Carl Hans Sasse: Geschichte der Augenheilkunde in kurzer Zusammenfassung mit mehreren Abbildungen und einer Geschichtstabelle (= Bücherei des Augenarztes. Heft 18). Ferdinand Enke, Stuttgart 1947, S. 51.
- Wilfried Westheide, Gunde Rieger: Spezielle Zoologie. Teil 2: Wirbel- oder Schädeltiere. Band 1. Spektrum Akademischer Verlag, 2009, ISBN 978-3-8274-2039-8, S. 100 (eingeschränkte Vorschau in der Google-Buchsuche)
- Johannes W. Rohen, Elke Lütjen-Drecoll: Funktionelle Histologie. 4. Auflage. Schattauer, F.K. Verlag, 2000, ISBN 978-3-7945-2044-2, S. 476.
- Peter K. Ahnelt, Helga Kolb: The mammalian photoreceptor mosaic-adaptive design. In: Progress in Retinal and Eye Research. Band 19, Nr. 6, 2000, S. 711–777, doi:10.1016/S1350-9462(00)00012-4
- Imke Ortmann: Live beobachtet: der Richtungsdetektor im Auge. In: Spektrum der Wissenschaft, November 2002, Heft 11, S. 12 ff.
- Joshua R. Sanes, Richard H. Masland: The Types of Retinal Ganglion Cells: Current Status and Implications for Neuronal Classification. In: Annual Review of Neuroscience. Band 38, Nr. 1, 8. Juli 2015, ISSN 0147-006X, S. 221–246, doi:10.1146/annurev-neuro-071714-034120 (annualreviews.org [abgerufen am 27. Januar 2020]).
- Richard H. Masland: The Neuronal Organization of the Retina. In: Neuron, 76, 18. Oktober 2012
- Bruch Membran. In: Norbert Boss (Hrsg.): Roche Lexikon Medizin. 2. Auflage. Hoffmann-La Roche AG und Urban & Schwarzenberg, München 1987, ISBN 3-541-13191-8; S. 244; 5. Auflage 2003: gesundheit.de/roche
- Th. Axenfeld (Begr.), H. Pau (Hrsg.): Lehrbuch und Atlas der Augenheilkunde. Unter Mitarbeit von R. Sachsenweger u. a. Gustav Fischer Verlag, Stuttgart 1980, ISBN 3-437-00255-4.
- Aspirin kann offenbar die Netzhaut schädigen. In: Welt Online. 23. Januar 2013, abgerufen am 21. Januar 2015.
- rme: Acetylsalicylsäure könnte Augenleiden fördern. In: aerzteblatt.de. 19. Dezember 2012, abgerufen am 21. Januar 2015.
- B. E. Klein, K. P. Howard u. a.: Long-term use of aspirin and age-related macular degeneration. In: JAMA, Band 308, Nummer 23, Dezember 2012, S. 2469–2478, doi:10.1001/jama.2012.65406, PMID 23288416, PMC 3630794 (freier Volltext).
- Ronald D. Gerste: Spiegelbild der Mikrovaskulatur. In: Deutsches Ärzteblatt, 115(48), 30. November 2018, S. A2234-A2238.