Metallorganische Chemie
Die metallorganische Chemie in der ursprünglichen Definition ist die Chemie der Verbindungen, in denen ein organischer Rest oder eine organische Verbindung direkt an ein Metallatom gebunden ist. Diese Verbindungen werden als metallorganische oder auch organometallische Verbindungen bezeichnet.
Heute wird der Begriff aber in der Regel weiter gefasst. Man zählt auch Derivate solcher Elemente zu den metallorganischen Verbindungen, die zwar im elementaren Zustand kein Metall bilden, aber eine niedrige Elektronegativität aufweisen wie zum Beispiel Silicium oder Bor. Besser ist es aber in diesen Fällen von elementorganischen Verbindungen (Elementorganyle) zu sprechen.
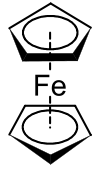
Metall- oder Element-Organyle enthalten also mindestens ein Kohlenstoffatom (C) und mindestens ein Metall- oder elektropositives Elementatom (E), die aneinander gebunden sind. Die E-C-Bindung ist dabei eine mehr oder weniger polare kovalente Bindung. Der Organylrest kann dabei entweder über eine Einfach-, Doppel- oder sogar Dreifachbindung an das Element gebunden sein, oder gleich mehrfach mit dem Elementatom verknüpft sein wie im Ferrocen (siehe unten). Nicht zu den metallorganischen Verbindungen zählen hingegen die Carbide: Stahl ist beispielsweise trotz seines Kohlenstoffgehalts eine Legierung und keine metallorganische Verbindung.
Organische Salze wie Natriumacetat (H3C–COONa, das Natriumsalz der Essigsäure) zählen ebenfalls trotz des Metallions und des vorhandenen Organylrestes (Methylgruppe, H3C– ) nicht zu den metallorganischen Verbindungen. Dieses weist nämlich keine direkte Na-C-Bindung auf. Anstelle dessen ist der Acetatrest vorwiegend ionisch über seine Sauerstoffatome an das Natriumion gebunden. Auch Chlorophyll und Hämoglobin sind nach dieser Definition keine metallorganischen Verbindungen, da bei ihnen das zentrale Magnesium- bzw. Eisenatom von Stickstoffatomen koordiniert wird.
Geschichte

Zu den frühen Entdeckungen in der metallorganischen Chemie zählen Louis Claude Cadets Synthese von mit Kakodyl verwandten Methyl-Arsen-Verbindungen, William Christopher Zeises[1] Platin-Ethylen-Komplex,[2] Edward Franklands Entdeckung des Dimethylzinks und Ludwig Monds Entdeckung des Nickeltetracarbonyls.[3] Bedeutend für die organische Synthese sind die Grignard-Verbindungen, das sind Magnesiumorganyle, die als RMgX abgekürzt werden. Sie wurden von Victor Grignard entdeckt, der dafür zusammen mit Paul Sabatier 1912 den Nobelpreis für Chemie erhielt.
Im industriellen Maßstab wurden Ziegler-Natta-Katalysatoren, Fischer-Tropsch-Katalysatoren und andere metallorganischen Komplexe in Verfahren wie der Hydroformylierung eingesetzt, mit Kohlenstoffmonoxid, Wasserstoff und Olefinen als Einsatzstoffe und Liganden. Für die Entdeckung der metallorganischen Katalysatoren zur Kunststoffherstellung erhielten Karl Ziegler und Giulio Natta 1963 den Nobelpreis für Chemie.
Im 20. Jahrhundert war das Bleitetraethyl PbEt4 die meistproduzierte metallorganische Verbindung, die zur Erhöhung der Klopffestigkeit dem Benzin zugesetzt wurde. Aufgrund ihrer stark giftigen und katalysatorschädigenden Wirkung fanden solche Zusätze jedoch seit den 1980er Jahren immer weniger Verwendung. Es wurden aber als dessen Ersatz andere metallorganische Verbindungen wie Ferrocen und Tricarbonylmethylcyclopentadienylmangan (MMT) untersucht, jedoch fanden diese keinen großtechnischen Einsatz. Ebenfalls wegen schädlicher Nebenwirkungen umstritten sind die Zinnorganyle, wie z. B. Tributylzinn, die als Stabilisatoren in Kunststoffen und zum Schutz von Schiffsrümpfen Verwendung finden.
Einen wesentlichen Aufschwung für die metallorganische Chemie, der die Etablierung als eigenständiges Fachgebiet gefördert hat, brachte die Entdeckung des Ferrocens (Dicyclopentadienyleisen, C5H5–Fe–C5H5) 1951. Die Anerkennung und Bedeutung der metallorganischen Chemie als eigenständiges Gebiet wurde durch die Vergabe der Nobelpreise an Ernst Otto Fischer und Geoffrey Wilkinson[4] unterstrichen. Im Jahr 2005 erhielten Yves Chauvin, Robert H. Grubbs und Richard R. Schrock den Nobelpreis für Chemie für die Metall-katalysierte Alkenmetathese.
Ein Teilbereich der metallorganischen Chemie ist die Biometallorganische Chemie, welche direkte Metall-Kohlenstoff-Bindungen in lebenden Organismen untersucht. Beispiele für derartige Verbindungen sind das Methylcobalamin (Vitamin B12) und das Adenosylcobalamin (Coenzym B12).[5] Die organometallische Bindung besteht im Vitamin B12 aus einer direkten Cobalt-Kohlenstoff-Bindung: ein Cobalt-Atom, das in der Mitte eines Ringsystems (Corrinring) sitzt, ist entweder mit einer Methylgruppe, einem Cyanidion oder mit dem 5'-Kohlenstoff von Desoxyadenosin verknüpft. Diese B12-Stoffgruppe ist somit vermutlich die einzige lebenswichtige, natürlich vorkommende Verbindung, die wegen ihrer direkten Metall-Kohlenstoff-Bindung zu den metallorganischen Verbindungen im engeren Sinne gezählt werden muss.
Einteilung der metallorganischen Chemie
Wichtige Einteilungsschemata für die metallorganischen Verbindungen sind:
- nach dem Metall, zum Beispiel:
- Alkalimetallorganyle, z. B. das für Synthesen verwendete Butyllithium
- Erdalkalimetallorganyle, z. B. Magnesiumorganyle wie die oben erwähnten Grignard-Reagenzien
- Organyle zur Borgruppe, z. B. Aluminiumorganyle wie DIBAL oder welche, die selbstentzündlich sind und in Flammenwerfern verwendet wurden
- Münzmetallorganyle, z. B. organische Kupferverbindungen, Carboplatin
- nach typischen Strukturelementen, zum Beispiel:
- Sandwich-Komplexe – Sie enthalten ein Metallatom oder -ion eingebettet zwischen zwei aromatischen Ringen. Das Bis-cyclopentadienyl-Eisen oder auch Ferrocen ist die bekannteste Sandwich-Verbindung
- Carben-Komplexe – Sie zeichnen sich durch eine Metall-Kohlenstoff-Doppelbindung aus.
- nach der Wertigkeit des Metalls, vor allem bei den Nebengruppenmetallen
Eigenschaften metallorganischer Verbindungen
In der Regel sind Metallorganyle brennbar. Bisweilen sind sie selbstentzündlich (pyrophor) und entflammen spontan an der Luft. Bei den Organylen unedler Metalle verbrennt nicht nur der organische Rest, sondern auch das Metall: Es reagiert zum Metalloxid. Während die Metallatome in einem massiven Metall in eine gut wärmeleitende Umgebung eingebettet sind, sind sie in den metallorganischen Verbindungen atomar fein verteilt, so dass die Reaktion meist heftiger verläuft als bei einem massiven Metall.
Viele Metallorganyle, vor allem die der Alkalimetalle, sind sehr starke Basen – manche zählen zu den stärksten Basen überhaupt. Sie reagieren häufig explosionsartig mit Wasser und sind auch in schwach saurer Umgebung unbeständig.
Luft- oder feuchtigkeitsempfindliche Metallorganyle müssen meist unter Schutzgas oder in einem inerten Lösemittel aufbewahrt und gehandhabt werden (Schlenk-Technik).
Zugehörigkeit des Fachgebiets
Nach der gängigen Definition der Organischen Chemie sind Verbindungen, die Kohlenstoff und Wasserstoff gleichzeitig enthalten, organisch, und demgemäß wären auch die metallorganischen Verbindungen zur Organischen Chemie zu zählen. Andererseits gehört die Chemie der Metalle und Metallionen traditionell zur Anorganischen Chemie. Daher sehen manche eine Einteilung entweder „organisch“ oder „anorganisch“ gerade hier als wenig zweckmäßig an und betrachten die metallorganische Chemie als Bereich, in dem sich die großen Gebiete überlappen – oder gar als eigenständiges Fachgebiet. Andererseits kann es sinnvoll sein, die Unterscheidung anhand des Blickwinkels festzumachen. Liegt der Schwerpunkt der Forschung auf den Eigenschaften des Metalls bzw. Elements, so handelt es sich um Anorganische Chemie. Wird die metallorganische Verbindung hingegen nur als Hilfsmittel zur Modifikation eines rein organischen Moleküls verwendet, so zählt das zur Organischen Chemie. Nur wenn die Kohlenstoff-Metall-Bindung als solche im Mittelpunkt des Interesses steht, wird man von reiner metallorganischer Chemie sprechen.
Die Einordnung von Substanzen wie die Metallcarbonyle (z. B. Tetracarbonylnickel Ni(CO)4), die an Metallatome gebundenes Kohlenmonoxid enthalten, zeigt ebenfalls die Unzulänglichkeit allzu starrer Einteilungsschemata: Kohlenmonoxid wird wie Kohlendioxid traditionell zu den anorganischen Substanzen gerechnet, was nahelegt, dass auch die Metallcarbonyle anorganisch sind. Andererseits bindet CO in den Carbonylkomplexen über sein Kohlenstoffatom an das Metall, und die chemischen Eigenschaften der Carbonylkomplexe legen es nahe, sie in die metallorganische Chemie miteinzubeziehen.
Literatur
- Wolfgang Beck, Kay Severin: Biometallorganische Chemie: Ein faszinierendes Forschungsgebiet. In: Chemie in unserer Zeit. 36, Nr. 6, 2002, S. 356–365 (doi:10.1002/1521-3781(200212)36:6<356::AID-CIUZ356>3.0.CO;2-F).
Einzelnachweise
- L. B. Hunt: The First Organometallic Compounds: William Christopher Zeise and his Platinum Complexes. In: Platinum Metals Rev.. 28, Nr. 2, 1984, S. 76–83.
- W. C. Zeise: Von der Wirkung zwischen Platinchlorid und Alkohol, und von den dabei entstehenden neuen Substanzen. In: Annalen der Physik. 97, Nr. 4, 1831, S. 497–541. doi:10.1002/andp.18310970402.
- Robert H. Crabtree: The organometallic chemistry of the transition metals. John Wiley and Sons, 2009, ISBN 978-0-470-25762-3, S. 2 (eingeschränkte Vorschau in der Google-Buchsuche).
- Geoffrey Wilkinson: Die lange Suche nach stabilen Alkyl-Übergangsmetallverbindungen (Nobel-Vortrag). In: Angewandte Chemie. Band 86, Nr. 18, 1974, S. 664–667, doi:10.1002/ange.19740861803.
- Erwin, Alsfasser, Ralf Riedel: Moderne anorganische Chemie. Gruyter, Berlin [u. a.] 2007, ISBN 978-3-11-019060-1, S. 582.