Quecksilberorganische Verbindungen
Quecksilberorganische Verbindungen (auch als Organoquecksilberverbindungen oder organische Quecksilberverbindungen bezeichnet) sind metallorganische chemische Verbindungen, die mindestens eine kovalente Bindung zwischen Quecksilber(II) und organischen Resten enthalten. Sie haben die allgemeinen Formeln R1-Hg-X oder R1-Hg-R2,[1] wobei R1 und R2 Alkyl- oder Arylgruppen sind und X einen anionischen Bindungspartner darstellt. Die kovalente C-Hg-Bindung ist unter Normalbedingungen gegenüber Luft und Feuchtigkeit stabil, aber lichtempfindlich (photolabil). Bei Lichteinwirkung wird die C-Hg-Bindung unter Bildung von Radikalen homolytisch gespalten.[2] Durch Rekombination der Radikale entsteht aus der Verbindung R1-Hg-X die Verbindung R1-R1. Beispiele für R1 Arylgruppen: Biphenyl-Bildung aus zwei Phenylradikalen und Benzidin-Bildung aus zwei Anilin-Radikalen.[3]
Die Toxizität von quecksilberorganischen Verbindungen[4][5] stellt prinzipiell eine Gefahr da, kann aber bei kontrollierter Verwendung von Nutzen sein. Die Nutzung ist sehr eingeschränkt. Beispielsweise wird Thiomersal als Antiseptikum gemäß der Kosmetik-Verordnung in sehr niedrigen Konzentrationen zur Haltbarmachung von Schmink- und Abschminkmitteln für die Augen verwendet.
Synthese
Quecksilberorganische Verbindungen können auf verschiedenen Wegen synthetisiert werden. Bezüglich ihrer chemischen Reaktivität sind sie palladiumorganischen Verbindungen ähnlich. Die Polarität der Bindung zwischen Kohlenstoff und Quecksilber ändert sich mit der Art des organischen Restes.[6]
Mercurierung von Aromaten
-acetate-from-xtal-1973-2D.png.webp)
Elektronenreiche aromatische Kohlenwasserstoffe werden bei der Behandlung mit Quecksilber(II)-acetat direkt mercuriert. Die am Quecksilberatom verbleibende Acetatgruppe kann durch Chlorid verdrängt werden. Ein Beispiel ist die Synthese von o-Chloromercuriphenol:[7]
- C6H5OH + Hg(O2CCH3)2 → C6H4(OH)–2-HgO2CCH3 + CH3CO2H
- C6H4(OH)–2–HgO2CCH3 + NaCl → C6H4(OH)–2-HgCl + NaO2CCH3
Die erste solche Reaktion, einschließlich einer Mercurierung von Benzol, wurde von Otto Dimroth zwischen 1898 und 1902 berichtet.[8][9][10]
Addition an Alkene (Oxymercurierung)
Das Hg2+-Kation bindet an Alkene und induziert die Addition von Hydroxid (in Gegenwart von Alkoholen Alkoxid). Die Oxymercurierung ergibt allgemein sehr gute Ausbeuten unter sehr milden Bedingungen.[11] Diese Reaktion heißt Hofmann-Sand-Reaktion.[12]
Beispielsweise ergibt die Behandlung von 1-Methylcyclohexen mit Quecksilber(II)-acetat in wässrigem Tetrahydrofuran einen α-Quecksilber-Ester:
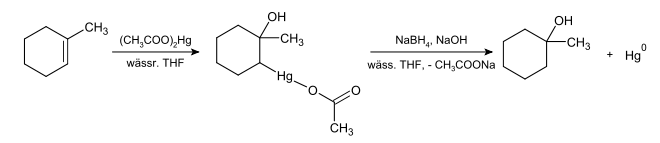
Der α-Quecksilber-Ester kann wie folgt umgesetzt werden:
- Reduktion mit Natriumborhydrid und Natronlauge liefert den Alkohol.
- Die resultierende C-Hg-Bindung kann mit Brom gespalten werden. Es wird das entsprechende Alkyl-Bromid gebildet:
- CH3OCH2CH(HgO2CCH3)CO2CH3 + Br2 → CH3OCH2CHBrCO2CH3 + BrHgO2CCH3
- Analog lassen sich auch Amine oder andere Nukleophile anlagern.[13] So kann an Stelle von Wasser z. B. auch der Alkohol einer Seitenkette intramolekular angreifen und einen cyclischen Ether bilden.
Reaktion von Hg(II)-Verbindungen mit Carbanionen
Ein allgemeiner Syntheseweg zu quecksilberorganischen Verbindungen führt über Alkylierung von Hg(II)-Salzen mit Grignard-Reagenzien[14] oder lithiumorganischen Verbindungen.
Diethylquecksilber resultiert aus der Reaktion von Quecksilberchlorid mit zwei Äquivalenten Ethylmagnesiumbromid, einer Umwandlung, die typischerweise in Diethylether durchgeführt wird.[15] Das resultierende (CH3CH2)2Hg ist eine Flüssigkeit von hoher Dichte (2,466 g/cm3), die bei 57 °C bei 16 Torr siedet. Die Verbindung ist in Ethanol nur leicht, in Ether aber gut löslich.
Ähnlich kann Diphenylquecksilber ( (C6H5)2Hg, Schmelzpunkt 121–123 °C) durch Reaktion von Quecksilberchlorid und Phenylmagnesiumbromid hergestellt werden. Eine ähnliche Präparation verwendet Phenylnatrium in Gegenwart von Quecksilber(II)-Salzen.[16]
Andere Methoden
Hg(II)-Verbindungen können durch Behandlung mit Diazoniumsalzen in Gegenwart von elementarem Kupfer alkyliert werden. Auf diese Weise wurde 2-Chlormercuri-naphthalin hergestellt.[17]
Verwendung
Folgende quecksilberorganische Verbindungen haben (oder hatten) eine Anwendung:
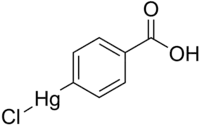 4-Chloromercuri-benzoesäure
4-Chloromercuri-benzoesäure Merbromin
Merbromin Mersalyl
Mersalyl Thiomersal
Thiomersal
Synthesereagenzien
Aufgrund der gut kontrollierbaren Bedingungen, unter denen die Spaltung der C-Hg-Bindung erfolgt, sind quecksilberorganische Verbindungen vielseitige synthetische Reagenzien.
Dichlorcarben-Donor
Phenylquecksilberchlorid kann mit Natriumtrichloracetat zu Phenyl(trichlormethyl)-Quecksilber umgesetzt werden. Diese Verbindung setzt beim Erhitzen Dichlorcarben frei:[18]
- C6H5HgCl + CCl3COONa → C6H5HgCCl3 + CO2 + NaCl.
- C6H5HgCCl3 → C6H5HgCl + CCl2.
Phenyl-Donor
Diphenylquecksilber kann in bestimmten Synthesen als Quelle des Phenylradikals (C6H5·) dienen. Die Behandlung mit Aluminium ergibt Aluminiumtriphenyl:[19]
- 3 Ph2Hg + 2 Al → 2 Ph3Al + 3 Hg
Transmetallierung
Wie erwähnt, reagieren quecksilberorganische Verbindungen mit Halogenen zu dem entsprechenden organischen Halogenid. Quecksilberorganische Verbindungen werden üblicherweise in Transmetallierungsreaktionen mit Lanthanoiden und Erdalkalimetallen eingesetzt.
Die Kreuzkupplung von quecksilberorganischen Verbindungen mit organischen Halogeniden wird durch Palladium katalysiert, was ein Verfahren zur Bildung von C-C-Bindungen liefert. In der Regel verläuft die Reaktion mit geringer Selektivität, die aber in Gegenwart von Halogeniden erhöht werden kann. Die Verwendung von Hg(II)-Reagenzien wurde bei der Carbonylierung von Lactonen unter palladiumkatalysierten Bedingungen demonstriert (C-C-Bindung und Cis-Ester-Bildung).[20]
Bakterizide, Fungizide, Insektizide, Antiseptika, Konservierungsmittel
Die Verwendung von quecksilberorganischen Verbindungen als Bakterizide, Fungizide, Insektizide, Antiseptika oder Konservierungsmittel beruht auf ihrer Toxizität. Ihre Anwendung ist begrenzt.
Falsche Anwendungen und Akkumulation des toxischen Schwermetalls Quecksilber[21] sorgten dafür, dass in Deutschland seit 1982 quecksilberorganische Verbindungen nicht mehr zum Beizen von Saatgut verwendet werden dürfen.[22]
In Deutschland ist Thiomersal als Antiseptikum gemäß der Kosmetik-Verordnung in Konzentrationen bis 0,007 % (berechnet als Quecksilber) zur Haltbarmachung von Schmink- und Abschminkmitteln für die Augen erlaubt.[23]
Der quecksilberhaltige Farbstoff Merbromin wurde in Deutschland bis 2003 in Form einer zweiprozentigen wässrigen Lösung, als Antiseptikum (Handelsname Mercurochrom) vertrieben.[24][25]
Diuretika wie Mersalyl waren früher üblich, wurden aber durch Thiazide und Schleifendiuretika ersetzt, die sicherer sind und länger wirken.
Affinitätschromatographie
Thiole (R-SH), auch bekannt als Mercaptane (lat. mercurium captāns ‚Quecksilber einfangend‘[26][27] aufgrund ihrer Neigung, hochaffin an Quecksilber zu binden), sowie Thiolate (R-S−) und Thioketone (R2C=S), weiche Nukleophile, bilden einen stabilen Koordinationskomplex mit Quecksilber(II), einem weichen Elektrophil.[28]
Dieser Effekt kann verwendet werden, um thiolierte Verbindungen – beispielsweise 2-Thiouridin enthaltende RNA[29] oder Cystein enthaltende Proteine – aus einem Gemisch oder einer biologischen Präparation zu isolieren, indem man eine Affinitätschromatographie mit kovalent an Trägermaterial (beispielsweise Agarose, Sepharose, Glasperlen etc.) gebundenen quecksilberorganischen Verbindungen durchführt.
Titration
4-Chlormercuribenzoesäure kann zur Titration von SH-Gruppen verwendet werden.
Selektive Hemmung
In der biochemischen und biologischen Forschung werden quecksilberorganische Verbindungen wegen ihrer starken Bindung an Cysteingruppen in Proteinen als mehr oder weniger selektive Hemmstoffe verwendet. Die Selektivität bei der Hemmung beruht dabei auf dem organischen Teil der Verbindung.
Ein Beispiel dafür ist die Markierung und Identifizierung des transmembranären Phosphattransporters der Mitochondrienmembran. Bereits bei sehr geringen Konzentrationen (nM-Bereich) hemmt Mersalyl den Transport von Phosphat in die Mitochondrien. Da Mersalyl durch den anionischen organischen Teil membranimpermeabel ist, erfolgt die Hemmung „von außen“, von der zytoplasmatischen Seite. Diese Hemmung ist durch Zugabe von Thiol-Reagenzien (Cystein, Mercaptoethanol etc.) reversibel. Die selektive Markierung erfolgt in den folgenden Schritten:
- Phosphattransport in Mitochondrien wird mit sehr geringen Mengen von Mersaly gehemmt, d. h. die Transporter-SH-Gruppe wird mit Mersalyl „geschützt“.
- Man gibt einen Überschuss des membranpermeablen SH-Reagenzes N-Ethylmaleinimid (NEM), wodurch alle „freien“ SH-Gruppen kovalent und irreversibel blockiert werden.
- Der Überschuss an NEM wird mit Cystein neutralisiert; dabei wird gleichzeitig das „schützende“ Mersalyl entfernt.
- Mitochondreine werden durch Zentrifugation von der Reaktionsmischung (NEM, Cystein und Mersalyl) abgetrennt.
- Die nun verfügbare Phosphattransporter-SH-Gruppe kann mit radioaktivem oder spin-markiertem NEM selektiv markiert werden.[30]
Selektive Aktivierung
Ein Beispiel für die Aktivierung eines Enzyms ist die Protease Prokollagenase aus Fibroblasten der menschlichen Haut, die von vier verschiedenen quecksilberorganischen Verbindungen, 4-Chlormercuribenzoesäure, Mersalyl, 4-Aminophenylquecksilberacetat und Phenylquecksilberchlorid, aktiviert werden kann.[31]
Literatur
- Walter Bosch: Organische Quecksilberverbindungen, Hörning & Berkenbusch (1901).
- Peter Rach: Synthesen und Reaktionen optisch aktiver Organoquecksilberverbindungen, Juris (1974), ISBN 978-3-260-03676-7.
- Christoph Elschenbroich: Organometallchemie, Springer-Verlag (2009), S. 77 ff., ISBN 978-3-8351-9223-2.
Weblinks
- 1967 Evaluations of some Pesticide Residues in Food: Organomercury compounds. International Programme on Chemical Safety.
- Organomercury Compounds. In: Comparative Toxicogenomics Database. Mount Desert Island Biological Laboratory.
- Safety data for a typical organomercury compound: phenylmercuric hydroxide
Siehe auch
Einzelnachweise
- Lexikon der Chemie: Quecksilberorganische Verbindungen; abgerufen am 6. April 2017.
- Entwicklung und Anwendung eines neuartigen Analysenverfahrens zur Bestimmung quecksilberorganischer Verbindungen in Sedimenten mit Hilfe eines gekoppelten SFC-AFS-Systems. Universität Hamburg e-Dissertation, 1998, abgerufen am 10. August 2015.
- Naarmann, Herbert; Naegele, Dieter: Durch oxidative Polymerisation erhältliche Polymere. 19. Juni 1987, abgerufen am 1. August 2015.
- H. Hintermann: Organomercurials. Their Formation and Pathways in the Environment (= Metal Ions in Life Sciences), Band 7. RSC publishing, Cambridge 2010, ISBN 978-1-84755-177-1, S. 365–401.
- M. Aschner, N. Onishchenko und S. Ceccatelli: Toxicology of Alkylmercury Compounds (= Metal Ions in Life Sciences), Band 7. RSC publishing, Cambridge 2010, ISBN 978-1-84755-177-1, S. 403–434.
- Russell N. Grimes: Metal Interactions with Boron Clusters. Springer Science & Business Media, 11 November 2013, ISBN 978-1-4899-2154-3, S. 209.
- Whitmore F. C., Hanson E. R.: o-Chloromercuriphenol In: Organic Syntheses. 4, 1925, S. 13, doi:10.15227/orgsyn.004.0013; Coll. Vol. 1, 1941, S. 161 (PDF).
- Otto Dimroth: Directe Einführung von Quecksilber in aromatische Verbindungen. In: Berichte der deutschen chemischen Gesellschaft. 31, Nr. 2, 1898, S. 2154–2156. doi:10.1002/cber.189803102162.
- Otto Dimroth: Ueber die Einwirkung von Quecksilberoxydsalzen auf aromatische Verbindungen. In: Berichte der deutschen chemischen Gesellschaft. 32, Nr. 1, 1899, S. 758–765. doi:10.1002/cber.189903201116.
- Otto Dimroth: Ueber die Mercurirung aromatischer Verbindungen. In: Berichte der deutschen chemischen Gesellschaft. 35, Nr. 2, 1902, S. 2032–2045. doi:10.1002/cber.190203502154.
- Beyer-Walter, Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998, ISBN 3-7776-0808-4.
- K. A. Hofmann und J. Sand: Ueber das Verhalten von Mercurisalzen gegen Olefine. In: Berichte der deutschen chemischen Gesellschaft. 33, Nr. 1, 1900, S. 1340–1353. doi:10.1002/cber.190003301231.
- F. A. Carey, R. J. Sundberg, Organische Chemie, Wiley-VCH Verlag, 2004, ISBN 3-527-29217-9.
- Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 547, ISBN 3-342-00280-8.
- W.A. Herrmann (Hrsg.): Synthetic Methods of Organometallic and Inorganic Chemistry Volume 5, Copper, Silver, Gold, Zinc, Cadmium, and Mercury, ISBN 3-13-103061-5.
- Calvery, H. O.: Diphenylmercury In: Organic Syntheses. 4, 1941, S. 54–55, doi:10.15227/orgsyn.009.0054; Coll. Vol. 1, 1941, S. 228 (PDF).
- A. N. Nesmajanow: β-Naphthylmercuric Chloride In: Organic Syntheses. 12, 1932, S. 54, doi:10.15227/orgsyn.012.0054; Coll. Vol. 2, 1943, S. 432 (PDF).
- T. J. Logan: Phenyl(trichloromethyl)mercury In: Organic Syntheses. 46, 1966, S. 98, doi:10.15227/orgsyn.046.0098; Coll. Vol. 5, 1973, S. 969 (PDF).
- T. A. Neely, William W. Schwarz und Herbert W. Vaughan: Triphenylaluminium In: Organic Syntheses. 45, 1965, S. 107, doi:10.15227/orgsyn.045.0107; Coll. Vol. 5, 1973, S. 1116 (PDF).
- Pavel Kočovský: Reactivity control in palladium-catalyzed reactions: a personal account, J. Organometallic Chemistry 687 (2003), S. 256–268. doi:10.1016/j.jorganchem.2003.07.008.
- Michael Binnewies, Maik Finze, Manfred Jäckel, Peer Schmidt, Helge Willner und Geoff Rayner-Canham: Allgemeine und Anorganische Chemie. Springer-Verlag, 2. Dezember 2016, ISBN 978-3-662-45067-3, S. 836.
- Saskia Dombrowski: Berichte zur Lebensmittelsicherheit 2009: Nationale Berichterstattung an die EU - Nationaler Rückstandskontrollplan (NRKP) und Einfuhrrückstandskontrollplan (ERKP) - Bericht zur amtlichen Futtermittelkontrolle 2009. Springer-Verlag, 22. Juni 2011, ISBN 978-3-0348-0128-7, S. 43.
- Anlage 6 zu § 3 der Kosmetik-Verordnung.
- Merbromin im Spiegel der Expertenmeinungen. In: Pharmazeutische Zeitung. Ausgabe 39/2003.
- Neues Rezeptur-Formularium: Quecksilber zur Anwendung auf der Haut (PDF).
- Oxford American Dictionaries (Mac OS X Leopard).
- Dictionary.com: mercaptan
- Jonathan Clayden, Nick Greeves und Stuart Warren: Organic Chemistry. OUP Oxford, 15. März 2012, ISBN 978-0-19-927029-3, S. 658.
- Masao Ono and Masaya Kawakami: Separation of Newly-Synthesized RNA by Organomercurial Agarose Affinity Chromatography. In: J. Biochem.. 81, Nr. 5, 1977, S. 1247–1252. PMID 19428.
- E. Quagliariello und F. Palmieri: Structure and Function of Membrane Proteins: Proceedings of the International Symposium on Structure and Function of Membrane Proteins Held in Selva Di Fasano (Italy), May 23–26, 1983. Elsevier, 21 May 2014, ISBN 978-1-4831-6290-4, S. 43–52.
- G. P. Stricklin, J. J. Jeffrey, W. T. Roswit and A. Z. Eisen: Human skin fibroblast procollagenase: mechanisms of activation by organomercurials and trypsin, Biochemistry (1983), Bd. 22(1), S. 61–68. PMID 6299336.